修回日期: 2004-06-09
接受日期: 2004-06-24
在线出版日期: 2004-09-15
目的: 表达Fas配体(fas ligand, FasL)的肿瘤周围激活的Fas阳性淋巴细胞凋亡异常增加. 肿瘤的发生在很大程度上是因为转化的细胞不能正常凋亡所致. 观察Fas与FasL在结肠癌细胞株的表达, 在体外验证结肠癌细胞SW620是否可以诱导淋巴细胞发生凋亡.
方法: 用免疫组织化学SABC法观察结肠癌细胞系和Jurkat T淋巴细胞系Fas与FasL的表达, 为癌细胞的Fas和FasL的功能提供形态学依据.采用非放射性细胞毒分析, 测定SW620结肠癌细胞与Jurkat靶细胞共培养后LDH释放值检测效应细胞的杀伤效应.
结果: 结肠癌SW620细胞FasL染色呈阳性反应, 阳性反应物主要定位于癌细胞的胞膜及核周区, 而Fas染色几乎呈阴性反应. Jurkat细胞系Fas, FasL免疫组化染色呈阳性反应, 阳性反应物主要定位于癌细胞的胞膜. CytoTox96â非放射性细胞毒分析显示大肠癌SW620细胞系与激活的T细胞(Jurkat T细胞)共培养, 诱导对Fas介导的凋亡敏感的T淋巴细胞(Jurkat T 细胞)明显凋亡, 并随着SW620接种浓度增加和共培养时间的延长, Jurkat T细胞凋亡的比例显著增加. 用含有乙酸肉豆佛波醇(phorbol 12-myristate 13-acetate , PMA)加离子霉素(ionomycin)的DMEM培养基孵育48 h的大肠癌SW620细胞系与激活的T细胞(Jurkat T细胞)共培养, Jurkat T细胞凋亡的比例也明显增加.
结论: 结肠癌细胞SW620表达功能性FasL, 能杀伤Fas阳性Jurkat T淋巴细胞, 形成免疫逃逸.
引文著录: 徐彤, 李强, 郝希山. 大肠癌细胞功能性Fas配体的表达度与肿瘤免疫逃逸的关系. 世界华人消化杂志 2004; 12(9): 2066-2069
Revised: June 9, 2004
Accepted: June 24, 2004
Published online: September 15, 2004
AIM: The evidence has pointed to an abnormal increase in apoptosis among activated Fas-positive lymphocytes, mainly in the periphery of the Fas ligand (FasL)-expressing tumors. On the other hand, to a great extent, the occurrence of tumor is due to the fact that the converted cells cannot undergo a normal process of apoptosis. This study was designed to detect the expression of FasL in human colon carcinoma cells and to determine whether colon cancer cells SW620 could induce apoptosis of lymphocytes by Fas system in vitro.
METHODS: By using immunohistochemical SABC method, the expression of Fas receptor and Fas ligand in SW620 colon carcinoma cell line and Jurkat T cells was observed so as to supply morphological evidence for the functions of Fas receptor and Fas ligand. In an effort to examine the cytotoxicity of effector cells, CytoTox 96â non-radioactive cytotoxicity assay was adopted to measure LDH releasing value after the SW620 cells were co-cultured with the Jurkat T lymphocytes.
RESULTS: It was shown that the Fas ligand of colon carcinoma SW620 cells was positive and the positive substances were distributed in the cell membrane and cytoplasm, and the Fas receptor of colon carcinoma SW620 cells was negative. The Fas receptor and the Fas ligand of Jurkat T lymphocytes turned out to be positive. The positive substances were distributed in the cell membrane. The non-radioactive cytotoxicity assay showed that the apoptotic rate of Jurkat cells remarkably increased with the increase of planting concentration of SW620 and co-cultured time with the Jurkat T lymphocytes. The cytotoxicity was significantly enhanced by PMA and ionomycin.
CONCLUSION: The functional expression of FasL in the colon carcinoma SW620 cells can inversely induce apoptosis of Fas-expressing Jurkat T lymphocytes for immune escape.
- Citation: Xu T, Li Q, Hao XS. Relationship between expression of functional Fas ligand in human colon cancer cells and tumor's immune escape. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2066-2069
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2066.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2066
Fas抗原(APO-1/CD95)与Fas配体(fas ligand, FasL)组成的Fas系统, 在将凋亡信号转导入细胞内发挥重要作用. 效应细胞FasL结合靶细胞Fas抗原后, 在数小时内通过细胞凋亡途径使靶细胞死亡. 研究证实表达FasL的肿瘤周围激活的Fas阳性淋巴细胞凋亡异常增加[1-3]. 另一方面, 肿瘤的发生在很大程度上是因为转化的细胞不能正常凋亡所致[4-9]. 把表达Fas的T淋巴细胞和表达FasL的肿瘤细胞的体外相互作用作为本项目的研究对象, 探讨结肠癌细胞能否通过自身Fas/FasL系统的变化对Fas介导凋亡途径的抵抗使其免受自杀和他杀, 从而逃避机体的免疫监控, 甚至通过表达FasL使肿瘤对机体免疫系统进行优先攻击或反击.
SW620 细胞系是美国组织培养库(ATCC)收录的人大肠癌细胞系(爱尔兰库克大学Joe O′Connell博士赠予). Jurkat细胞系是美国组织培养库(ATCC)收录的人急性T淋巴细胞白血病的T淋巴细胞(中国医科院血液病研究所提供). TJ905细胞系是人脑胶质瘤细胞系(天津环湖医院细胞室张文治主任赠予). 离子霉素(ionomycin)和乙酸肉豆佛波醇(phorbol 12-myristate 13-acetate PMA)及PHA(phytohaemagglutinin)购自美国Sigma公司. RPMI1640培养液和DMEM培养液购自Gibco公司; 胎牛血清购自Hyclone公司; 人FasmAb和人FasLmAb购自北京中山生物技术有限公司; 通用型SABC试剂盒购自武汉博士德生物公司; CytoTox96âNon-Radioactive Cytotoxicity Assay试剂盒购自美国Promega公司. CO2细胞培养箱, 倒置显微镜, 病理图像分析仪, 低温冰箱, 超净工作台, 酶标仪(labsystem multiscann MS), 细胞涂片机均由天津医科大学肿瘤研究所提供.
SW620细胞系和TJ905细胞系呈贴壁生长, 培养液为含100 mL/L胎牛血清(FBS), 100 mg/L链霉素, 100 kU/L青霉素的DMEM, 37 ℃, 50 mL/L CO2孵箱内培养. Jurkat细胞系呈悬浮生长, 培养液为含100 mL/L胎牛血清, 100 mg/L 链霉素, 100 kU/L青霉素的RPMI1640, 37 ℃, 50 mL/L CO2孵箱内培养. 我们在进行免疫组织化学SABC染色前, Jurkat细胞用含有PHA(4 mg/L)[10]RPMI1640(100 mL/L FBS)培养基孵育24 h, 同时用不含有PHA的RPMI1640 (100 mL/L FBS)培养基孵育24 h作为对照.
1.2.1 免疫组织化学SABC染色: 准备无菌玻璃片, 大培养皿. Jurkat 细胞为悬浮细胞(RPMI1640, 100 mL/L FBS), 用甩片机甩片, 铺片. TJ905和SW620(DMEM, 100 mL/L FBS), 为上皮型贴壁细胞, 用无菌载玻片进行爬片48 h. 用无水乙醇固定载玻片20 min, 用蒸馏水反复冲洗, 浸泡在30 mL/L H2O2 25-30 min, 用蒸馏水反复冲洗, 用PBS浸泡载玻片平衡5-10min, 用正常血清滴片, 滴加1:200的抗Fas或FasLmAb, 4 ℃湿盒内孵育过夜, PBS冲洗后, 滴加1:200的羊抗兔lgG室温下孵育4 h, 最后滴加1:100的SABC复合物于室温下孵育2 h后DAB显色, 镜下观察以控制反应强度. 用PBS代替第一抗体作为阴性对照, 其余步骤同SABC方法.两种抗体的免疫反应阳性细胞均呈棕黄色颗粒状, 背景不着色或呈淡黄色, 阳性细胞易于识别. 两种对照实验均为阴性反应.
1.2.2 体外杀伤实验: 采用CytoTox96â 非放射性细胞毒分析盒, 测定效应细胞SW620和TJ905(对照组)与Jurkat靶细胞共培养后LDH释放值检测效应细胞的杀伤效应. 参照试剂盒推荐程序操作. 在进行细胞介导的细胞毒分析前, Jurkat靶细胞用含有PHA(4 mg/L)[10]RPMI1640 (50 mL/L FBS)培养基孵育24 h后, 离心弃上清, 加入RPMI1640, 吹打成细胞悬液, 滴板计数. SW620和TJ905两种效应细胞用含有10 mg/L PMA加500 mg/L离子霉素的DMEM(100 mL/L FBS)[10]培养基孵育48 h, 同时这两种效应细胞用不含 PMA加离子霉素的DMEM(100 mL/L FBS)培养基孵育48 h, 用胰酶和EDTA分别消化后, 分别取消化上清离心, 弃上清, 各加入1 mL DMEM(100 mL/L FBS), 吹打成细胞悬液. 滴板计数并各用含100 mL/L FBS的培养液DMEM(两种效应细胞用含有10 mg/L PMA加500 mg/L离子霉素的DMEM培养基, 同时这两种效应细胞用不含有 PMA加离子霉素的DMEM培养基对照), 分别调整细胞浓度系列稀释为2×109/L, 1×109/L, 5×108/L, 2.5×108/L, 1.25×108/L, 接种于96孔培养板, 每孔100 mL, 每种浓度均设3个复孔, 于37 ℃, 50 mL/L CO2培养箱内孵育24 h, 待细胞完全贴壁并均匀覆盖80%后, 除去陈旧的培养液上清, 将2×104 个Jurkat细胞移入, 换含50 mL/L 胎牛血清(FBS)的无酚红RPMI1640培养液至每孔100 mL. 然后, 离心含靶细胞和效应细胞的培养板5 min (250×g, 4 ℃)以确保效应细胞和靶细胞接触. 同时测定靶细胞LDH自发释放值、靶细胞LDH最大释放值、效应细胞LDH自发释放值、体积校正对照值和培养基背景对照值. 应用如下公式计算杀伤效应: 杀伤效应(%)=(实验组A值-效应细胞自发释放A值-靶细胞自发释放A值)/(靶细胞最大释放A值-靶细胞自发释放A值)×100.
统计学处理 采用方差分析, 由SPSS10.0统计软件完成.
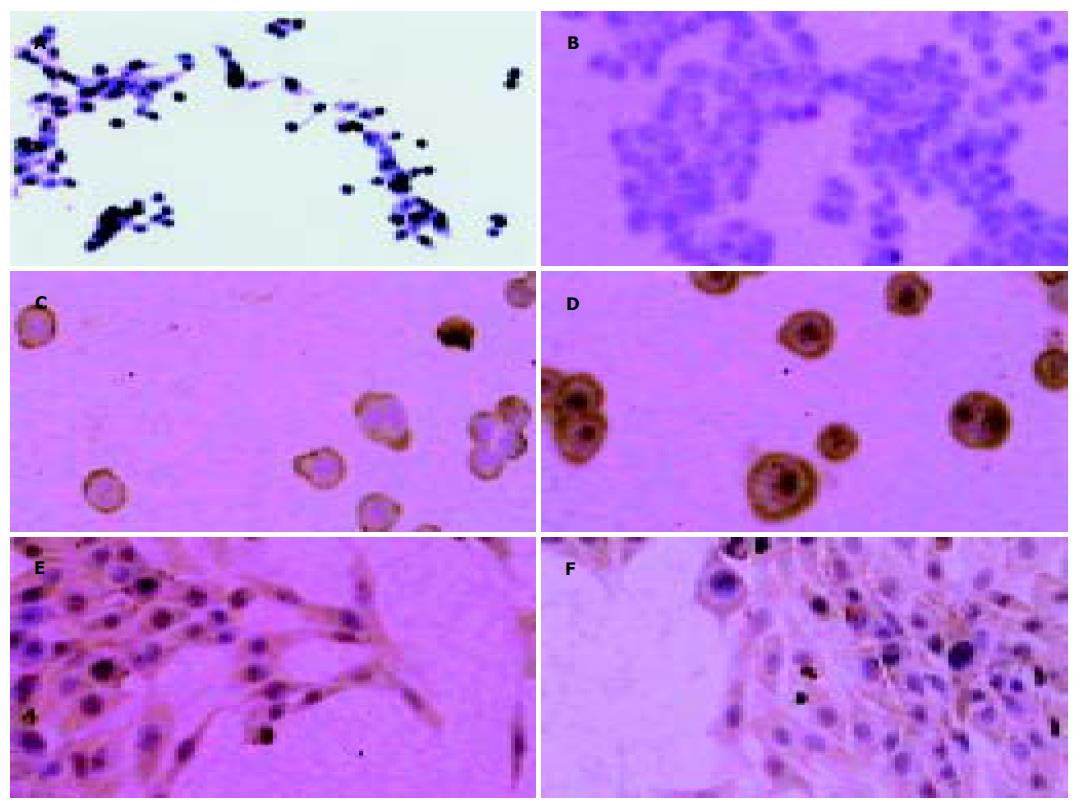
结肠癌SW620细胞FasL染色呈阳性反应, 阳性反应物主要定位于癌细胞的胞膜及核周区(图1A), 其余区域则相对浅染, 而Fas染色几乎呈阴性反应(图1B). Jurkat细胞系Fas, FasL免疫组化染色呈阳性反应, 阳性反应物主要定位于癌细胞的胞膜, 其余区域则相对浅染, 胞核呈阴性反应. (图1C, D). TJ905细胞Fas染色呈阳性, 阳性反应物主要定位于癌细胞的胞膜与胞质, 散在分布(图1E), 而FasL呈弱阳性反应, FasL阳性反应物主要定位于癌细胞的胞膜与胞质, 散在分布(图1F).
SW620介导的细胞毒分析, 在E:T为10:1, 5:1, 2.5:1, 1.25:1和0.62:1效应细胞SW620与Jurkat靶细胞共培养4h细胞毒杀伤效应分别为14.9%, 10.5%, 6.9%, 5.8%和3.4%, 统计学差异显著(F = 3.45, P <0.05). SW620效应细胞用含有10mg/L PMA加500 mg/L离子霉素的DMEM(100 mL/L FBS)培养基孵育48 h后, SW620细胞与Jurkat细胞进行共培养, 在E:T为10:1, 5:1, 2.5:1, 1.25:1和0.62:1效应细胞SW620与Jurkat靶细胞共培养4 h细胞毒杀伤效应分别为74.6%, 40.8%, 32.4%, 10.9%和4.2%, 统计学差异显著(F = 8.19, P <0.05). 在E:T为5:1, 2.5:1, 1.25:1和0.62:1效应细胞SW620与Jurkat靶细胞共培养8 h细胞毒杀伤效应分别为83.9%, 74.1%, 28.5%和21.4%, 统计学差异显著(F = 137.04, P <0.05). SW620用含有PMA和离子霉素的DMEM(100 mL/L FBS)孵育48 h后与用不含有PMA和离子霉素的DMEM(100 mL/L FBS)孵育48 h后, 2组间及2组内不同比例的SW620细胞与Jurkat细胞进行共培养4h细胞毒作用效果差异显著(P <0.01, 表1). 用含有PMA和离子霉素的DMEM(100 mL/L FBS)孵育48 h后的SW620与Jurkat细胞进行共培养4 h细胞毒作用效果明显高于用不含有PMA和离子霉素的DMEM(100 mL/L FBS)孵育48 h后的SW620与Jurkat细胞进行共培养4 h细胞毒作用效果(P <0.01). SW620(不同比例的SW620细胞)与Jurkat细胞进行共培养8 h细胞毒作用效果明显高于SW620(不同比例的SW620细胞)与Jurkat细胞进行共培养4 h细胞毒作用效果(P <0.01, 表1).
| 差异源 | F (加药) | P-value | F (8 h) | P -value |
| 样本 | 27.71 031 | 1.11E-05 | 475.9 873 | 2.47E-17 |
| 列 | 10.29 316 | 2.28E-05 | 77.62 379 | 1.7E-12 |
| 交互 | 5.137 621 | 0.002 832 | 51.09 462 | 1.43E-10 |
不同比例的TJ905细胞与Jurkat细胞共培4h细胞毒杀伤效果无统计学意义(F = 0.25, P = 0.782), TJ905细胞与Jurkat细胞共培养4 h对Jurkat细胞无细胞毒杀伤效果. 不同比例的TJ905细胞与Jurkat细胞共培养8 h细胞毒杀伤效果无统计学意义(F = 2.92, P = 0.105), TJ905细胞与Jurkat细胞共培养8 h对Jurkat细胞无细胞毒杀伤效果. 不同比例的TJ905细胞(加药)与Jurkat细胞共培养4 h细胞毒杀伤效果无统计学意义(F = 0.04, P = 0.965), TJ905细胞与Jurkat细胞共培养4 h对Jurkat细胞无细胞毒杀伤效果. TJ905(不同比例的TJ905细胞)与Jurkat细胞进行共培养8 h细胞毒作用效果与TJ905(不同比例的TJ905细胞)Jurkat细胞进行共培养4h细胞毒作用效果无统计学差异(P = 0.934). 用含有PMA和离子霉素的DMEM (100 mL/L FBS)孵育48 h后的TJ905与Jurkat细胞进行共培养4 h细胞毒作用效果与不含有PMA和离子霉素的DMEM(100 mL/L FBS)孵育48 h后的TJ905与Jurkat细胞进行共培养4 h细胞毒作用效果无统计学差异(P = 0.927). 细胞毒分析表明TJ905人脑胶质瘤细胞系与激活的T细胞(Jurkat T细胞)共培养, 不能诱导对Fas介导的凋亡敏感的T淋巴细胞(Jurkat T 细胞)的凋亡.
正常人体淋巴细胞表达Fas抗原, 经某些因素(如炎症、肿瘤抗原)刺激后, Fas抗原表达上调. 细胞毒性T淋巴细胞(CTL)是杀伤肿瘤细胞的主要细胞[11], 由于CTL在体外难以分离培养, 我们选用Jurkat细胞替代肿瘤浸润淋巴细胞. SW620细胞系, 是美国组织培养库(ATCC)收录的人大肠癌细胞系, 其组织来源为结肠腺癌的肝转移淋巴结. 本研究进一步证实肿瘤细胞通过Fas抗原丢失逃避体内Fas系统对其清除作用, 还通过自身表面的FasL与激活的T淋巴细胞表面的Fas结合, 诱导T细胞发生凋亡, 逃避免疫系统的监视. 肿瘤细胞通过Fas/FasL途径诱导T淋巴细胞凋亡, 逃避免疫监视的机制可分为2步: 肿瘤拮抗Fas/FasL介导的凋亡和肿瘤通过Fas/FasL系统反击T淋巴细胞[12-13]. 研究表明大肠癌细胞表达功能性FasL, 能同时诱导表达Fas的肝细胞凋亡, 形成肝转移灶[14-16]. 研究显示PMA加离子霉素显著上调SW620的FasL蛋白表达水平[17], 本研究证实PMA和离子霉素刺激能显著增强大肠癌的细胞毒活性. 肿瘤细胞与机体淋巴细胞的Fas/FasL表达与肿瘤免疫逃逸密切相关, 这为临床预防肿瘤转移、复发又提供了一新思路. 观察Fas/FasL表达及信号传导过程对于评价根治性治疗后(根治性手术、放化疗)肿瘤患者状态具有重要作用. 根治性治疗之后患者淋巴细胞及体内残存的肿瘤细胞的凋亡与增生情况是决定肿瘤是否转移复发的一个重要因素, Fas/FasL表达与淋巴细胞、肿瘤细胞的凋亡密切相关. 肿瘤细胞表达FasL, 使免疫细胞通过Fas途径凋亡, 从而逃避机体免疫系统的监视: 这又给肿瘤免疫提供一种新思路, 即恢复肿瘤细胞对Fas/FasL介导凋亡的敏感性或阻断Fas/FasL介导的对T细胞的杀伤作用.
总之, Fas/FasL系统介导的凋亡在肿瘤免疫中发挥着重要作用, 在CTL杀伤肿瘤细胞的效应机制; 维持肿瘤的免疫逃逸等方面为肿瘤的基因治疗和过继免疫治疗提供了新的方案和对策. 肿瘤细胞通过Fas途径诱导T细胞凋亡, 代表着一种新的肿瘤免疫逃逸机制. 更加深入地研究Fas和FasL表达调控机制以及他们介导的凋亡信号的传导, 无疑将有助于明确Fas/FasL系统介导的凋亡在肿瘤发生和发展以及治疗具有重大的意义, 也可能会给肿瘤的治疗提供新的手段和方法.
| 2. | Houston A, Bennett MW, O'Sullivan GC, Shanahan F, O'Connell J. Fas ligand mediates immune privilege and not inflammation in human colon cancer, irrespective of TGF-beta expression. Br J Cancer. 2003;89:1345-1351. [PubMed] [DOI] |
| 3. | Bennett MW, O'Connell J, O'Sullivan GC, Brady C, Roche D, Collins JK, Shanahan F. The Fas counterattack in vivo: apoptotic depletion of tumor-infiltrating lymphocytes associated with Fas ligand expression by human esophageal carcinoma. J Immunol. 1998;160:5669-5675. [PubMed] |
| 4. | Zhu Q, Deng C. [The role of Fas/Fas ligand in tumorgenesis, immune escape, and counterattack in colonic cancer]. Zhonghua Neike Zazhi. 2002;41:378-380. [PubMed] |
| 5. | French LE, Tschopp J. Defective death receptor signaling as a cause of tumor immune escape. Semin Cancer Biol. 2002;12:51-55. [PubMed] [DOI] |
| 6. | Houston A, O'Connell J. The Fas signalling pathway and its role in the pathogenesis of cancer. Curr Opin Pharmacol. 2004;4:321-326. [PubMed] [DOI] |
| 7. | Kim R, Emi M, Tanabe K, Uchida Y, Toge T. The role of Fas ligand and transforming growth factor beta in tumor progression: molecular mechanisms of immune privilege via Fas-mediated apoptosis and potential targets for cancer therapy. Cancer. 2004;100:2281-2291. [PubMed] [DOI] |
| 8. | Yanagisawa J, Takahashi M, Kanki H, Yano-Yanagisawa H, Tazunoki T, Sawa E, Nishitoba T, Kamishohara M, Kobayashi E, Kataoka S. The molecular interaction of Fas and FAP-1. A tripeptide blocker of human Fas interaction with FAP-1 promotes Fas-induced apoptosis. J Biol Chem. 1997;272:8539-8545. [PubMed] [DOI] |
| 9. | Ivanov VN, Lopez Bergami P, Maulit G, Sato TA, Sassoon D, Ronai Z. FAP-1 association with Fas (Apo-1) inhibits Fas expression on the cell surface. Mol Cell Biol. 2003;23:3623-3635. [PubMed] [DOI] |
| 10. | Müschen M, Moers C, Warskulat U, Even J, Niederacher D, Beckmann MW. CD95 ligand expression as a mechanism of immune escape in breast cancer. Immunology. 2000;99:69-77. [PubMed] [DOI] |
| 11. | Saff RR, Spanjaard ES, Hohlbaum AM, Marshak-Rothstein A. Activation-induced cell death limits effector function of CD4 tumor-specific T cells. J Immunol. 2004;172:6598-6606. [PubMed] [DOI] |
| 12. | Graban J, Kohút A. [Apoptosis in T-lymphocytes and its significance]. Cesk Fysiol. 2003;52:144-152. [PubMed] |
| 13. | Webb SD, Sherratt JA, Fish RG. Cells behaving badly: a theoretical model for the Fas/FasL system in tumour immunology. Math Biosci. 2002;179:113-129. [PubMed] [DOI] |
| 14. | Shiraki K, Tsuji N, Shioda T, Isselbacher KJ, Takahashi H. Expression of Fas ligand in liver metastases of human colonic adenocarcinomas. Proc Natl Acad Sci USA. 1997;94:6420-6425. [PubMed] [DOI] |
| 15. | Hayashi H, Kohno H, Ono T, Yamanoi A, Dhar DK, Ueda S, Rahman MA, Kubota H, Nagasue N. Transforming growth factor-beta1 induced hepatocyte apoptosis--a possible mechanism for growth of colorectal liver metastasis. Acta Oncol. 2004;43:91-97. [PubMed] [DOI] |
| 16. | Yokomizo H, Yoshimatsu K, Ishibashi K, Hashimoto M, Yosida K, Kato H, Naritaka Y, Okada Y, Ogawa K. Fas ligand expression is a risk factor for liver metastasis in colorectal cancer with venous invasion. Anticancer Res. 2003;23:5221-5224. [PubMed] |