修回日期: 2004-06-19
接受日期: 2004-06-24
在线出版日期: 2004-09-15
目的: 探讨荧光定量聚合酶链式反应(FQ-PCR)扩增P53基因作为检测胃癌血行微小转移方法的可行性及其表达的临床意义.
方法: 应用对胃癌患者转移(n = 12)和无转移组(n = 18)的外周血的基因进行检测, 分析这两组基因的表达与胃癌转移复发之间的关系, 并将FQ-PCR与普通PCR的敏感性进行比较.
结果: 胃癌患者30例, 在转移组中P53基因表达检出为58.3%(7/12); 而无转移组中为11.1%(2/18). 两组比较, 具有显著性差异(P<0.01), 表明外周血癌基因表达与转移复发是相关的, 其他病种患者外周血中无阳性表达, 而28名健康献血员中均为阴性.
结论: P53基因可作为胃癌微小转移的重要指标, FQ-PCR是检测微小转移的敏感方法, 对胃癌的早期诊断和预测微小转移有一定的临床价值.
引文著录: 刘中宏, 李春明, 王秀江, 龙培滨. 胃癌微转移基因检测的临床应用. 世界华人消化杂志 2004; 12(9): 2033-2035
Revised: June 19, 2004
Accepted: June 24, 2004
Published online: September 15, 2004
AIM: To analyze feasibility of amplifying P53 gene by FQ-PCR in micrometastasis detection of gastric cancer.
METHODS: PCR and FQ-PCR were used to detect the peripheral blood carcinoma gene in the metastased group (n = 12) and non-metastased group (n = 18) of gastric cancer, to evaluate the correlation between gene expression and micrometastasis in gastric cancer and the sensitivity of PCR and FQ-PCR.
RESULTS: P53 expression rate was 58.3% (7/12) in the metastased group, and 11.1% (2/18) in the non-metastased group. There was significant difference between the two groups (P <0.01).
CONCLUSION: P53 may be an important marker of micro-metastasis. FQ-PCR can be used to detect micrometastases of gastric cancer for early diagnosis.
- Citation: Liu ZH, Li CM, Wang XJ, Long PB. Clinical application of gene detection in micrometastases of gastric cancer. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2033-2035
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2033.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2033
转移是恶性肿瘤的重要特征, 也是判断预后及影响肿瘤治疗效果的主要原因. 胃癌是我国常见的恶性肿瘤之一, 目前对其局部原发肿瘤, 采取手术为主的治疗方法基本可以控制, 但根治术后的肿瘤复发和转移率高达50%左右. 早期认识有无肿瘤转移、转移方式及范围, 对临床诊断、治疗及预后的判断具有重要意义. 近年来, 随着免疫学, 尤其是分子生物学的发展, 使胃癌的微转移检测成为可能. 我们采用聚合酶链式反应(PCR)结合荧光定量(FQ-PCR), 通过扩增癌基因, 对发生转移及未转移的胃癌患者及健康献血者的外周血中癌基因表达进行检测分析, 探讨外周血中癌基因表达与胃癌转移复发之间的关系, 以及FQ-PCR作为检测微小转移方法的可能性.
2001-01/2002-10手术后经病理组织学证实的并有转移的胃癌患者12例; 手术后经病理组织学证实的无转移胃癌患者18例; 胃溃疡、胃炎和胃息肉病等胃良性疾病10例; 健康献血员对照28名.
每例术前采集静脉血5 mL, EDTA抗凝, DNA提取按试剂操作说明. PCR引物的设计由上海基因研究所合成(见表1), 荧光定量PCR应用美国ABI生产的PE 5700全自动荧光检测设备进行检测, 反应结束后, 由电脑自动分析出结果. 普通PCR检测均按常规方法. 反应结束后, 电泳, 紫外线下观察结果. PCR 50 mL反应体系包括: cDNA 20 mL, 10倍buffer 5 mL, MgCl2 (25 mmol/L) 3mL, dNTPs(1 010 mmol/L)1 mL, Taq酶1 u, 引物(20 pmol/L)1 mL, 荧光探针(10 mol/L)1 mL, 加去离子水至总体积50 mL. 94℃, 2 min, 预变性, 94 ℃, 45 s, 60 ℃, 78 s, 40个循环. 反应结束后, 由电脑自动分析计算出定量结果.
| 外显子 | 引物序列 | 大小(bp) |
| 5 | 5'-CTCTTCCTGCAGTACTCCCTGC-3' | 335 |
| 5'-CCCAGCTGCTCACCATCGCTA-3' | ||
| 6 | 5'-GATTGCTCTTAGGTCTCCCCCTC-3' | 23 |
| 5'-CCACTGACAACCACCCTTAACC-3 ' | ||
| 7 | 5'-GTGTTCTCTCCTAGGTTGGCTG-3' | 213 |
| 5'-CAAGTGGCTCCTGACCTGGAGTC-3' | ||
| 8 | 5'-ACCTGATTTCCTTACTGCCTCTGGC-3' | 167 |
| 5'-GTCCTGCTTGCTTACCTGGAGTC-3 ' |
统计学处理 实验数据进行χ2检验.
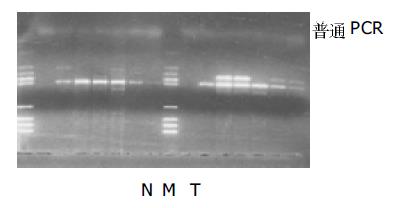
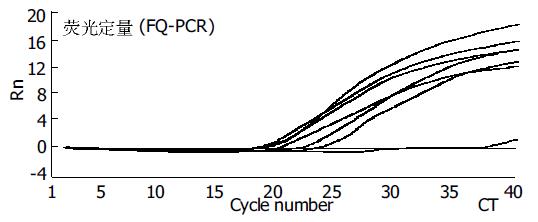
胃癌转移组有1例P53在普通PCR为阴性, 而在FQ-PCR则为阳性, (图1, 2). 表明FQ-PCR较普通的PCR更为敏感. FQ-PCR检测P53基因在胃癌转移组比胃癌无转移组、胃良性病组和健康献血者中的表达差异有显著意义(P <0.01)(表2).
微转移为恶性实体肿瘤播散并存活于淋巴系统、血循环、骨髓、肝、肺等组织器官中的微小肿瘤细胞灶, 常无任何临床表现, 是造成转移和复发的主要原因. 常规检查方法如CT、MRI, 单抗放射显影技术, 普通病理检查等都很难发现, 借助活体显微电视系统可直接检测到手术中癌细胞的播散. 基因检测方法是通过对肿瘤标志物进行PCR检测来诊断微转移. PCR技术可准确检测1 g组织或1 mL液体中的1个癌细胞[1], 癌细胞进入血液是肿瘤发生远处转移的先决条件. 杨万勇et al[2]报告CEAmRNA检测是预测胃癌微转移的有效指标, 血中CEAmRNA阳性提示肿瘤的早期转移, 且阳性率随肿瘤的分期而增高[3], 也有研究[4]表明CK20mRNA 可以作为检测胃癌, 结肠癌, 胰腺癌患者外周血微转移的靶RNA. CEAmRNA敏感性低, 但较CK19mRNA和CK20mRNA可靠[5]. 还有研究[6]显示以CK19mRNA为靶RNA比CK20mRNA更可靠. Shin et al[7]曾以RT-PCR方法检测胃癌患者外周血中不同靶RNA的表达情况, 表明hTERTmRNA可作为血中胃癌细胞的靶RNA. 目前, 应用何种靶RNA检测胃癌患者外周血的微转移最为可靠仍需进一步研究, 但检测外周血微转移对预测预后, 指导治疗的重要意义是不可否认的. P53基因突变是胃癌变过程中的常发事件, 50-86%以上胃癌中存在P53基因突变, 且这种改变常发生在良性肿瘤向恶性肿瘤过渡时期. 因而, P53基因突变的检测, 对胃癌的早期筛选、诊断有着重要意义. 荧光定量PCR技术则在常规PCR基础上, 添加了1条标记了2个荧光基团的双标记探针. 二者可构成能量传递结构, 当有特异性PCR扩增发生时, 探针会在PCR过程中被Taq酶5'-3'活性作用切断, 抑制作用消失, 从而引起荧光信号的变化, 当信号增强到某一阈值, 此时的循环次数(CT值)就被记录下来. 该循环参数和PCR体系中起始DNA量的对数值之间有严格的线性关系, 从而达到相对定量的目的. FQ-PCR 在定性的同时相对定量, 增强了可比性; 采用闭管检测避免了交叉污染, 加入的荧光探针大大增强了特异性, 结果客观可靠. 用于微小转移具有更大的优越性. 目前有人用于乙型肝炎病毒的研究[8], 但未见有将该方法用于检测胃癌微小转移的报道. 我们利用普通PCR结合FQ-PCR扩增P53基因, 其中FQ-PCR 的检出率高于普通PCR法, 提示该方法具有更高的敏感性, 同时本研究检测了12例胃癌转移患者, 18例胃癌无转移患者, 10例胃良性患者, 和28名健康者的外周血中P53基因表达, 发现其特异性表达于胃癌患者的外周血中, 尤其是胃癌转移的患者中, 阳性率58.3%(7/12), 而无转移者的阳性率为11.1%(2/18), 两组比较, 差异显著. 而在其他组的患者及正常健康者的外周血中则无表达, 提示胃癌患者P53 阳性是由脱落到循环中的肿瘤细胞产生的, 也就意味着外周血微转移的存在, 说明P53基因的检测对于胃癌的早期诊断和判断微小转移等具有重要的临床应用价值. 本试验胃癌转移组中有5例P53表达阴性, 可能是由单一点采集标本处于癌细胞释放的间歇期, P53低水平表达, 达不到检测的限度要求.胃癌无转移组2例P53表达阳性, 经随访6 mo、7 mo出现转移迹象, 提示P53基因检测在诊断胃癌早期转移方面有重要意义. 血行转移是胃癌的一种主要转移途径. 我们发现, 胃癌转移者的外周血中具有较高比例(58.3%)的癌细胞转移, 反映出胃癌血性转移的重要性, 微转移的存在意味着预后较差[9], 因此, 了解外周血微转移的情况, 可帮助临床医生判断肿瘤患者预后. 对于外周血检测到微转移的胃癌患者, 应密切追踪随访, 定期检查, 并积极给与针对性辅助或补救性治疗会大大提高胃癌总体的治疗效果. 因为早期胃癌也可发生微转移, 所以微转移的检测应成为肿瘤分期的一部分常规[10], 从而为制定个体化的综合治疗方案提供依据. 荧光定量PCR是近年出现的新技术, 极大地提高了检测的敏感性和特异性, 我们首次将其用于胃癌外周血微小转移的检测, 提高了检测的准确性, 为胃癌微小转移的检测提供了新的更为敏感的方法, 可能对诊断早期转移, 指导临床治疗和判断预后产生深刻影响.
| 1. | Funaki NO, Tanaka J, Itami A, Kasamatsu T, Ohshio G, Onodera H, Monden K, Okino T, Imamura M. Detection of colorectal carcinoma cells in circulating peripheral blood by reverse transcription-polymerase chain reaction targeting cytokeratirr-20 mRNA. Life Sci. 1997;60:643-652. [DOI] |
| 3. | Nishida S, Kitamura K, Ichikawa D, Koike H, Tani N, Yamagishi H. Molecular detection of disseminated cancer cells in the peripheral blood of patients with gastric cancer. Anticancer Res. 2000;20:2155-2159. [PubMed] |
| 4. | Chausovsky G, Luchansky M, Figer A, Shapira J, Gottfried M, Novis B, Bogelman G, Zemer R, Zimlichman S, Klein A. Expression of cytokeratin 20 in the blood of patients with disseminated carcinoma of the pancreas, colon, stomach, and lung. Cancer. 1999;86:2398-2405. [PubMed] [DOI] |
| 5. | Ikeguchi M, Ohro S, Maeda Y, Fukuda K, Yamaguchi K, Shirai H, Kondo A, Tsujitani S, Kaibara N. Detection of cancer cells in the peripheral blood of gastric cancer patients. Int J Mol Med. 2003;11:217-221. [PubMed] [DOI] |
| 6. | Majima T, Ichikura T, Takayama E, Chochi K, Mochizuki H. Detecting circulating cancer cells using reverse transcriptase-polymerase chain reaction for cytokeratin mRNA in peripheral blood from patients with gastric cancer. Jpn J Clin Oncol. 2000;30:499-503. [PubMed] [DOI] |
| 7. | Shin JH, Chung J, Kim HO, Kim YH, Hur YM, Rhim JH, Chung HK, Park SC, Park JG, Yang HK. Detection of cancer cells in peripheral blood of stomach cancer patients using RT-PCR amplification of tumour-specific mRNAs. Aliment Pharmacol Ther. 2002;16 Suppl 2:137-144. [PubMed] [DOI] |
| 9. | Kodera Y, Nakanishi H, Ito S, Yamamura Y, Kanemitsu Y, Shimizu Y, Hirai T, Yasui K, Kato T, Tatematsu M. Quantitative detection of disseminated free cancer cells in peritoneal washes with real-time reverse transcriptase-polymerase chain reaction: a sensitive predictor of outcome for patients with gastric carcinoma. Ann Surg. 2002;235:499-506. [PubMed] [DOI] |