修回日期: 2004-05-02
接受日期: 2004-06-10
在线出版日期: 2004-08-15
目的: 研究RAR-βmRNA在食管癌发生发展过程中的作用, 探讨维A酸(RA, retinoid acid)在食管癌高危人群中化学预防和化学治疗中应用的可行性.
方法: 应用原位杂交方法检测了食管癌70例 (原位癌30例, 鳞状细胞癌20例, 腺癌20例) 及增生性病变97例 (单纯增生19例, 不典型增生I-III分别为20例, 39例, 38例) 和正常食管黏膜鳞状上皮组织19例中RAR-β mRNA表达情况.
结果: 在正常食管黏膜上皮、单纯增生、不典型增生上皮总体及其I-III、原位癌、侵袭性鳞状细胞癌及腺癌中RAR-β mRNA表达的阳性率分别为100%(19/19), 94.7%(18/19), 90%(18/20), 69.2%(27/39), 68.4%(26/38), 63.3%(19/30), 60%(12/20), 60%(12/20). 正常食管黏膜上皮较不典型增生总体、原位癌和侵袭癌组织均有显著性差异(P<0.05).
结论: RAR-β mRNA表达的丢失与食管癌的发生发展有关, 用RA对表达RAR-β高危人群进行化学干预可能会得到预期效果.
引文著录: 王立峰, 张丽红, 刘明, 张伟, 王吾如. 食管癌发生发展过程中RAR-β mRNA的原位表达. 世界华人消化杂志 2004; 12(8): 1980-1982
Revised: May 2, 2004
Accepted: June 10, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1980-1982
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1980.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1980
RA(retinoid acid, 维A酸)对食管癌细胞系的生长抑制和RAR-β (retinoid acid receptor beta, 维A酸β受体)的表达和表达上调有关, 不表达RAR-β的细胞系对RA有抵抗力, 可以在软琼脂糖中形成集落[1].为研究RAR-β在食管癌发展过程中表达的改变, 以及应用RA在食管高危人群中进行化学预防的可行性, 我们对205例一系列食管活检组织, 包括正常食管黏膜、单纯增生、不典型增生食管上皮、原位癌和侵袭性癌组织中RAR-βmRNA的表达情况用非放射性原位杂交方法进行了研究.
取自河北磁县1997年食管癌普查食管活检组织195例, 经病理诊断: 侵袭性鳞状细胞癌20例, 原位癌30例, 腺癌10例, 不典型增生I, II, III级分别为20例, 39例, 38例, 单纯增生19例和正常食管黏膜鳞状上皮19例. 其中哈医大一院标本腺癌10例. 地高辛配基核酸标记和检测试剂盒为Boehinger mannheim公司产品. 质粒PSG5(分别含RAR-β-antisense cDNA和RAR-β-sense cDNA, 酶切位点分别为sphI和BamHI), 由中国医学科学院肿瘤研究所生物检测中心提供. BL21大肠杆菌由医科院基础所提供.
探针的制备: 重组质粒的转化、扩增、提取、纯化、酶切及酶切片段回收纯化参照"分子克隆"的方法进行, 酶切电泳鉴定纯化质粒DNA及其酶切片段. 探针的标记按试剂盒说明操作. 杂交步骤按文献[2]方法进行, NBT/BCIP显色, 用正义探针作阴性对照. 结果分析采用计数资料的结构相对数(%)表示, 统计学分析采用Fisher's检验.
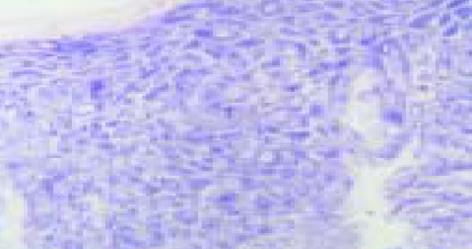
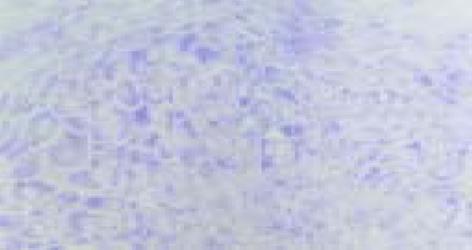
RAR-β mRNA阳性信号位于细胞质, NBT/BCIP染色为蓝紫色(图1, 2). 正常黏膜、单纯增生、不典型增生总体及其I, II, III级、原位癌、侵袭性鳞状细胞癌、腺癌的杂交阳性率分别为100%(19/19), 94.7%(18/19), 73.2%(71/97), 90%(18/20), 69.2%(27/39), 68.4%(26/38), 63.3%(19/30), 60%(12/20), 60%(12/20). 正常黏膜、单纯增生的阳性信号普遍高于或相当于不典型增生和侵袭癌组织.
维A酸及其衍生物对恶性与正常细胞的分化诱导和生长抑制起重要作用[3-6], 维A酸的这些功能是由维A酸受体所介导的, 维A酸只有通过与其特异的核内受体结合才能发挥其生物学效应, 因此对所研究组织中维A酸受体的检测将对肿瘤发生研究有很大意义. 维A酸受体属于类固醇/甲状腺激素受体超家族, 现已发现两大类受体可调节维A酸及其内源性和合成的化合物的生物学作用, 即维A酸受体(RARs)和维A类X受体(RXRs), 都有三个亚基 α, β和γ. 在动物实验和临床研究中, RAR-β的表达与恶性实体瘤的密切相关.
将RAR-β基因转染至表达RAR-β的肺上皮样癌肿细胞中, 然后接种于裸鼠, 该细胞的生长受抑制, 不能形成肿瘤; 而在表达反义RAR-β2的转基因鼠中, 则可形成肺癌[7]. 在头颈部鳞状细胞癌中, RAR-β在邻近头颈部肿瘤正常组织和单纯增生表达率为70%, 不典型增生为56%, 恶性肿瘤为35%; RAR-α分别为94%, 77%, 70%; 而RAR-γ和RXR-α, β可在大部分头颈部肿瘤邻近正常组织、单纯增生、不典型增生和肿瘤中检测到[2]; 在乳腺癌中, RAR-β的表达率在邻近肿瘤正常组织为98.0%, 导管原位癌83.1%, 侵袭癌51.6%; RAR-α分别为98.1%, 96.8%, 83.6%; RAR-γ分别为93%, 88.5%, 88.5%; 而RXR-α分别为100%, 100%, 92%[8]. 即在恶性肿瘤中RAR-β基因较其他受体基因表达下降明显, 故RAR-β表达的丢失与恶性实体瘤的关系较为密切. 为研究RAR-β在食管癌发展过程中表达的改变, 我们对205例一系列食管活检组织, 包括正常食管黏膜、单纯增生、不典型增生食管上皮、原位癌和侵袭性癌组织中RAR-β基因的表达情况用非放射性原位杂交方法进行了研究. 结果表明, RAR-β在正常组织中100%表达, 不典型增生上皮中70%表达, 60%的侵袭性鳞状细胞癌中表达阳性, 其表达丢失率与文献报道的头颈癌、乳癌和非小细胞肺癌的研究结果相似[2,8-9]. 这说明RAR-β mRNA表达的丢失与食管癌的发生发展有关, 我国是食管癌的高发区, 用RA对表达RAR-β阳性高危人群进行化学干预可能会得到预期效果.
虽然已经发现实体瘤的发生与RAR-β的表达丢失, 但其内在的机制仍不清楚[10]. 我们知道RAR-α, RAR-β和RAR-γ定位在17q21.1, 3p24和12q13; RXR-α, β和γ分别定位在9q34.3, 6p21.3和1q22-23. 然而定位于3p24的RAR-β, 其3p的杂合性丢失仅在大约30%的食管癌检测到[11], 且与RAR-β的表达无关. 我们知道RXRs和RARs在结合到DNA顺序前形成二聚体, 这些二聚体与位于靶基因启动子的维A酸作用反应元件(RARE)结合, RARE以(A/G)GGTCA用2个或5个核苷酸间隔的重复为特征, 从而调节靶基因的转录、表达, 发挥其作用. 因此在最近的研究中发现, 全反式RAR诱导的β RARE转录活性的丢失才可能是RAR-β表达丢失的主要原因. 但也可能有多重机制与RAR-β表达丢失有关, 有待进一步研究.
编辑: N/A
| 1. | Xu XC, Liu X, Tahara E, Lippman SM, Lotan R. Expression and up-regulation of retinoic acid receptor-beta is associated with retinoid sensitivity and colony formation in esophageal cancer cell lines. Cancer Res. 1999;59:2477-2483. [PubMed] |
| 2. | Xu XC, Ro JY, Lee JS, Shin DM, Hong WK, Lotan R. Differential expression of nuclear retinoid receptors in normal, premalignant, and malignant head and neck tissues. Cancer Res. 1994;54:3580-3587. [PubMed] |
| 3. | Lotan R. Effects of vitamin A and its analogs (retinoids) on normal and neoplastic cells. Biochim Biophys Acta. 1980;605:33-91. [PubMed] [DOI] |
| 4. | Moon RC, Mehta RG, Rao KVN. Retinoids and cancer in experimental animals.The Retinoids-Biiology, Chemistry, and Medicine. New York: Raven Press 1994; pp537-596. |
| 5. | Inayama Y, Kitamura H, Shibagaki T, Usuda Y, Ito T, Nakatani Y, Kanisawa M. In vivo growth and differentiation potential of tracheal basal cells of rabbits in vitamin A deficiency. Int J Exp Pathol. 1996;77:89-97. [PubMed] [DOI] |
| 6. | Han J. Highlights of the cancer chemoprevention studies in China. Prev Med. 1993;22:712-722. [PubMed] [DOI] |
| 7. | Bérard J, Laboune F, Mukuna M, Massé S, Kothary R, Bradley WE. Lung tumors in mice expressing an antisense RARbeta2 transgene. FASEB J. 1996;10:1091-1097. [PubMed] |
| 8. | Xu XC, Sneige N, Liu X, Nandagiri R, Lee JJ, Lukmanji F, Hortobagyi G, Lippman SM, Dhingra K, Lotan R. Progressive decrease in nuclear retinoic acid receptor beta messenger RNA level during breast carcinogenesis. Cancer Res. 1997;57:4992-4996. [PubMed] |
| 9. | Xu XC, Sozzi G, Lee JS, Lee JJ, Pastorino U, Pilotti S, Kurie JM, Hong WK, Lotan R. Suppression of retinoic acid receptor beta in non-small-cell lung cancer in vivo: implications for lung cancer development. J Natl Cancer Inst. 1997;89:624-629. [PubMed] [DOI] |
| 11. | Nakamura Y, Tokino T, Isomura M. Multistep carcinogenesis of esophageal carcinoma. Molecular Pathology of Gastroenterology Cancer. Edited by E Tahara. Tokoyo: Spring-Verlag 1997; pp15-21. [DOI] |