修回日期: 2004-05-20
接受日期: 2004-06-17
在线出版日期: 2004-08-15
目的: 探讨正常人肠上皮细胞(intestinal epithelial cells, IEC)的分离、体外培养方法, 为研究IEC以及与IEC相关疾病建立合适的细胞模型.
方法: 正常结肠黏膜取自外科手术的大肠恶性肿瘤患者距肿瘤10 cm的结肠组织, 联合运用I型胶原酶和嗜热菌蛋白酶消化分离IEC, 接种于含多种促IEC生长的营养成分的DMEM培养液内, 根据IEC和成纤维细胞贴壁时间的差异并运用胶原酶来纯化IEC, 通过观察IEC生长状态、形态特征、超微结构及检测上皮细胞膜抗原对IEC进行鉴定.
结果: 联合运用I型胶原酶和嗜热菌蛋白酶消化1 h可分离出健全绒毛隐窝单位, 2 wk左右细胞可铺满整个玻片. 免疫细胞化学检测该细胞为阳性细胞, 纯度高.
结论: 联合运用I型胶原酶和嗜热菌蛋白酶, 可分离培养出高纯度未凋亡的ICE.
引文著录: 张安平, 刘宝华, 张连阳, 王亚旭, 李春穴. 正常人结肠上皮细胞体外培养和鉴定. 世界华人消化杂志 2004; 12(8): 1966-1968
Revised: May 20, 2004
Accepted: June 17, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1966-1968
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1966.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1966
肠道是人体重要的消化和吸收器官, 肠上皮细胞(intestinal epithelial cells, IEC)处于机体与外界抗原接触的第一线, 近年来源于大肠上皮细胞的恶性肿瘤发病率呈上升趋势[1-3], 而正常大肠上皮细胞再分化能力较差, 体外培养未凋亡肠上皮细胞困难大, 如何改进正常成人肠上皮细胞的分离培养成为研究课题之一. 国内外对IEC生理功能、药物作用及各种致病因素作用下的病理生理改变的研究资料多来自培养实验动物细胞和人结肠癌细胞. 国外对于正常成人肠上皮细胞分离培养的报道也较少, 国内鲜有报道. 因此, 原代培养正常成人肠上皮细胞对于研究ICE以及与ICE相关疾病具有重要意义.
我科住院经病理证实确诊为大肠癌的患者, 术前征询患者同意, 手术中取距肿瘤至少10 cm的正常结肠组织. DMEM培养基(Hyclone)按说明分别配制, 加入青霉素100 000 U/L, 链霉素250 mg/L, 庆大霉素125 mg/L, 制菌霉素125 mg/L, 过滤除菌, 冻存备用; 培养基中加入Hepes 20 mmoL/L, NaHCO3 1.97 g/L, 丙酮酸钠 110 mg/L, 胰岛素 200 U/L, 肝素钠 100 mg/L、FCS 50 mL/L均购自Hyclone公司, 表皮生长因子0.01 mg/L和牛垂体提取物5 mg/L购自Sigma公司. I型胶原酶0.2 g/L, 嗜热菌蛋白酶消化液25 mg/L, 溶于Hepes缓冲液中. 小鼠抗人上皮细胞膜抗原单克隆抗体购自Santa Cruz公司; SABC免疫组化染色试剂盒及DAB显色试剂盒由武汉博士德生物工程有限公司提供, 其他试剂均为分析纯试剂.
手术中所取正常结肠组织, 立即用含抗生素的D-Hanks液冲洗肠黏膜至干净, 所取黏膜组织立即放入4 ℃的D-Hanks液中迅速带回实验室. 将肠黏膜剪成碎片约1 mm×1 mm的小块, 转入10 mMDTT的50 mL Hanks液的50 mL离心管中室温下15 min, 800 g离心5 min. 把沉淀转入150 mL三角烧瓶中, 加入嗜热菌蛋白酶消化酶液约50 mL, 37 ℃震荡30 min, 可见消化液变浑浊, 800 g离心5 min. 将沉淀转入I型胶原酶20 mL, 37 ℃震荡30 min, 100 g离心10 min. 用Hanks液10 mL将沉淀反复吹打5 min, 400 μm分样筛过滤后收集过滤液, 再用80 μm分样筛过滤, 反转分样筛用Hanks冲洗, 收集冲洗液, 100 g离心5 min, 将细胞沉淀悬浮于培养基中, 种植在25 cm2塑料培养瓶中, 置37 ℃, 50 mL/L CO2孵箱内培养. 90 min后, 把培养液连同未贴壁的细胞转入新培养瓶中. 每48 h更换培养液1次. 约14 d融合成片. 传代: 用5 g/L的胰蛋白酶消化后, 接种到新的塑料培养瓶中, 在第1次传代的前3 d加入0.05 g/L的I型胶原酶, 种植密度为(1-5)×109/L, 继续培养. 在倒置显微镜下, 常规观察IEC生长状态、形态特征. 用胰蛋白酶消化肠上皮细胞后, 收集于离心管内, 500 g离心10 min, 去上清, 加入适量25 g/L戊二醛固定, 行常规超薄切片, 用透射电镜进行超微结构观察. 把盖玻片切割成适当大小, 高压灭菌后, 放进24孔板孔内, 然后加入含200 mL/L FCS的培养液2 mL, 留置1-2 d后, 吸弃培养液, 接种IEC细胞悬液, 待细胞长满后取出盖玻片, 按照SABC免疫组化染色试剂盒及DAB显色试剂盒说明书进行免疫细胞化学检测. 一抗为小鼠抗人上皮细胞膜抗原mAb(稀释比例为1∶200). 阴性对照: 一抗用PBS替代.
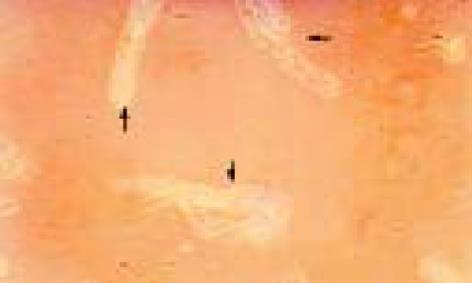
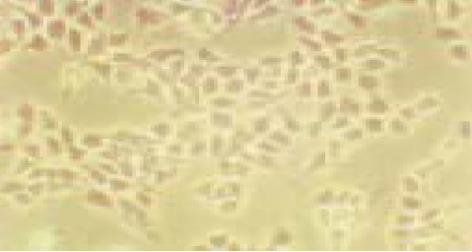
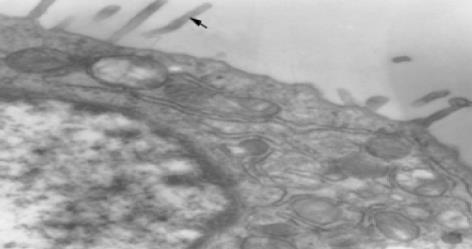
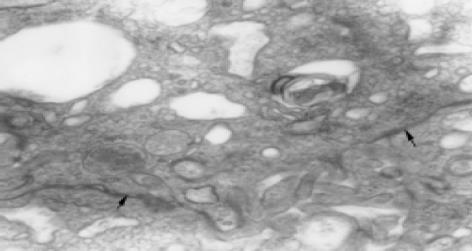
联合运用I型胶原酶和嗜热菌蛋白酶进行消化分离可成功分离出大量的健全绒毛隐窝单位, 全部16例标本均可见分离出的健全绒毛隐窝单位,其中13例成功培养出肠上皮细胞, 培养成功率为81%(图1). 1-2 d绒毛隐窝单位贴壁, 然后开始"长出"梭状细胞, 向周围蔓延, 1 wk左右形成细胞群落, 约2 wk融合成片. 光镜下见原代培养IEC单层生长, 多呈扁平多角状、椭圆状, 或短梭状, 核仁1-2个, 胞质丰富, 边界清楚(图2). 电镜观察第2代IEC细胞表面可见微绒毛, 胞内含有丰富的线粒体、内质网等, 细胞贴壁期间形成紧密连接, 符合肠上皮细胞特征(图3, 4). 第2代IEC上皮细胞膜抗原几乎100%呈阳性(胞膜呈棕黄色), 而阴性对照胞膜无染色(图5).
成人结肠上皮细胞培养的组织可来源于纤维结肠镜下钳取和外科手术切除的标本黏膜[4-6], 培养方法不断改进但国外报道的方法各有特点[7-8]. 嗜热菌蛋白酶被用于分离肺和支气管上皮细胞及真皮中角质形成细胞等, 具有分离产量高、分离下的细胞活力强等特点, 因此可用于肠上皮细胞的分离[9]. Baten et al[10]运用多种细胞分离液进行肠上皮细胞的分离, 发现联合运用I型胶原酶和EDTA进行分离其细胞数量高, 培养成活率较高. 我们联合运用I型胶原酶和嗜热菌蛋白酶能分离下较多的健全绒毛隐窝单位, 而健全绒毛隐窝单位是体外分离成功培养IEC的一个关键因素. 红细胞、白细胞和成纤维细胞等单细胞可通过80 μm 分样筛, 反转冲洗得到隐窝细胞. 为了减少细胞的凋亡应尽量缩短切取标本到进入实验室分离的间隔时间, 并运用二硫苏糖醇予以保护. Grossmann et al[11]报道间隔时间最好控制在10 min内. IEC贴壁和分化能力差, 我们运用I型胶原包被塑料培养器皿或采用留置含高浓度血清培养液的方法可使IEC更易于贴壁.
在原代培养接种90 min后把培养液连同未贴壁的细胞转入新培养瓶中继续培养. 由于成纤维细胞具有贴壁快的特点, 而IEC贴壁需12-24 h, 这样新培养瓶中的细胞基本是纯化的IEC, 在第1次传代的前3 d 在培养基中加入I型胶原酶, 使成纤维细胞消化而进一步纯化细胞, 运用免疫组化得到证实, 纯化后的IEC上皮细胞膜抗原阳性, 而成纤维细胞和平滑肌细胞上皮细胞膜抗原呈阴性. 电镜法观察细胞的超微结构如微绒毛、细胞间连接等进一步鉴定IEC.
编辑: N/A
| 1. | Qing SH, Rao KY, Jiang HY, Wexner SD. Racial differences in the anatomical distribution of colorectal cancer: a study of differences between American and Chinese patients. World J Gastroenterol. 2003;9:721-725. [PubMed] [DOI] |
| 3. | Kim JI, Park YJ, Kim KH, Kim JI, Song BJ, Lee MS, Kim CN, Chang SH. hOGG1 Ser326Cys polymorphism modifies the significance of the environmental risk factor for colon cancer. World J Gastroenterol. 2003;9:956-960. [PubMed] [DOI] |
| 4. | Pedersen G, Saermark T, Giese B, Hansen A, Drag B, Brynskov J. A simple method to establish short-term cultures of normal human colonic epithelial cells from endoscopic biopsy specimens. Comparison of isolation methods, assessment of viability and metabolic activity. Scand J Gastroenterol. 2000;35:772-780. [PubMed] [DOI] |
| 5. | Panja A. A novel method for the establishment of a pure population of nontransformed human intestinal primary epithelial cell (HIPEC) lines in long term culture. Lab Invest. 2000;80:1473-1475. [PubMed] [DOI] |
| 6. | Grossmann J, Walther K, Artinger M, Rümmele P, Woenckhaus M, Schölmerich J. Induction of apoptosis before shedding of human intestinal epithelial cells. Am J Gastroenterol. 2002;97:1421-1428. [PubMed] [DOI] |
| 7. | Kaeffer B. Mammalian intestinal epithelial cells in primary culture: a mini-review. In Vitro Cell Dev Biol Anim. 2002;38:123-134. [PubMed] [DOI] |
| 8. | Dzierzewicz Z, Orchel A, Swierczek-Zieba G, Latocha M, Cwalina B, Wilczok T. Normal colonocytes in primary culture--an experimental model for molecular pharmacology and biology of large intestine. Acta Pol Pharm. 2000;57 Suppl:23-25. [PubMed] |
| 9. | Perreault N, Beaulieu JF. Use of the dissociating enzyme thermolysin to generate viable human normal intestinal epithelial cell cultures. Exp Cell Res. 1996;224:354-364. [PubMed] [DOI] |
| 10. | Baten A, Sakamoto K, Shamsuddin AM. Long-term culture of normal human colonic epithelial cells in vitro. FASEB J. 1992;6:2726-2734. [PubMed] |
| 11. | Grossmann J, Walther K, Artinger M, Kiessling S, Steinkamp M, Schmautz WK, Stadler F, Bataille F, Schultz M, Schölmerich J. Progress on isolation and short-term ex-vivo culture of highly purified non-apoptotic human intestinal epithelial cells (IEC). Eur J Cell Biol. 2003;82:262-270. [PubMed] [DOI] |