修回日期: 2004-03-20
接受日期: 2004-04-05
在线出版日期: 2004-08-15
目的: 利用反义核酸技术, 研究体外胰岛素样生长因子-I(IGF-I)反义寡核苷酸转染对肝癌细胞增生、分化及凋亡的影响, 探讨寡核苷酸转染治疗肝癌的可行性.
方法: 合成针对IGF-I的寡核苷酸片段, 利用脂质体包裹反义IGF-I寡核苷酸片段瞬时转染人肝癌细胞系BEL-7402细胞, MTT法检测细胞增生; 放免法检测培养细胞上清中AFP, CEA的分泌量; 免疫组化法检测转染细胞AFP, PCNA表达的变化; 采用末端标记(Tunel)法检测细胞凋亡的变化.
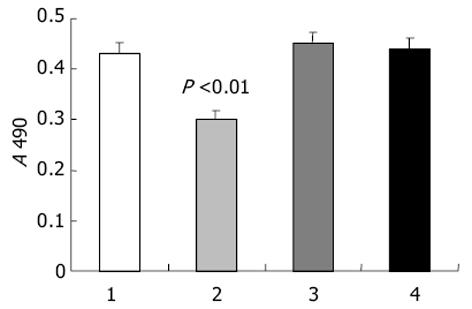
结果: MTT法检测转染反义IGF-I寡核苷酸的人肝癌细胞系BEL-7402 A值由0.44±0.09下降为0.30±0.07 (P<0.01), 上清液AFP和CEA水平分别由12.5±2.2 μg/L和6.8±2.3 μg/L下降为2.5±0.3 μg/L和2.2±1.5 μg/L(P<0.01, P<0.05), 凋亡阳性细胞数由16.4%±2.3%增加至23.1%±3.7%(P<0.05).
结论: 反义IGF-I寡核苷酸转染人肝癌细胞系BEL-7402细胞可以降低细胞增生, 减少细胞去分化并诱导肝癌细胞凋亡.
引文著录: 王季堃, 乔世峰. 反义IGF-I寡核苷酸转染对人肝癌细胞生长的抑制作用. 世界华人消化杂志 2004; 12(8): 1962-1964
Revised: March 20, 2004
Accepted: April 5, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1962-1964
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1962.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1962
胰岛素样生长因子-I(Insulin like growth factor I, IGF-I)是一种多效的生长因子, 在肿瘤的生长、分化和转移过程中起重要作用[1]. 肿瘤细胞通过自分泌方式过度产生IGF-I, 激活IGF-I受体, 使自身不断生长, 因此IGF-I成为反义核酸治疗的良好靶分子. 利用反义寡核苷酸(ASON)技术人工合成IGF-I寡核苷酸片段, 脂质体包裹并转染人肝癌细胞系BEL-7402细胞, 可以通过特异性结合靶基因, 干扰基因的复制、转录和翻译过程. 抑制肿瘤细胞IGF-I的过度表达, 观察转染细胞增生、分化及凋亡的变化, 进而为IGF-I反义核苷酸治疗肝细胞癌提供依据.
肝癌细胞株BEL-7402(购自北京市肿瘤防治研究所); 脂质体Lipofectin 及RPMI1640培养基(美国GIBCO公司); 正、反义IGF-I寡核苷酸片段(上海博亚生物技术有限公司合成); AFP检测试剂盒(天津九鼎医学生物工程有限公司); CEA检测试剂盒(天津市千叶生物技术有限公司); AFP, PCNA免疫组化试剂盒(北京市中山生物技术有限公司); Tunel凋亡检测试剂盒(美国Promega公司).
反义IGF-I寡核苷酸的合成根据IGF-I cDNA序列, 按编码人IGF-I第11到第20氨基酸编码序列设计反义IGF-I寡核苷酸, 两端硫代修饰以增强其稳定性, 并以正义寡核苷酸作为对照. Antisense 5'TCC ACA CAC GAA CTG AAG AGC ATC CAC CAG 3'Sense 5'CTG GTG GAT GCT CTT CAG TTC GTG TGT GGA 3'. BEL-7402细胞经消化后计数, 以1.5×108个/L接种96孔板, 每孔200 μL, 100 mL/L小牛血清的RPMI 1640培养基, 50 mL/L CO2, 37 ℃孵箱中培养12 h. 培养细胞分为4组: (1)脂质体包裹反义IGF-I寡核苷酸链组(反义IGF-1+LP组); (2)脂质体包裹正义IGF-I寡核苷酸链组(正义IGF-1+LP组), (3)单纯脂质体组(LP组); (4)空白对照组: 无血清RPMI1640组, 每组设3个平行孔. 按产品说明书进行脂质体包裹寡核苷酸片段及瞬时转染, 改为普通培养基培养12h后进行各指标检测. (1)MTT法检测活细胞群体总数培养细胞加入MTT(5 g/L) 50 μL/孔, 继续孵育4 h, 加入DMSO 100 μL/孔, 轻摇10 min后检测波长490 nm的吸光度. (2)放射免疫法测定培养细胞上清中AFP、CEA含量 按试剂盒方法进行操作, FT-6B γ计数器测量放射计数率. (3)培养细胞经甲醇丙酮(1: 1)固定5-7 min, 0.5 g/L Tween-20/PBS洗后, 10 g/L BSA/PBS 37 ℃封闭1 h, 加AFP/PCNA单抗作为一抗, 室温孵育1 h, PBS洗3次, 加生物素标记羊抗小鼠IgG(1: 300)37 ℃室温孵育1 h, PBS洗3次, 加辣根过氧化物酶标记链霉卵白素37 ℃ 40 min, DAB显色. (4)原位末端标记DNA片段(TUNEL)检测细胞凋亡按说明书进行.
统计学处理 结果均以mean±SD表示, 不同组别的比较采用单因素方差分析.
脂质体包裹反义IGF-I寡核苷酸链转染组细胞增生明显受到抑制, 与其他组相比较有显著性差异(P<0.01), 其他组间比较无显著性差异(P>0.05)(图1).
反义IGF-I+LP组AFP变化差异有显著性意义(P<0.01), CEA变化差异有显著性意义(P<0.05), 正义IGF-I+LP组, LP组AFP及CEA变化差异无显著性意义(P>0.05)(表1).
人肝癌细胞系BEL-7402细胞与AFP及PCNA单抗染色均有反应, 阳性细胞染色为棕色, AFP染色部位在细胞质, PCNA染色部位在细胞核; 同一反应条件下反义IGF-I+LP组的AFP 及PCNA染色与其他组比较显色明显减弱.
转染细胞培养后原位末端标记法观察细胞凋亡现象, 细胞核呈棕褐色着染者即为凋亡细胞, 反义IGF-I+LP组阳性细胞为23.1%±3.7%, 正义IGF-I+LP组为17.4%±3.5%, LP组为15.9%±2.7%, 空白对照组为16.4%±2.3%, 反义IGF-I+LP组与其他组比较凋亡细胞明显增多(P<0.05).
反义寡核苷酸(ASON)技术是根据碱基互补原则通过人工合成一段与靶基因及其mRNA互补的寡核苷酸片段, 与相应靶基因或mRNA特异性结合, 干扰基因的复制、转录和翻译过程, 从而达到削弱或抑制该基因功能的目的[2]. 胰岛素样生长因子-I(IGF-I)是许多肿瘤细胞赖以生长的细胞因子, 实验表明多种肿瘤细胞IGF-I异常表达, 在肿瘤的发生、发展中起重要作用, 他具有促进细胞有丝分裂、维持肿瘤细胞恶性转化和逃逸凋亡作用[3-4]. 肿瘤细胞通过自分泌方式过度产生IGF-I, 从而激活IGF-I受体, 而使自身不断生长, 因此IGF-I成为反义核酸治疗的良好靶分子. 本结果表明, 抑制IGF-I的表达可以抑制肝癌细胞的增生, 并与肝癌细胞的分化相关. AFP和CEA是与肝癌细胞生长相关的肿瘤标记物[5-6], 可以做为反义IGF-I寡核苷酸转染后肿瘤细胞生物学变化的指标, 评价其对肿瘤细胞的影响. 我们通过IGF-I反义寡核苷酸转染肝癌细胞后, 肿瘤细胞分泌AFP及CEA水平明显降低, 分别为P<0.01和P<0.05, 表明IGF-I与肝癌细胞的恶性程度相关, 反义IGF-I基因可能通过调控这两种肿瘤标记物的分泌而在改变肿瘤恶性程度中起到一定的作用.
肿瘤组织中PCNA阳性细胞数可反映肿瘤组织增生的速度, 因此PCNA成为研究肿瘤细胞分裂增生的有利工具[7]. 本实验中反义IGF-I寡核苷酸转染的肝癌细胞PCNA染色强度明显低于其他组, 进一步证明IGF-I基因与肝癌细胞的增生相关. 一般认为肿瘤细胞分化程度越低, 增生力越强, 恶性程度越高, 其PCNA表达越强[8-9], 我们认为肝癌细胞中IGF-I的高表达导致PCNA的表达改变, AFP及CEA作为肝细胞癌分化水平的指标, 可以说明IGF-I基因不仅与细胞增生相关, 也与细胞的分化程度相关. 反义IGF-I寡核苷酸的封闭可能是靶细胞分泌CEA和AFP减少的原因, 确切机制尚待进一步的研究. 肿瘤细胞凋亡说明机体可通过自主地清除恶变的或可能恶变的细胞来对抗肿瘤的发生和发展[10]. 我们发现, 应用反义IGF-I寡核苷酸转染可以使凋亡的阳性细胞数量增加, 诱导肝癌细胞凋亡. 细胞凋亡对肿瘤起着负调控作用, 肿瘤的发生发展不仅是由于细胞增生速率升高, 而且与细胞死亡速率下降有关. 本实验中凋亡阳性细胞的CEA和AFP分泌降低, 表明肝癌细胞凋亡阳性率与肿瘤分化程度有密切关系.
编辑: N/A
| 1. | Shen WH, Yin Y, Broussard SR, McCusker RH, Freund GG, Dantzer R, Kelley KW. Tumor necrosis factor alpha inhibits cyclin A expression and retinoblastoma hyperphosphorylation triggered by insulin-like growth factor-I induction of new E2F-1 synthesis. J Biol Chem. 2004;279:7438-7446. [PubMed] [DOI] |
| 2. | Gleave M, Nelson C, Chi K. Antisense targets to enhance hormone and cytotoxic therapies in advanced prostate cancer. Curr Drug Targets. 2003;4:209-221. [PubMed] [DOI] |
| 3. | Price JA, Kovach SJ, Johnson T, Koniaris LG, Cahill PA, Sitzmann JV, McKillop IH. Insulin-like growth factor I is a comitogen for hepatocyte growth factor in a rat model of hepatocellular carcinoma. Hepatology. 2002;36:1089-1097. [PubMed] [DOI] |
| 4. | Ellouk-Achard S, Djenabi S, De Oliveira GA, Desauty G, Duc HT, Zohair M, Trojan J, Claude JR, Sarasin A, Lafarge-Frayssinet C. Induction of apoptosis in rat hepatocarcinoma cells by expression of IGF-I antisense c-DNA. J Hepatol. 1998;29:807-818. [DOI] |
| 5. | Kato M, Shinozawa T, Kato S, Terada T. Aberrant expression of a fetal glycoprotein 68 in hepatocellular carcinoma: a comparative study on the expression of alpha-fetoprotein and carcinoembryonic antigen. Histol Histopathol. 2004;19:701-706. [PubMed] |
| 6. | Torzilli G, Makuuchi M, Ferrero A, Takayama T, Hui AM, Abe H, Inoue K, Nakahara K. Accuracy of the preoperative determination of tumor markers in the differentiation of liver mass lesions in surgical patients. Hepatogastroenterology. 2002;49:740-745. [PubMed] |
| 7. | Sever-Chroneos Z, Angus SP, Fribourg AF, Wan H, Todorov I, Knudsen KE, Knudsen ES. Retinoblastoma tumor suppressor protein signals through inhibition of cyclin-dependent kinase 2 activity to disrupt PCNA function in S phase. Mol Cell Biol. 2001;21:4032-4045. [PubMed] [DOI] |
| 8. | Usnarska-Zubkiewicz L, Maryniak R, Podolak-Dawidziak M, Woźniak Z, Jeleń M, Ramlau R, Poreba M, Kuliczkowski K. The expression of proliferating cell nuclear antigen (PCNA) and of nucleolar organizer regions (AgNORs) correlates with the morphological type of bone marrow plasma cells in multiple myeloma (MM). Pol Arch Med Wewn. 2003;109:257-263. [PubMed] |
| 9. | Tong Q, Zeng F, Lin C, Zhao J, Lu G. Growth inhibiting effects of antisense eukaryotic expression vector of proliferating cell nuclear antigen gene on human bladder cancer cells. Chin Med J (Engl). 2003;116:1203-1206. [PubMed] |
| 10. | Tabs S, Avci O. Induction of the differentiation and apoptosis of tumor cells in vivo with efficiency and selectivity. Eur J Dermatol. 2004;14:96-102. [PubMed] |