修回日期: 2004-04-10
接受日期: 2004-05-13
在线出版日期: 2004-08-15
目的: 探讨PCNA与CD44V6在胃癌中的表达及其与CT征象之间的相关性.
方法: 用免疫组化S-P法测定48例胃癌标本中PCNA, CD44V6表达情况, 并就其结果与CT表现、手术结果进行对照以探讨其相关性.
结果: 胃癌中PCNA及CD44V6阳性表达率分别为79.2%(38/48)和72.9%(35/48); PCNA与淋巴结转移, TNM分期有相关性(P<0.05), 而与分化程度、Borrman分型无关(P>0.05); CD44V6阳性表达率与胃癌大体分型、淋巴结转移及TNM分期均相关(P<0.05), 而与肿瘤分化程度无关(P>0.05); 在显示病变进展程度以及TNM分期方面CT有其独到的优势, PCNA与CD44V6强阳性表达与CT征象中病变胃壁的厚度, 胃周脂肪线的消失, 周围淋巴结肿大, CT分期, 远处脏器转移均有明显相关(P<0.05), 而与病变范围无关(P>0.05).
结论: CT征象与PCNA、CD44V6表达有相关性; CT作为胃癌术前诊断及术后随访的重要手段, 与相关的分子生物学指标相结合, 在胃癌的早期诊断, 预测肿瘤转移及治疗等方面将提供新的思路和理论依据.
引文著录: 王刚, 黎卫平, 冯颖. 胃癌的CT征象与PCNA、CD44V6表达的相关性研究. 世界华人消化杂志 2004; 12(8): 1950-1953
Revised: April 10, 2004
Accepted: May 13, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1950-1953
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1950.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1950
胃癌是我国最常见的消化道恶性肿瘤, 且进展期胃癌预后差. CT不仅能够明确显示病变的存在, 还能根据其浸润深度, 病变周围情况及有无转移作出分期, 对于术前手术切除可能性的评估以及判断预后具有重要的意义. PCNA和CD44V6是目前已知研究较多的与胃癌多种生物学行为密切相关的免疫标志物, 但尚未见有关他们与胃癌CT影像学表现关系的报道. 我们探讨PCNA, CD44V6在胃癌中的表达与胃癌CT表现之间的潜在联系, 以期对胃癌的早期诊断、准确分期及判断预后提供更有效可靠的理论依据.
2000/2003年兰州医学院第一附属医院上腹部CT资料完整的胃癌手术标本48例, 均经手术和病理证实. 男30例, 女18例,平均年龄55.3岁; 贲门癌19例, 胃窦癌21例, 胃体癌8例; 48例胃癌中高分化癌18例, 中分化癌10例, 低分化癌11例, 未分化癌5例, 4例为黏液癌. 临床分期按国际抗癌联盟(UICC)新TNM标准, Ⅰ期4例, Ⅱ期17例, Ⅲ期13例, Ⅳ期14例, 所有病例术前均未行化疗及放疗. 标本均经甲醛固定、石蜡包埋, 连续切片, 厚4 μm, 分别供HE, SP染色. 鼠抗人PCNA单抗(编号MAB-0145)和鼠抗人CD44V6单抗(编号MAB-0038)及免疫组化染色即用型S-P试剂盒, 均购自福州迈新公司.
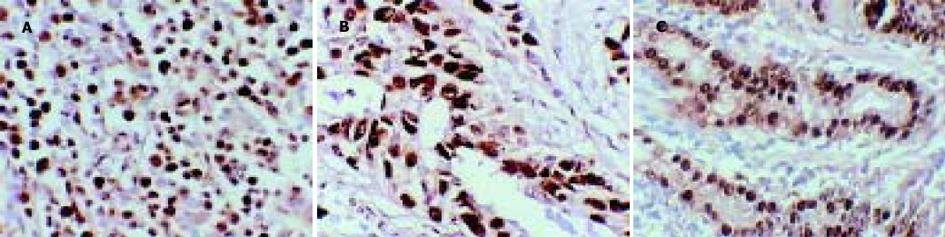
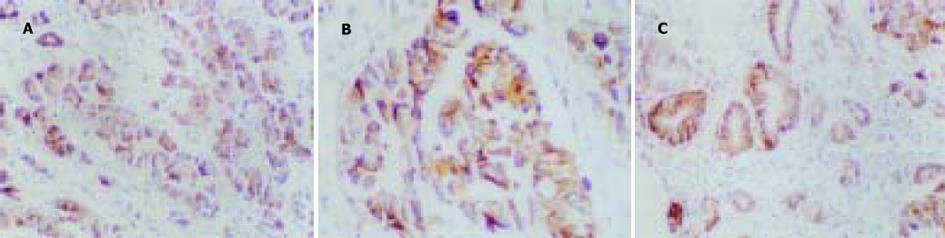
1.2.1 免疫组化: 石蜡切片4 μm脱蜡至水, 经30 mL/L H2O2甲醛溶液室温下孵育10 min, 微波抗原修复(250W, 20 min), 孵育10 min后, 直接滴加一抗. 4 ℃下过夜, 生物素标记羊抗鼠IgG孵育30 min, 链霉菌生物素抗过氧化酶溶液孵育30 min, DAB显色5-8 min, 苏木素复染, 脱水, 透明, 封片, 光镜下观察结果. PCNA表达以细胞核内出现棕黄色颗粒为阳性, 采用PCNA标记指数PCNALI(每1 000个肿瘤细胞中阳性细胞所占的百分比)进行结果判断, PCNA阳性细胞数0%-25%为(-), 26%-50%为(+), >50%为(++); CD44V6表达以细胞膜和/或胞质呈棕黄色为阳性, 染色阳性细胞数<10%为(-), 10%-25%为(+), 25%-50%为(++), 阳性细胞数>50%为(+++). 本组中二者均以50%为强表达与弱表达之分界标准.
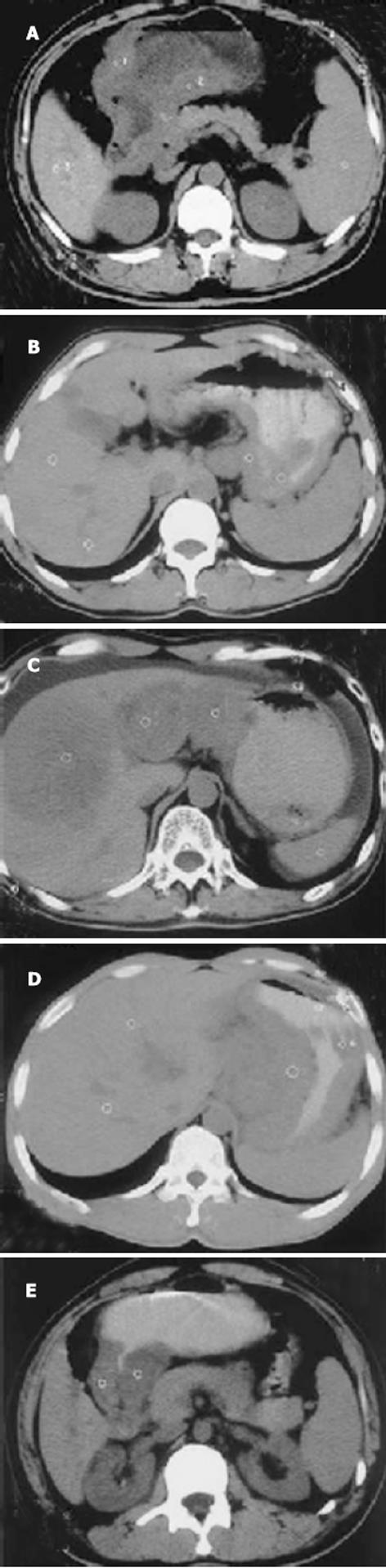
1.2.2 CT检查方法: 采用西门子公司Samoton AR型CT机, 扫描层厚及间隔为5.0-10.0 mm, 扫描条件为3.0 s, 130 kV, 140 mA, 采用常规腹部窗宽窗位. 常规肠道准备, 检查当天晨起禁食水, 扫描前20 min肌肉注射654-Ⅱ20 mg, 口服纯净水或20 g/L泛影葡胺600- 800 mL, 上机前再口服100-200 mL以充分扩张胃腔. 患者取仰卧位, 常规平扫, (部分患者加扫增强). 胃壁增厚>5 mm者为异常; 以病变区胃壁与周围组织器官间是否存在脂肪间隙或透亮线为标准判断病变是否侵犯周围脏器; 胃周出现孤立性且>10.0 mm的圆形结节或融合结节视为淋巴结异常, 作为胃周淋巴结转移的依据; 若出现腹水或肝, 胆, 胰, 脾内出现异常密度则视为腹腔转移的依据. CT分期以修正后的Halvorsen和Thompson法[1]为标准.
统计学处理 采用SPSS10.0软件包, x2检验, 以P<0.05为差异有显著性.
胃癌PCNA及CD44V6的阳性表达率分别为79.2%和72.9%, PCNA的阳性表达率与淋巴结转移, TNM分期有相关性(bP<0.01), 而与分化程度、Borrman分型无关(P>0.05); CD44V6的阳性表达率在Borrman分型的浸润型组、淋巴结转移组及TNMⅢ-Ⅳ期中的表达均较局限型组, 无淋巴结转移组, TNM分期中Ⅰ-Ⅱ组高(aP<0.05, bP<0.01); 在分化程度不同的两组间差异无显著性(P>0.05). 胃癌CT分期与手术病理对照, 其总的TNM分期准确率为79.2%(38/48), 大体分型准确率为70.7%(34/48), 二者均有较好的一致性. 胃癌CT征像中胃壁厚度、胃周脂肪线、淋巴结转移、CT分期及远处转移均与PCNA、CD44V6强阳性表达相关(aP<0.05, bP<0.01), CT发现胃壁厚度超过2 cm、胃周脂肪层消失、淋巴结转移阳性、合并远处转移及分期较晚者, 其PCNA、CD44V6强阳性表达较对应组为高, 而肿瘤范围大小与二者表达均无关(P>0.05) (表1-2)(图1-3).
| CT 征像 | n | PCNA强表达n (%) | CD44V6强表达n (%) | |
| 胃壁厚度 | ≥20 mm | 30 | 16 (53.3) | 19 (63.3) |
| < 20 mm | 18 | 4 (22.2)a | 5 (27.8)a | |
| 肿瘤范围 | ≥60 mm | 20 | 8 (40.0) | 13 (65.0) |
| <60 mm | 28 | 12 (42.9) | 11 (39.3) | |
| 胃周脂肪层 | 清晰 | 18 | 4 (22.2) | 5 (27.8) |
| 模糊或消失 | 30 | 16 (53.3)a | 19 (63.3)a | |
| 淋巴结 | 阳性 | 16 | 10 (62.5)a | 12 (75.0)a |
| 阴性 | 32 | 10 (31.3) | 12 (37.5) | |
| CT分期 | Ⅰ,Ⅱ期 | 17 | 3 (17.6) | 5 (29.4) |
| Ⅲ,Ⅳ期 | 31 | 17 (54.8)a | 19 (61.3)a | |
| 远处转移 | 没有 | 36 | 11 (30.6) | 15 (41.7) |
| 有 | 12 | 9 (75.0)b | 9 (75.0)a |
增生细胞核抗原(proliferating cell nuclear antigen, PCNA)是与细胞增生有关的周期蛋白, 是一种较好的判断细胞增生状态的标记[2], 与恶性肿瘤的侵袭转移及预后密切相关[3-5]; 转移相关因子CD44V6是一种分布极为广泛的细胞表面跨膜糖蛋白, 属于表面黏附分子, 主要参与细胞与细胞、细胞与基质之间特异性的粘连过程, CD44V6的表达与胃癌进展程度、转移及预后密切相关[6-10]. 本结果显示PCNA,CD44V6的表达与CT征象密切相关, CT表现胃壁增厚≥20 mm者, 胃周脂肪线消失者, CT发现阳性淋巴结者以及有肝内异常密度病灶, 腹水等远处转移, CT分期Ⅲ-Ⅳ期胃癌组, 其 PCNA强表达率(53.3%, 53.3%, 62.5%, 54.8%, 75.0%)均高于胃壁厚度< 20 mm, 胃周脂肪线清晰, CT淋巴结阴性, 不合并远处转移以及CT分期Ⅰ-Ⅱ期者(22.2%, 22.2%, 31.3%, 17.6%, 30.6%)(表2, aP<0.05, bP<0.01); 该结果说明, 影像表现所提示的胃癌生物学特性与胃癌的分子生物学检测指标之间有一定的相关性, 同时也说明CT征象客观地反映了病变的进展程度, 其表现与PCNA表达所提示的肿瘤细胞增生程度有相同的病理意义; 本组资料CT征象中病灶大小与PCNA表达无明显相关性, 此结果与Perez-Oso et al[11]在内镜下活检标本研究结果不一致. 本资料表明, 在胃壁增厚≥20 mm, 胃周脂肪线消失, 有淋巴结转移及远处转移、CT分期Ⅲ-Ⅳ期的胃癌组中, CD44V6强阳性表达率高于其对应组, 差异有统计学意义(aP<0.05). Yamamichi et al[12]发现CD44V6表达与胃癌诊断时是否存在远处转移相关, 并与根治术后患者的局部肿瘤复发率及死亡率有关; Nakashiot et al[13]的研究显示CD44V6表达在胃癌腹膜种植转移中起重要作用, 说明CD44V6与病情进展及预后密切相关. Paramo et al[14]研究显示, 随着CT上病灶厚度的增加, 其浆膜浸润的几率显著提高(<5 mm, 25%; 5-20 mm, 62.5%; >20 mm, 81%), 这在本组资料中PCNA和CD44V6的强表达率与CT征病变厚度及脂肪层的相关性可得到证实. Tahara et al[15]认为, 分化较好的胃癌转移多发生肝脏转移, 而分化差者多见于腹膜转移, 本组病例中未反映出该病理学特征, 此结论尚有待进一步实验探讨.
胃癌浸润深度、范围和淋巴结转移是影响预后的主要因素, 在术前识别出预后不良者对确定治疗方案和术后辅助治疗具有重要意义. CT技术的不断发展为胃癌研究提供了一个重要的研究手段, 并且通过增强扫描、图像后处理技术进行确诊, 扩大了诊断范围, 增强了诊断效度, 能为临床判断手术切除可能性、预后评价提供较为可靠的依据, 从而避免不必要的剖腹探查. 但由于CT图像对病灶的缩小以及机器性能和扫描方法选择的不同, CT在判断淋巴结转移、分期及早期胃癌诊断方面仍存在一定局限性[16-18]. 本组资料显示: CT对胃癌术前分期的准确率及大体分型准确率分别为79.2%、70.7%, CT分期的不足主要是因为: (1)正常大小的淋巴结已发生癌转移; (2)CT对于与胃壁和癌灶紧邻融合的转移淋巴结无法辨认; (3)肝内小转移灶以及不合并腹水的腹膜小转移灶CT不能检出. CT分期过度主要是因为: (1)尚未穿透胃全层的癌肿周围脂肪层的消失, (2)消瘦患者因脂肪较少而出现假阳性征像. 本组多数病例未做增强扫描也是导致分期不准的原因之一. 因此, CT判断分期及胃癌淋巴结转移仍存在一定的限度, 尤其对病变表浅、CT诊断病变尚属早期但已发生小淋巴结转移、以及具有潜在转移特性的胃癌, CT尚难准确判断其分期而可能导致治疗方法选择不恰当.
总之, CT扫描可作为胃癌术前诊断及分期的一种有效的检查手段; 分析胃癌组织中CD44V6及PCNA表达情况并结合其影像表现及常规病理检测结果, 有助于从分子生物学角度解释不同的影像学表现, 同时可补充CT诊断的局限性, 对癌组织浸润、淋巴结转移及预后判断提供更为客观的多参数评价指标, 为胃癌的准确术前分期、早期诊断、肿瘤转移的预测提供新的思路和理论依据.
编辑: N/A
| 1. | 李 松年, 唐 光健. 《现代全身CT诊断学》. 北京: 中国医药科技出版社 2001; 986. |
| 3. | Lee KE, Lee HJ, Kim YH, Yu HJ, Yang HK, Kim WH, Lee KU, Choe KJ, Kim JP. Prognostic significance of p53, nm23, PCNA and c-erbB-2 in gastric cancer. Jpn J Clin Oncol. 2003;33:173-179. [PubMed] [DOI] |
| 4. | Elpek GO, Gelen T, Aksoy NH, Karpuzoglu T, Keles N. Microvessel count, proliferating cell nuclear antigen and Ki-67 indices in gastric adenocarcinoma. Pathol Oncol Res. 2000;6:59-64. [PubMed] [DOI] |
| 5. | Tao K, Chen D, Tian Y, Lu X, Yang X. The relationship between apoptosis and the expression of proliferating cell nuclear antigen and the clinical stages in gastric carcinoma. J Tongji Med Univ. 2000;20:222-224. [PubMed] [DOI] |
| 6. | Xin Y, Grace A, Gallagher MM, Curran BT, Leader MB, Kay EW. CD44V6 in gastric carcinoma: a marker of tumor progression. Appl Immunohistochem Mol Morphol. 2001;9:138-142. [PubMed] [DOI] |
| 7. | Joo M, Lee HK, Kang YK. Expression of E-cadherin, beta-catenin, CD44s and CD44v6 in gastric adenocarcinoma: relationship with lymph node metastasis. Anticancer Res. 2003;23:1581-1588. [PubMed] |
| 8. | Li Y, Zhang JH, Kuang G, Yang JQ, Zhao Q, Wang XL, Jiao ZK, Zhang ZD, Wang LL. [Expression of MUC1, CD44v6, nm23 in gastric carcinomas and regional lymph node tissues and their association with invasion, metastasis, and prognosis of the tumor]. Ai Zheng. 2003;22:985-989. [PubMed] |
| 9. | Chen JQ, Zhan WH, He YL, Peng JS, Wang JP, Cai SR, Ma JP. Expression of heparanase gene, CD44v6, MMP-7 and nm23 protein and their relationship with the invasion and metastasis of gastric carcinomas. World J Gastroenterol. 2004;10:776-782. [PubMed] |
| 11. | Perez-Oso E, Arilla E. Effect of prenatal dopamine receptor blocking on somatostatin receptor binding in the developing rat brain. Brain Res Bull. 1993;31:165-169. [PubMed] [DOI] |
| 12. | Yamamichi K, Uehara Y, Kitamura N, Nakane Y, Hioki K. Increased expression of CD44v6 mRNA significantly correlates with distant metastasis and poor prognosis in gastric cancer. Int J Cancer. 1998;79:256-262. [PubMed] [DOI] |
| 13. | Nakashio T, Narita T, Sato M, Akiyama S, Kasai Y, Fujiwara M, Ito K, Takagi H, Kannagi R. The association of metastasis with the expression of adhesion molecules in cell lines derived from human gastric cancer. Anticancer Res. 1997;17:293-299. [PubMed] |
| 14. | Paramo JC, Gomez G. Dynamic CT in the preoperative evaluation of patients with gastric cancer: correlation with surgical findings and pathology. Ann Surg Oncol. 1999;6:379-384. [PubMed] [DOI] |
| 15. | Tahara E, Semba S, Tahara H. Molecular biological observations in gastric cancer. Semin Oncol. 1996;23:307-315. [PubMed] |
| 16. | D'Elia F, Zingarelli A, Palli D, Grani M. Hydro-dynamic CT preoperative staging of gastric cancer: correlation with pathological findings. A prospective study of 107 cases. Eur Radiol. 2000;10:1877-1885. [PubMed] [DOI] |
| 17. | Cereceda Pérez CN, Urbasos Pascual MI, Romero Castellanos C, Carreira Gómez C, Pinto Varela JM. Helical CT of the stomach: differentiation between benign and malignant pathologies, together with the staging of gastric carcinoma. Rev Esp Enferm Dig. 2002;94:601-612. [PubMed] |
| 18. | Mani NB, Suri S, Gupta S, Wig JD. Two-phase dynamic contrast-enhanced computed tomography with water-filling method for staging of gastric carcinoma. Clin Imaging. 2001;25:38-43. [PubMed] [DOI] |