修回日期: 2003-02-20
接受日期: 2003-03-28
在线出版日期: 2004-08-15
目的: 探讨白介素-10对大鼠肝星状细胞的干预作用和作用机制.
方法: 分离大鼠肝星状细胞(HSC), 采用不同浓度的白介素-10处理后, 分别应用ELISA法和Northern blot检测大鼠HSC中细胞间黏附分子-1(ICAM-1)、肿瘤坏死因子-α和白介素- 1β蛋白和mRNA的表达, 采用凝胶迁移率法检测核因子κB(NF-κB)活性.
结果: 白介素-10可明显下调大鼠HSC ICAM-1、TNF-α及IL-1β表达, 并且抑制NF-κB活性, 其效应呈浓度依赖性.
结论: 白介素-10可能通过下调HSC ICAM-1、TNF-α及IL-1β表达和抑制NF-κB活性来发挥其抗炎和抗纤维化作用的.
引文著录: 颜吉丽, 范钰, 李华, 张锦生, 黄富春. 白介素-10对大鼠肝星状细胞核因子-κB、细胞因子及细胞间黏附分子-1表达的影响. 世界华人消化杂志 2004; 12(8): 1947-1949
Revised: February 20, 2003
Accepted: March 28, 2003
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1947-1949
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1947.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1947
近年发现, 细胞间黏附分子-1与许多肝脏疾病的发生、发展密切相关[1-8]. 肝损伤时, 被激活的肝星状细胞不仅分泌细胞外基质, 直接导致肝纤维化的形成, 同时细胞表面表达细胞间黏附分子-1(intercellular adhesion molecule-1, ICAM-1). ICAM-1表达增多促进白细胞向肝实质浸润, 使肝脏炎症加剧、损伤加重[9-10]. 核内转录因子(nuclear factor κB, NF-κB)是一个多功能的核转录因子, 具有广泛的生物学活性, 能够促进多种细胞因子、黏附因子和趋化因子的基因转录, 在炎症反应中起重要作用. 研究发现, 肝损伤及肝纤维化与NF-κB密切相关[11-16]. 白介素-10(interleukin-10, IL-10)是一种多功能的炎症抑制因子, 有抑制炎症反应、减轻纤维化的作用[17-23], 但是其细胞内的作用机制不清. 为此, 我们采用IL-10处理大鼠HSC, 观察其对NF-κB和细胞因子(TNF-α)、(IL-1β)影响, 旨在进一步揭示其抗肝纤维化的作用机制.
♂Wistar大鼠, 体质量450-500 g, 购自中国科学院上海实验动物中心. 鼠抗人结蛋白(Desmin)多克隆抗体, 羊抗鼠ICAM-1多克隆抗体, 购自Dako公司. 辣根过氧化物酶标记兔抗羊IgG、链霉素生物素-过氧化物酶(ABC)法免疫组化试剂盒, 购自武汉博士德公司. 大鼠TNF-α, 购自PeproTech公司. 总RNA提取试剂盒(TRIzol)、逆转录试剂盒、NF-κB探针, 购自Promega公司. 四甲基联苯胺盐酸盐(TMB)、Taq聚合酶、dNTP均购自华美公司. ICAM-1、TNF-α、IL-1βELISA试剂盒购于北京邦定公司.
1.2.1 HSC分离: 分离培养HSC: 按文献[24]方法. HSC活率和纯度鉴定: 用常规台盼蓝染色法鉴定细胞活率; 采用Desmin和α-平滑肌肌动蛋白(α-SMA)染色对细胞进行免疫组化鉴定. 鉴定成功后进行如下试验.
1.2.3 HSC NF-κB活性: 采用凝胶迁移率法. 参照文献[25]加以改进. 定量后取核蛋白5 μg、DNA结合缓冲液17 μL、标记探针1 μL. 总体积21 μL, 置37 ℃孵育30 min, 然后加上样缓冲液4 μL. 反应产物经50 mL/L的非变性聚丙烯酰胺凝胶电泳(0.25×TBE, pH8.3, 电压110 V). 电泳完毕, 凝胶置-70 ℃放射自显影.
1.2.4 HSC ICAM-1、TNF-α及IL-1β表达: (1)蛋白水平采用ELISA方法. 按照试剂盒说明书操作. 测定490 nm波长下的吸光度. (2)mRNA水平采用Northern blot方法[26]检测. 以TRIzol提取细胞总RNA, 以GAPDH为内参照. 利用Kodak Digital Science 1D Image Analysis Software测定Northern Blot条带净灰度值, 并与内参照GAPDH的测定结果相比较, 计算其比值.
统计学处理 采用计算机SPSS10.0 软件系统进行F检验和t检验.
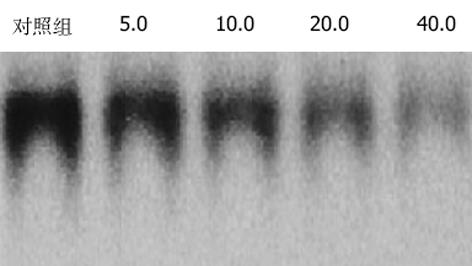
大鼠HSC有较高的NF-κB表达, 以IL-10处理后, NF-κB活性被抑制, 且呈剂量依赖性(见图1).
IL-10是一种主要由Th2细胞产生的炎症抑制因子. 近年发现, 肝脏Kupffer细胞、肝细胞、肝星状细胞(HSC)等也可产生IL-10. 在多种实验性肝损伤模型中, 内源性IL-10有明显抑制肝脏炎症, 减轻肝损伤的作用[17-23,27]. 提示IL-10对于慢性肝炎和肝纤维化的治疗具有重要的作用. 但是其减轻肝纤维化的机制尚完全不清楚. 本研究采用IL-10处理大鼠HSC, 探讨了IL-10对其ICAM-1、NF-κB活性及细胞因子TNF-α和IL-1的影响.
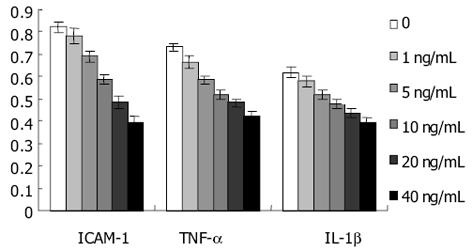
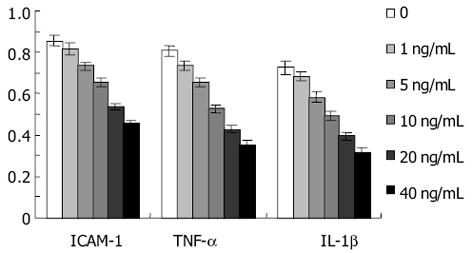
肝细胞的退行性病变, 不论是可逆的还是不可逆的, 均可通过局部各种递质的释放引起炎症反应, 后者通过旁分泌和(或)自分泌途径刺激HSC的激活, 最终促进肝纤维化的发生、发展. 在此过程中, 黏附分子起着重要的作用. 抗黏附治疗可以减轻肝损伤. 目前已发现的黏附分子主要分五类: 免疫球蛋白超家族、整合素家族、选择素家族、Cadherin家族及其他未分类的黏附分子. 其中研究最多的是免疫球蛋白超家族, 包括细胞间黏附分子(intercellular adhesion molecule, ICAM-1, 2, 3)、血管细胞黏附分子-1(vascular cell adhesion molecule-1, VCAM-1)、血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1, PECAM-1)以及神经细胞黏附分子(neural cell adhesion molecule, NCAM)等. 在这些黏附分子中, ICAM-1引人重视. 静息的HSC不表达ICAM-1, 而在HSC被激活后, ICAM-1基因及其产物均增加, 并且ICAM-1能够趋化炎症细胞, 促使炎症细胞从肝血窦直接浸润到肝实质[9-10]. 这表明ICAM-1的表达与HSC的活化有关, 并在肝纤维化的形成中起着重要作用. 在酒精性肝病[28], 病毒性肝炎[29], 自身免疫性肝病及肝纤维化肝硬变等[30]病变时, 不管其病因如何, 肝细胞, 窦周细胞及胆管上皮细胞ICAM-1表达均明显增加. 我们采用ELISA和Northern blot检测ICAM-1在大鼠HSC中的蛋白和mRNA表达, 发现, HSC高表达ICAM-1. 采用IL-10处理后, HSC中ICAM-1蛋白及mRNA均明显下调, 且呈剂量依赖性. 本研究提示, IL-10抑制大鼠HSC的激活途径之一, 可能是通过其下调ICAM-1表达来实现的.
近来发现, 核转录因子NF-κB在HSC的激活中起着重要作用[31]. NF-κB位于ICAM-1基因的启动子内, 是由p50和p65构成的二聚体复合物, 为DNA结合蛋白. 在正常情况下, NF-κB与抑制因子IκB结合形成三聚体复合物存在于细胞质内, 处于无活性状态. 多种细胞外刺激信号能够诱导NF-κB进入细胞核而被活化[32]. 目前研究表明, NF-κB参与调节免疫反应及炎症过程, 促进前炎症因子(IL-1, TNF-α, IL-6)、趋化因子(IL-8, 巨噬细胞炎症蛋白-1)等炎性基因及TGF-β基因的转录, 而这些细胞因子在肝纤维化发生发展中起重要作用. 他们可引起中性粒细胞及巨噬细胞活化, 增强中性粒细胞及单核细胞向损伤的肝实质浸润, 刺激成纤维细胞增生等[33]. 因此, TNF-α、IL-1与NF-κB之间造成细胞因子网络中的恶性循环. 而TNF-α、IL-1作为细胞外刺激信号, 又可激活NF-κB, 进一步放大炎症反应[34]. 因此, TNFα、IL-1与NF-κB之间造成细胞因子网络中的恶性循环. 研究发现, 用亲脂性铁蝥合剂阻断kuffper内核因子NF-κB的激活后, 可以阻止细胞因子TNF-α和IL-6表达的上调, 从而减轻肝脏的损伤[35]. 提示NF-κB的激活是诱导肝损伤的重要因素. 因此, NF-κB在炎症细胞向肝实质浸润过程中起重要作用. 采用药物或技术手段下调HSC表面NF-κB表达, 可望减轻炎症性肝损伤和肝纤维化.
本研究发现, IL-10处理大鼠HSC后, 凝胶迁移率法显示, NF-κB活性下降, 并且呈浓度和时间依赖性. 由此说明, IL-10可明显地抑制HSC NF-κB活性. 与此同时, 我们发现, 大鼠HSC的增生受到抑制, 说明NF-κB与HSC增生有密切的关系. 提示通过阻抑NF-κB活化可以抑制HSC增生. 我们应用ELISA方法检测IL-1β、TNF-α及ICAM-1蛋白在HSC中的表达, 结果显示, IL-10能明显下调大鼠HSC IL-1β、TNF-α及ICAM-1蛋白的表达, 并呈量效依赖性. 进一步应用Northern blot法在mRNA水平检测IL-1β、TNF-α及ICAM-1在大鼠HSC中的表达, 结果与IL-1β、TNF-α及ICAM-1蛋白表达下调趋势一致, 说明IL-10在转录水平即对IL-1β、TNF-α及ICAM-1的表达起抑制作用. 本研究提示, IL-10能够抑制大鼠HSC的激活, 可能是通过其抑制NF-κB活性, 阻断了NF-κB与TNFα、IL-1β形成的恶性循环, 从而在减轻肝脏炎症性损伤、抑制肝纤维化中发挥重要的作用.
编辑: N/A
| 1. | Hellerbrand , Wang SC, Tsukamoto H, Brenner DA, Rippe RA. Expression of intracellular adhesion molecule 1 by activated hepatic stellate cells. Hepatology. 1996;24:670-676. [PubMed] [DOI] |
| 2. | Nakanuma Y, Yasoshima M, Tsuneyama K, Harada K. Histopathology of primary biliary cirrhosis with emphasis on expression of adhesion molecules. Semin Liver Dis. 1997;17:35-47. [PubMed] [DOI] |
| 3. | Neubauer K, Eichhorst ST, Wilfling T, Buchenau M, Xia L, Ramadori G. Sinusoidal intercellular adhesion molecule-1 up-regulation precedes the accumulation of leukocyte function antigen-1-positive cells and tissue necrosis in a model of carbontetrachloride-induced acute rat liver injury. Lab Invest. 1998;78:185-194. [PubMed] |
| 4. | Menger MD, Richter S, Yamauchi J, Vollmar B. Role of microcirculation in hepatic ischemia/reperfusion injury. Hepatogastroenterology. 1999;46 Suppl 2:1452-1457. [PubMed] |
| 5. | Nakanuma Y, Tsuneyama K, Sasaki M, Harada K. Destruction of bile ducts in primary biliary cirrhosis. Baillieres Best Pract Res Clin Gastroenterol. 2000;14:549-570. [PubMed] [DOI] |
| 6. | Lalor PF, Shields P, Grant A, Adams DH. Recruitment of lymphocytes to the human liver. Immunol Cell Biol. 2002;80:52-64. [PubMed] [DOI] |
| 7. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 8. | Ohira H, Abe K, Yokokawa J, Takiguchi J, Rai T, Shishido S, Sato Y. Adhesion molecules and CXC chemokines in endotoxin-induced liver injury. Fukushima J Med Sci. 2003;49:1-13. [PubMed] [DOI] |
| 9. | Knittel T, Dinter C, Kobold D, Neubauer K, Mehde M, Eichhorst S, Ramadori G. Expression and regulation of cell adhesion molecules by hepatic stellate cells (HSC) of rat liver: involvement of HSC in recruitment of inflammatory cells during hepatic tissue repair. Am J Pathol. 1999;154:153-167. [PubMed] [DOI] |
| 10. | Schnabl B, Purbeck CA, Choi YH, Hagedorn CH, Brenner D. Replicative senescence of activated human hepatic stellate cells is accompanied by a pronounced inflammatory but less fibrogenic phenotype. Hepatology. 2003;37:653-664. [PubMed] [DOI] |
| 11. | Mirza A, Liu SL, Frizell E, Zhu J, Maddukuri S, Martinez J, Davies P, Schwarting R, Norton P, Zern MA. A role for tissue transglutaminase in hepatic injury and fibrogenesis, and its regulation by NF-kappaB. Am J Physiol. 1997;272:G281-G288. [PubMed] |
| 12. | Hellerbrand C, Jobin C, Iimuro Y, Licato L, Sartor RB, Brenner DA. Inhibition of NFkappaB in activated rat hepatic stellate cells by proteasome inhibitors and an IkappaB super-repressor. Hepatology. 1998;27:1285-1295. [PubMed] [DOI] |
| 13. | Hellerbrand C, Jobin C, Licato LL, Sartor RB, Brenner DA. Cytokines induce NF-kappaB in activated but not in quiescent rat hepatic stellate cells. Am J Physiol. 1998;275:G269-G278. [PubMed] |
| 14. | Gallois C, Habib A, Tao J, Moulin S, Maclouf J, Mallat A, Lotersztajn S. Role of NF-kappaB in the antiproliferative effect of endothelin-1 and tumor necrosis factor-alpha in human hepatic stellate cells. Involvement of cyclooxygenase-2. J Biol Chem. 1998;273:23183-23190. [PubMed] [DOI] |
| 15. | Elsharkawy AM, Wright MC, Hay RT, Arthur MJ, Hughes T, Bahr MJ, Degitz K, Mann DA. Persistent activation of nuclear factor-kappaB in cultured rat hepatic stellate cells involves the induction of potentially novel Rel-like factors and prolonged changes in the expression of IkappaB family proteins. Hepatology. 1999;30:761-769. [PubMed] [DOI] |
| 16. | Kweon YO, Paik YH, Schnabl B, Qian T, Lemasters JJ, Brenner DA. Gliotoxin-mediated apoptosis of activated human hepatic stellate cells. J Hepatol. 2003;39:38-46. [PubMed] [DOI] |
| 17. | Wynn TA, Cheever AW, Williams ME, Hieny S, Caspar P, Kühn R, Müller W, Sher A. IL-10 regulates liver pathology in acute murine Schistosomiasis mansoni but is not required for immune down-modulation of chronic disease. J Immunol. 1998;160:4473-4480. [PubMed] |
| 18. | Thompson K, Maltby J, Fallowfield J, McAulay M, Millward-Sadler H, Sheron N. Interleukin-10 expression and function in experimental murine liver inflammation and fibrosis. Hepatology. 1998;28:1597-1606. [PubMed] [DOI] |
| 19. | Louis H, Van Laethem JL, Wu W, Quertinmont E, Degraef C, Van den Berg K, Demols A, Goldman M, Le Moine O, Geerts A. Interleukin-10 controls neutrophilic infiltration, hepatocyte proliferation, and liver fibrosis induced by carbon tetrachloride in mice. Hepatology. 1998;28:1607-1615. [PubMed] [DOI] |
| 20. | Edwards-Smith CJ, Jonsson JR, Purdie DM, Bansal A, Shorthouse C, Powell EE. Interleukin-10 promoter polymorphism predicts initial response of chronic hepatitis C to interferon alfa. Hepatology. 1999;30:526-530. [PubMed] [DOI] |
| 21. | Nelson DR, Lauwers GY, Lau JY, Davis GL. Interleukin 10 treatment reduces fibrosis in patients with chronic hepatitis C: a pilot trial of interferon nonresponders. Gastroenterology. 2000;118:655-660. [PubMed] [DOI] |
| 22. | Wang XZ, Chen ZX, Zhang LJ, Chen YX, Li D, Chen FL, Huang YH. Expression of insulin-like growth factor 1 and insulin-like growth factor 1 receptor and its intervention by interleukin-10 in experimental hepatic fibrosis. World J Gastroenterol. 2003;9:1287-1291. [PubMed] [DOI] |
| 23. | Nelson DR, Tu Z, Soldevila-Pico C, Abdelmalek M, Zhu H, Xu YL, Cabrera R, Liu C, Davis GL. Long-term interleukin 10 therapy in chronic hepatitis C patients has a proviral and anti-inflammatory effect. Hepatology. 2003;38:859-868. [PubMed] [DOI] |
| 25. | Sundstedt A, Sigvardsson M, Leanderson T, Hedlund G, Kalland T, Dohlsten M. In vivo anergized CD4+ T cells express perturbed AP-1 and NF-kappa B transcription factors. Proc Natl Acad Sci U S A. 1996;93:979-984. [PubMed] [DOI] |
| 27. | Louis H, Le Moine O, Goldman M, Devière J. Modulation of liver injury by interleukin-10. Acta Gastroenterol Belg. 2003;66:7-14. [PubMed] |
| 28. | Nanji AA, Griniuviene B, Yacoub LK, Fogt F, Tahan SR. Intercellular adhesion molecule-1 expression in experimental alcoholic liver disease: relationship to endotoxemia and TNF alpha messenger RNA. Exp Mol Pathol. 1995;62:42-51. [PubMed] [DOI] |
| 29. | Horiike N, Onji M, Kumon I, Kanaoka M, Michitaka K, Ohta Y. Intercellular adhesion molecule-1 expression on the hepatocyte membrane of patients with chronic hepatitis B and C. Liver. 1993;13:10-14. [PubMed] [DOI] |
| 30. | Nakanuma Y, Yasoshima M, Tsuneyama K, Harada K. Histopathology of primary biliary cirrhosis with emphasis on expression of adhesion molecules. Semin Liver Dis. 1997;17:35-47. |
| 31. | Wu J, Zern MA. NF-kappa B, liposomes and pathogenesis of hepatic injury and fibrosis. Front Biosci. 1999;4:D520-D527. [PubMed] [DOI] |
| 32. | Baldwin AS Jr. The NF-kappa B and I kappa B proteins: new discoveries and insights. Annu Rev Immunol. 1996;14:649-683. [PubMed] [DOI] |
| 33. | Peterson TC. Pentoxifylline prevents fibrosis in an animal model and inhibits platelet-derived growth factor-driven proliferation of fibroblasts. Hepatology. 1993;17:486-493. [PubMed] |
| 34. | Blackwell TS, Christman JW. The role of nuclear factor-kappa B in cytokine gene regulation. Am J Respir Cell Mol Biol. 1997;17:3-9. [PubMed] [DOI] |
| 35. | Lin M, Rippe RA, Niemelä O, Brittenham G, Tsukamoto H. Role of iron in NF-kappa B activation and cytokine gene expression by rat hepatic macrophages. Am J Physiol. 1997;272:G1355-G1364. [PubMed] |