修回日期: 2004-07-25
接受日期: 2004-07-31
在线出版日期: 2004-08-15
目的: 观察三七总皂甙对实验性肝纤维化的防治作用, 并探讨其可能的机制.
方法: 以CCl4、乙醇及胆固醇诱导大鼠肝纤维化模型, 同时给予三七总皂甙干预组三七总皂甙腹腔注射. 设立模型对照组和正常组. 于造模6 wk后大鼠全部处死, 取血清及肝组织标本. 应用放射免疫法检测血清PCⅢ、LN含量, HE染色观察肝组织形态学改变, VG染色测定肝组织纤维表达情况, 免疫组织化学测定肝组织desmin、α-SMA、ICAM-1、LN、Ⅰ和Ⅲ型胶原.
结果: 与模型组比较, 三七总皂甙组大鼠血清PCⅢ、LN含量均明显降低; 形态学改变明显轻于模型组; 肝组织desmin、α-SMA、ICAM-1染色强度均明显减弱; 三七总皂甙组肝组织LN、Ⅰ和Ⅲ型胶原染色轻于模型组, 但差异性不显著.
结论: 三七总皂甙对实验性肝纤维化形成具有一定的抑制作用. 其作用机制可能与抑制HSC活化, 诱导活化的HSC凋亡, 减少Ⅰ、Ⅲ型胶原和LN表达, 并减轻肝窦毛细血管化有关.
引文著录: 王文兵, 戴立里, 郑元义. 三七总皂甙对大鼠肝纤维化防治机制. 世界华人消化杂志 2004; 12(8): 1939-1942
Revised: July 25, 2004
Accepted: July 31, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1939-1942
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1939.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1939
防治肝纤维化的发生发展, 对于改善慢性肝病的预后具有重要意义. 近年来国内许多学者以活血化瘀为主中药防治肝纤维化的研究业已取得可喜成果[1-6]. 具有活血化瘀功效的三七及其主要有效成分PNS在防治肝纤维化的实验研究中已得到重视[7]. 我们采用CCl4诱导大鼠肝纤维化模型, 给予PNS进行干预, 观察其对肝纤维化这一病理变化的阻断作用, 为PNS临床应用提供理论依据.
Wistar大鼠由重庆医科大学动物中心提供. 普通饲料喂养, 自由进食进饮; 正常饲养2 wk后进行实验. PCⅢ放射免疫分析试剂盒, 购自上海海军医学研究所生物技术中心; LN放射免疫分析测定盒, 购自上海海军医学研究所生物技术中心. 小鼠抗结蛋白(desmin), 为美国Sigma公司产品; 小鼠抗α-平滑肌动蛋白(α-SMA)抗体, 购自武汉博士得生物工程有限公司; 鼠抗细胞间黏附因子-1(ICAM-1)抗体, 购自北京中山生物技术有限公司. 药物及其他试剂: 血塞通注射液, 为昆明兴中制药有限责任公司产品, 本品为从五加科人参属植物三七提取的有效部位三七总皂甙制成的灭菌水溶液, 主要成分为人参皂甙Rb1, 人参皂甙Rg1, 三七皂甙R1, 每支5 mL (50 g/L); CCl4, 甲醛溶液及无水乙醇均购自重庆医科大学设备科. GC-911γ放射免疫计数器, 中国科学技术大学科技实业总公司产品.
Wistar大鼠46只, 雌雄各半, 质量175-225 g, 随机分为3组, 其中正常对照组10只, CCl4模型对照组20只, PNS干预组16只. 将CCl4与色拉油混合配制成400 mL/L的溶液, 给予CCl4模型对照组和PNS干预组大鼠皮下注射, 首剂给予5 mL/kg, 以后给予3 mL/kg体重; 正常对照组给予生理盐水皮下注射, 3 mL/kg体重, 2次/wk, 造模时间为6 wk. 造模同时给予PNS干预组大鼠PNS, 60 mg/kg体重, 1次/d, 正常对照组给予与PNS相同容积的生理盐水ip, 连续注射6 wk. 模型组和PNS干预组大鼠均给予5g/L的胆固醇-玉米粉饲料喂养, 含100-150 mL/L乙醇的自来水自由饮用; 正常对照组给予普通饲料喂养及自来水自由饮用. 分别于实验开始后2 wk末和4 wk末, 随机处死各组大鼠各一只, 取肝脏组织作石蜡切片, HE染色观察病理学变化; 其余大鼠于6 wk末全部处死. 整个实验过程中, 正常对照组自然死亡1只, 存活率为90%, CCl4模型对照组死亡10只, 存活率为50%, PNS干预组死亡3只, 存活率为81.2%. 给予0.5%的异戊巴比妥钠100 mg/kg ip. 体外心脏采血, 4 ℃静置4 h, 800 r/min离心5 min, 取血清-20 ℃保存待检. 打开腹腔, 取肝脏, 从肝右叶中切取1 cm×1 cm×3-5 mm大小的组织, 置于40 g/L的甲醛溶液中固定, 石蜡包埋、切片. 取6 wk末的各组肝脏, SABC法免疫组织化学染色检测α-SMA, desmin, ICAM-1; LN、Ⅰ和Ⅲ型胶原. 放免法检测PCⅢ, LN. 按Ⅲ型前胶原放射免疫分析试剂盒(平衡法)说明书及层粘蛋白放射免疫分析测定盒说明书进行操作.
统计学处理 计量资料均使用计算机统计软件SPSS11.0中One-Way ANOVA程序进行单因素方差分析, 并用LSD法进行两两比较.
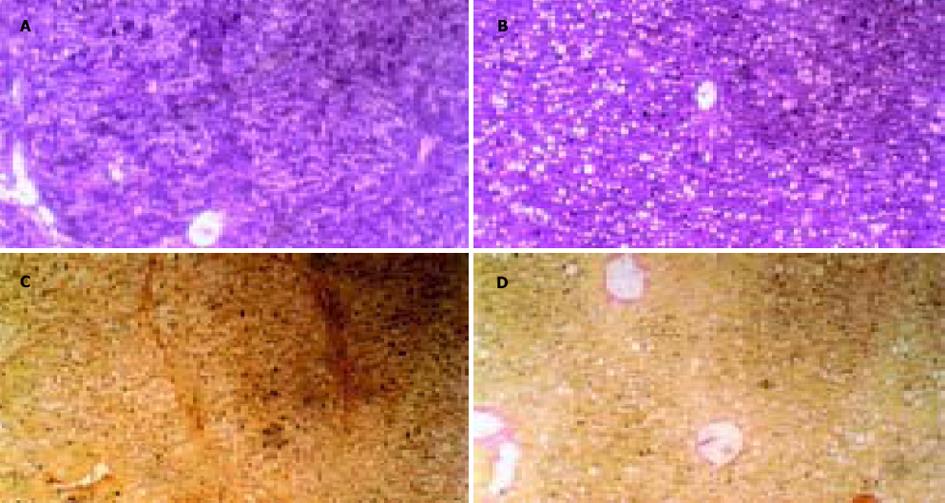
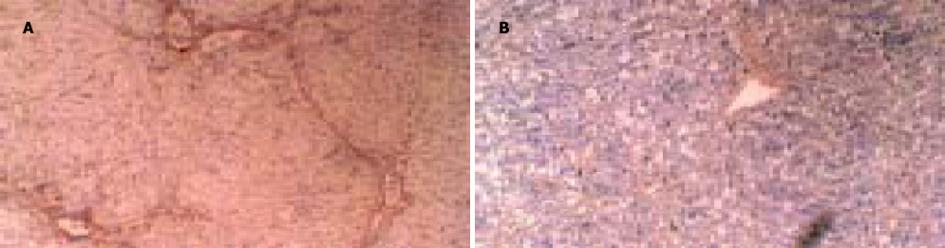
2.1 肝脏组织形态学改变HE和VG染色显示, 2, 4, 6 wk末, 正常对照组大鼠肝小叶结构完整, 无变性、坏死, 无炎症细胞浸润及纤维结缔组织增生. 2 wk末, 模型对照组大鼠肝小叶结构完整, 出现广泛的肝细胞脂肪变性、及散在的气球样变性, 中央静脉及汇管区有大量炎症细胞浸润, 并可见少数点状坏死, VG染色无纤维结缔组织增生; PNS干预组大鼠肝小叶结构完整, 肝细胞脂肪变性、气球样变性、炎症细胞浸润均较模型对照组轻, 无点状坏死及纤维结缔组织增生. 4 wk末, 模型对照组大鼠肝小叶结构仍较完整, 但肝细胞脂肪变性、气球样变性、坏死及炎症细胞浸润较2 wk末明显, 出现片状坏死, VG染色无纤维结缔组织增生; PNS干预组大鼠肝小叶结构完整, 肝细胞脂肪变性、气球样变性、炎症细胞浸润均较模型对照组轻, 见少数点状坏死, 无纤维结缔组织增生. 6 wk末, 模型对照组大鼠肝小叶正常结构被破坏, 部分区域出现假小叶形成, 肝细胞变性、坏死范围增大, 炎症细胞成团浸润, VG染色可见纤维结缔组织增生; PNS干预组大鼠肝小叶结构完整, 肝细胞变性、坏死及炎症细胞浸润均较模型对照组轻, 无假小叶形成, VG染色无纤维结缔组织增生(图1).
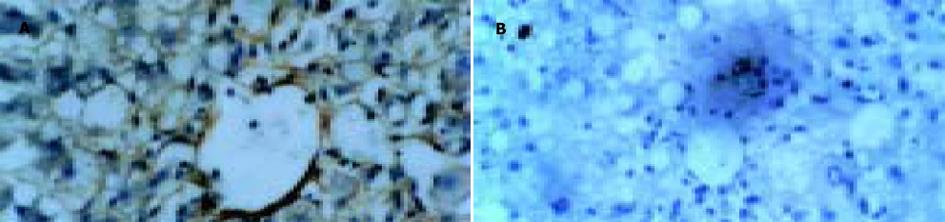
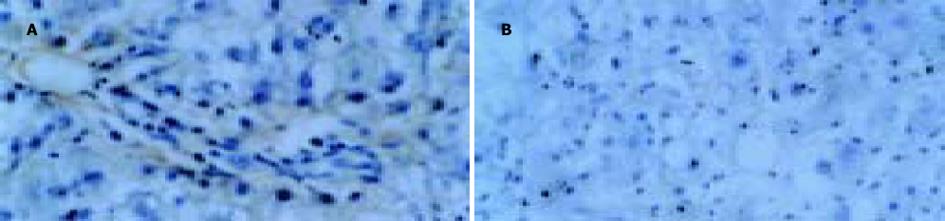
2.2 肝脏α-SMA, desmin, ICAM-1的表达免疫组化染色显示, 正常对照组大鼠肝组织在中央静脉及汇管区无阳性染色出现; 模型对照组在中央静脉及汇管区均出现明显的阳性染色, ICAM-1染色显示在部分中央静脉与中央静脉之间以及中央静脉与汇管区之间的区域也出现阳性染色; PNS干预组在中央静脉及汇管区均出现阳性染色, 但程度较模型对照组轻, 在中央静脉与中央静脉之间以及中央静脉与汇管区之间无阳性染色出现. 高倍镜下, 模型对照组在中央静脉及汇管区α-SMA, desmin, ICAM-1染色阳性细胞数较PNS干预组明显增多(图2-4).
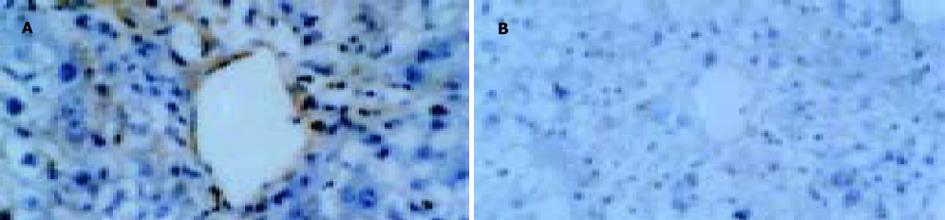
2.3 肝脏纤维组织增生Ⅰ, Ⅲ型胶原和LN免疫组化染色显示, 正常对照组大鼠肝组织无阳性染色出现; 模型对照组在中央静脉与中央静脉之间以及中央静脉与汇管区之间出现阳性染色; PNS干预组在中央静脉与中央静脉之间以及中央静脉与汇管区之间无阳性染色出现(图5).
2.4 血清PCⅢ, LN 与正常对照组相比, 模型对照组和PNS干预组血清PCⅢ(m2 = m4), LN均明显升高, 尤以6 wk末明显. 与模型对照组相比, PNS干预组有比较明显的下降, 与组织学改变具有比较良好的相关性(表1).
肝纤维化是许多肝脏疾病的中间发展环节[8-9], 是大多数慢性肝病向肝硬化发展的共同病理过程[10], 最终会发展为肝硬化[11], 因而治疗肝纤维化具有极为重要的临床意义. 寻找有效治疗药物是目前肝病领域研究的热点[12-15]. 近年来中医药防治慢性肝病显示了光明的前景, 部分中药具有较好的抗纤维化效果[16-19]. Ⅰ型胶原的显著增加是肝纤维化的特征性改变, 在肝纤维化过程中通过基因复制增加和mRNA稳定性增加而有Ⅰ型胶原基因α1的表达增加[20]. 我们采用CCl4复制了慢性肝炎→肝纤维化的动物模型, 观察PNS对肝纤维化的防治作用. 从造模开始即给予PNS干预, 目的在于观察PNS对肝纤维化的防治作用, 同时观察PNS对肝细胞是否具有保护作用. 实验结果表明, 在CCl4诱导大鼠肝纤维化的过程中, 同时给予PNS进行防治, 大鼠肝组织α-SMA, desmin, LN, ICAM-1的表达, Ⅰ, Ⅲ型胶原和LN的增生均明显低于模型对照组. 说明在慢性肝损伤的过程中PNS的应用可抑制HSC的激活与增生, 通过抑制HSC的激活从而减少胶原的形成与沉积, 达到抗肝纤维化的作用.
各种原因所致的肝纤维化的过程中一个显著的病理变化即为纤维间隔近旁肝窦毛细血管化. 肝窦内皮细胞的失窗孔和内皮下连续性基底膜的形成是肝窦毛细血管化的两个主要特征. 文献报道, 层粘蛋白在正常肝窦几乎不表达, 而在慢性肝炎碎片状坏死灶和肝硬化纤维间隔附近的肝窦明显表达, 肝硬化再生结节中的肝窦表达也增强. 表明层粘蛋白可作为肝窦毛细血管化基底膜形成的一个重要标志. 实验结果表明, PNS可抑制HSC的激活减少层粘蛋白的分泌及在Disse间隙的沉积, 可能减轻肝窦毛细血管化的形成, 从而减轻肝细胞的损伤, 防止肝纤维化的形成并延缓其向肝硬化转变. 血清PCⅢ、LN含量能够较好地反应慢性肝病炎症过程和纤维化程度[21]. 实验结果表明, PNS干预后, 2 wk末PCⅢ、LN测得的含量即低于模型对照组, 随着干预的时间的延长, 到6 wk末PCⅢ、LN含量则明显低于模型对照组. 从血清纤维化指标改变方面也证实了PNS对慢性肝损伤后肝纤维化的形成具有一定程度的抑制作用.
编辑: N/A
| 11. | 陈 文慧, 刘 平, 徐 光福, 陆 雄, 熊 卫国, 李 风华, 刘 成海. 脂质过氧化在二甲基亚硝胺大鼠肝纤维化形成过程中的作用. 世界华人消化杂志. 2001;9:645-648. [DOI] |
| 13. | Wang JY, Guo JS, Yang CQ. Expression of exogenous rat collagenase in vitro and in a rat model of liver fibrosis. World J Gastroenterol. 2002;8:901-907. [PubMed] [DOI] |
| 14. | Xu JW, Gong J, Chang XM, Luo JY, Dong L, Hao ZM, Jia A, Xu GP. Estrogen reduces CCL4- induced liver fibrosis in rats. World J Gastroenterol. 2002;8:883-887. [PubMed] [DOI] |
| 15. | Liu P, Hu YY, Liu C, Zhu DY, Xue HM, Xu ZQ, Xu LM, Liu CH, Gu HT, Zhang ZQ. Clinical observation of salvianolic acid B in treatment of liver fibrosis in chronic hepatitis B. World J Gastroenterol. 2002;8:679-685. [PubMed] [DOI] |
| 20. | Yata Y, Scanga A, Gillan A, Yang L, Reif S, Breindl M, Brenner DA, Rippe RA. DNase I-hypersensitive sites enhance alpha1(I) collagen gene expression in hepatic stellate cells. Hepatology. 2003;37:267-276. [PubMed] [DOI] |