修回日期: 2004-01-12
接受日期: 2004-02-12
在线出版日期: 2004-08-15
目的: 探讨环氧合酶(COX)-2抑制剂对酒精诱导的肝损伤大鼠氧化/抗氧化系统的作用.
方法: 应用酒精灌胃法制作酒精性肝损伤大鼠模型, 对照组(n = 10)玉米油+葡萄糖; 损伤组(n = 24)酒精+玉米油; 处理组(n = 24)在损伤组基础上予选择性COX-2抑制剂塞莱昔布(celecoxib).23 d后处死大鼠, 测定血浆和肝组织匀浆谷胱甘肽-S转移酶(GST)活性、超氧化歧化酶(SOD)活性和丙二醛(MDA)水平, 血清门冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)水平, Western blot法检测各组大鼠肝组织中COX-2蛋白的表达.
结果: 与对照组相比, 损伤组中血清AST、ALT、血浆GST活性和肝组织MDA水平明显升高(196.00±29.52 vs 139.78±26.27, 59.43±6.00 vs 46.67±10.09, 17.56±1.26 vs 13.29±4.31, 0.562±0.054 vs 0.465±0.062, P<0.01或P<0.05), 血浆及肝组织SOD活性、肝组织GST活性明显下降(43.969±8.863 vs 57.788±7.587, 2.083±0.394 vs 2.943±0.321, 1.63±0.64 vs 3.54±0.33, P<0.01). 与对损伤相比, 处理组血清AST明显下降、血浆及肝组织SOD活性、肝组织GST活性均明显升高(144.00±18.45 vs 196.00±29.52, 55.547±5.937 vs 43.969±8.863, 2.833±0.176 vs 2.083±0.394, 3.77±0.32 vs 1.63±0.64, P<0.01). Western blot显示, 肝组织中COX-2表达损伤组较对照组明显升高(0.5 239±0.1 399 vs 0.2 255±0.0916, P<0.01), 处理组较损伤组降低, 而较对照组升高(0.3 769±0.1 798 vs 0.5 239±0.1 399, 0.3 769±0.1 798 vs 0.2 255±0.0 916, P<0.05).
结论: COX-2的表达与酒精性肝损伤大鼠肝组织抗氧化酶系呈负相关而与脂质过氧化(lipid peroxides, LPO)产物正相关, 其抑制剂则可以使酒精性肝损伤大鼠肝组织抗氧化酶系活性升高和LPO减轻, 从而对大鼠酒精诱导的肝损伤起保护作用.
引文著录: 易辉, 王新, 苗继延, 樊代明. 环氧合酶-2对酒精性肝损伤大鼠氧化/抗氧化的作用. 世界华人消化杂志 2004; 12(8): 1934-1936
Revised: January 12, 2004
Accepted: February 12, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1934-1936
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1934.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1934
COX是前列腺素类物质合成的限速酶, 几种亚型有诸多不同, COX-2在大多数正常组织中不表达或弱表达[1], 而炎症、肿瘤等病理状态下被诱导表达[2-3]. 以往实验[4]证实, 因为肝脏的氧应激等原因, 可使酒精性肝病(ALD)中COX-2过表达, 而COX-2的表达反过来又进一步加剧肝脏的氧应激, 加重ALD. 乙醇、乙醛的氧化等原因可以导致肝脏的氧应激, 使活性氧产物(ROS)增加, 使脂质、蛋白质和核酸的正常功能受损, 引起细胞变性、坏死, 从而引起ALD[5]. 机体氧化/抗氧化系统的状态可以反应氧应激的强弱, 对疾病的发生、发展和转归产生重要的影响. 但COX-2及其选择性抑制剂对ALD中的氧化/抗氧化系统影响报道很少, 国内尚无有关报道. 我们通过观察塞莱昔布对酒精性肝损伤大鼠中GST活性、SOD活性、MDA水平的影响, 来了解COX-2对ALD大鼠氧化/抗氧化系统的作用, 探索他们之间的关系.
Wistar♂大鼠(第四军医大学实验动物中心).兔抗鼠COX-2 多克隆抗体(美国Cayman公司); 小鼠抗大鼠β-actin单克隆抗体(美国Sigma公司); 辣根过氧化物酶标记羊抗兔及羊抗鼠二抗、化学发光剂ECL(北京中山生物技术有限公司), 塞莱昔布(合肥森瑞化工有限公司), GST、SOD、MDA试剂盒(南京建成生物工程研究所), 其他试剂均为分析纯.
模型建立与标本收集: 58只Wistar♂大鼠, 体质量240-320 g, 用随机数表法随机分为3组. 对照组: 10只, 给予500 g/L葡萄糖液20 mL/kg-1/d-1加玉米油2 g/kg-1/d-1. 损伤组: 24只, 给予玉米油2 g/kg-1/d-1, 加400 g/L酒精4 g/kg-1/d-1共3 d, 8 g/kg-1/d-1 共10 d, 10 g/kg-1/d-1 共10 d, 灌胃. 处理组: 24只, 在与损伤组间等量玉米油+酒精灌胃的基础上, 给予塞莱昔布10 mg/kg-1/d-1灌胃. 灌胃前3 d为1次/d, 其余每日分2次进行. 23 d造模结束后, 全部处死各组大鼠. 共剩余对照组9只, 损伤组7只, 处理组10只. 取血清、血浆(100 g/L EDTA抗凝)、肝组织等进行有关检测. 其中新鲜的肝组织经液氮冷冻后-70 ℃保存待检. AST、ALT测定: 取大鼠血清, 日立7170全自动生化分析仪检测. GST、SOD、MDA测定: 采用比色法, 按试剂盒说明书进行, 分别测定血浆、100 g/L肝组织匀浆MDA水平、GST和SOD活性. COX-2表达检测: 使用Western blot方法检测肝组织COX-2表达. 冷冻的肝组织称重后按1: 10比例用三去污蛋白裂解液裂解, 10 000 rpm×5 min 2次, 取上清. 用考马斯亮蓝(G250)测定蛋白含量.以每样品总蛋白150 μg上样, 用不连续100 g/L SDS聚丙烯酰胺凝胶电泳, 半干转法转蛋白至硝酸纤维素膜; 100 g/L脱脂奶粉封闭; 一抗4 ℃过夜; TBS洗膜; 辣根过氧化物酶标记二抗室温2 h; TBS洗膜; ECL作用后X胶片曝光, 经显影、定影等处理后观察结果. 并用Bandscan软件作灰度扫描分析, 用COX-2与内参照(β-actin)灰度值比值表示各样本COX-2表达强度, 并作统计学处理.
统计学处理 各组实验数据用均数±标准差(mean±SD)表示. 有关原始数据用SPSS统计软件处理, 进行方差齐性检验, 方差分析和相关分析, 以P<0.05为有显著性差异.
AST、ALT损伤组与对照组差别均有显著性意义(P<0.01); 在处理组与损伤组间, AST差别亦有显著性意义(P<0.01), 但ALT差别不显著(表1).
| 组别 | 对照组(n = 9) | 损伤组(n = 7) | 处理组(n = 10) |
| AST(IU/L) | 139.78±26.27 | 196.00±29.52a | 144.00±18.45d |
| ALT(IU/L) | 46.67±10.09 | 59.43±6.00a | 51.90±7.65 |
| 组织GST(U/mgprot) | 3.54±0.33 | 1.63±0.64a | 3.77±0.32d |
| 血浆GST(U/mL) | 13.29±4.31 | 17.56±1.26b | 17.69±3.90b |
| 组织SOD(NU/mgprot) | 2.943±0.321 | 2.083±0.394a | 2.833±0.176d |
| 血浆SOD(NU/mL) | 57.788±7.587 | 43.969±8.863a | 55.547±5.937d |
| 组织MDA(nmoL/mgprot) | 0.465±0.062 | 0.562±0.054b | 0.534±0.089b |
| 血浆MDA(nmoL/mL) | 5.427±0.645 | 6.211±0.656 | 5.565±1.365 |
血浆MDA水平各组间差别不显著, 肝组织MDA水平、肝组织及血浆GST和SOD活性损伤组与对照组差别均有显著性意义; 而处理组与损伤组相比, 肝组织匀浆GST、SOD活性及血浆SOD活性其组间差别有显著性意义, 但肝组织MDA水平及血浆GST活性其组间差别不显著(表1).
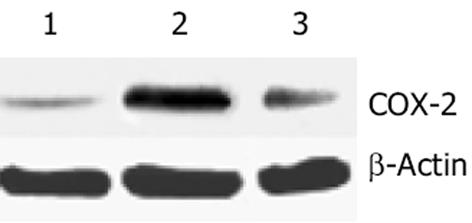
对照组呈弱表达, 损伤组显著高表达, P<0.01 vs 对照组. 处理组与损伤组相比 COX-2表达下调(P<0.05), 但仍高于对照组(P<0.05).灰度值比值: 对照组(n = 8)为0.2 255±0.0 916, 损伤组(n = 7)为0.5239±0.1 399, 处理组(n = 10)为0.3 769±0.1 798(图1).
采用双变量相关分析, AST与肝组织GST、血浆及肝组织SOD活性呈负相关, 与血浆MDA呈正相关. ALT与血浆及肝组织GST活性呈负相关, 与肝组织MDA呈正相关(表2).
| 氧化/抗氧化指标 | 相关系数(r) | P | ||
| AST | ALT | AST | ALT | |
| 组织GST | -0.722 | -0.344 | 0.000 | 0.086 |
| 血浆GST | 0.305 | 0.017 | 0.130 | 0.935 |
| 组织SOD | -0.693 | -0.486 | 0.000 | 0.012 |
| 血浆SOD | -0.603 | -0.494 | 0.001 | 0.010 |
| 组织MDA | 0.329 | 0.439 | 0.101 | 0.025 |
| 血浆MDA | 0.532 | 0.312 | 0.005 | 0.121 |
脂质过氧化(LPO)是脂肪酸(特别是不饱和脂肪酸)的一种自我催化的链式自我氧化反应(autoxidation reaction). LPO可以由ROS引发, 亢进时可引起细胞质膜脂质不饱和脂肪酸的损伤, 导致质膜流动性和通透性改变, 并可造成对酶、核酸的损伤, 进而引起细胞肿胀、变性、坏死等改变, 他可发生在许多疾病过程中, 还可生成大量ROS[6]. 在正常状态下, ROS由机体的抗氧化酶系如SOD、GST、过氧化氢酶和谷胱甘肽氧化酶等清除, 抗氧化酶系活性减低, 就会使机体清除ROS减少、LPO亢进[7]. SOD对机体的氧化与抗氧化平衡起着至关重要的作用, 机体形成的超氧阴离子首先由他作用形成过氧化氢, 后者再经其他抗氧化酶作用最终形成水[8]. MDA是不饱和脂肪酸脂LPO产物之一, 他的高低可反应机体细胞受自由基攻击的严重程度[9]. GST是一组多功能酶, 具有清除过氧化物和解毒等多种功能[10]. SOD、GST的活性高低可反应机体清除ROS的能力, MDA水平高低则反应LPO的强弱, 他们的检测对疾病的病因学探讨有着重要的意义.
在酒精性肝病中, 因为乙醇及其氧化产物的作用, 可使氧自由基增多、LPO亢进, 引起肝细胞受损, 出现肝组织SOD、GST活性减低, MDA水平升高[11]. 而肝细胞中因富含GST(占肝细胞可溶性蛋白的3%), 在肝细胞受损时可很早释放入血, 引起血浆GST活性升高[12]. 本研究结果显示, 在酒精性肝损伤的损伤组中, 肝组织的GST、SOD活性及血浆SOD活性明显降低, 而血浆GST活性升高, MDA则在肝组织和血浆中均升高, 上述结果与对照组相比有显著性差异.在使用塞莱昔布处理后, 肝组织GST及SOD活性和血浆SOD活性明显升高, 与损伤组间差别具有统计学意义; MDA水平有所下降但差别无统计学意义. 另外, 通过相关分析表明, 肝组织GST、血浆及肝组织SOD活性与AST、ALT水平呈负相关, 表明抗氧化酶活性降低可导致肝组织损伤. 血浆GST活性改变趋势及其与AST、ALT的相关性不明显, 可能是因为其反应的是外周和肝组织GST活性及肝细胞的渗透性改变等因素的综合结果. 肝组织及血浆MDA水平与ALT、AST水平分别呈正相关表明, 活性氧或脂质过氧化产物与肝损伤是正相关的.本研究中MDA的变化趋势与AST、ALT一致, 而组间差别的统计学改变并不十分明显, 一方面可能因为LPO仅是氧自由基作用靶点之一, 且MDA又仅是LPO的产物之一, 所以MDA水平的敏感性也就不如SOD活性明显了; 另一方面也可能其本身存在差别, 但实验样本含量较少, 致使统计效能不足, 不能反应他们之间的差别.
自从COX-2被发现以来, 他引起了人们的广泛兴趣, 他在炎症、肿瘤等病理状态下起重要作用, 其表达上调出现于许多疾病过程中. 在ALD中, 他可由氧自由基引发, 并反过来促进肝脏的氧应激, 参与ALD的肝脏炎症、脂肪变性、纤维化等病理变化[13]. 本研究表明, 在早期酒精性肝损伤中, COX-2的表达就已经升高, 并与肝组织GST、血浆及肝组织SOD活性呈负相关, 而与肝组织MDA呈正相关.使用塞莱昔布后, 可以提高抗氧化酶的活性, 减少MDA含量, 从而减轻酒精诱导的肝损伤. COX-2的表达强度与AST、ALT的相关性不明显, 可能是COX-2并不直接引起肝损伤, 而是通过其合成产物引起机体氧化能力增强和/或抗氧化能力减弱, 从而导致肝损伤的缘故.
上述结果表明在酒精性肝损伤中COX-2的表达上调可以使肝损伤加重. 使用选择性COX-2抑制剂则可通过减少对抗氧化酶活性的损害和降低过氧化产物而对酒精诱导的肝损伤起保护作用.
编辑: N/A
| 1. | Okamoto T, Hino O. Expression of cyclooxygenase-1 and -2 mRNA in rat tissues: tissue-specific difference in the expression of the basal level of mRNA. Int J Mol Med. 2000;6:455-457. [PubMed] [DOI] |
| 2. | 吴 汉平, 吴 开春, 李 玲, 幺 立萍, 兰 梅, 王 新, 樊 代明. 人环氧合酶-2(hCOX-2)编码基因的克隆及其反义核酸转染胃癌细胞的初步研究. 世界华人消化杂志. 2000;8:1211-1217. [DOI] |
| 4. | Nanji AA, Jokelainen K, Fotouhinia M, Rahemtulla A, Thomas P, Tipoe GL, Su GL, Dannenberg AJ. Increased severity of alcoholic liver injury in female rats: role of oxidative stress, endotoxin, and chemokines. Am J Physiol Gastrointest Liver Physiol. 2001;281:G1348-G1356. [PubMed] |
| 5. | Tsukamoto H, Lu SC. Current concepts in the pathogenesis of alcoholic liver injury. FASEB J. 2001;15:1335-1349. [PubMed] [DOI] |
| 6. | Kanbagli O, Balkan J, Aykaç-Toker G, Uysal M. Hepatic mitochondrial prooxidant and antioxidant status in ethanol-induced liver injury in rats. Biol Pharm Bull. 2002;25:1482-1484. [PubMed] [DOI] |
| 7. | Mottaran E, Stewart SF, Rolla R, Vay D, Cipriani V, Moretti M, Vidali M, Sartori M, Rigamonti C, Day CP. Lipid peroxidation contributes to immune reactions associated with alcoholic liver disease. Free Radic Biol Med. 2002;32:38-45. [PubMed] [DOI] |
| 8. | Wheeler MD, Nakagami M, Bradford BU, Uesugi T, Mason RP, Connor HD, Dikalova A, Kadiiska M, Thurman RG. Overexpression of manganese superoxide dismutase prevents alcohol-induced liver injury in the rat. J Biol Chem. 2001;276:36664-36672. [PubMed] [DOI] |
| 9. | 陈 文慧, 刘 平, 徐 光福, 陆 雄, 熊 卫国, 李 风华, 刘 成海. 脂质过氧化在二甲基亚硝胺大鼠肝纤维化形成过程中的作用. 世界华人消化杂志. 2001;9:645-648. [DOI] |
| 10. | Degoul F, Sutton A, Mansouri A, Cepanec C, Degott C, Fromenty B, Beaugrand M, Valla D, Pessayre D. Homozygosity for alanine in the mitochondrial targeting sequence of superoxide dismutase and risk for severe alcoholic liver disease. Gastroenterology. 2001;120:1468-1474. [PubMed] [DOI] |
| 12. | Loguercio C, de Girolamo V, Cuomo A, Argenzio F, Iannotta C, Disalvo D, Grella A, del Vecchio Blanco C. Determination of plasma alpha-glutathione-S-transferases in chronic alcohol abusers: relationship with alcohol intake and liver involvement. Alcohol Alcohol. 1998;33:366-372. [PubMed] [DOI] |
| 13. | Nieto N, Greenwel P, Friedman SL, Zhang F, Dannenberg AJ, Cederbaum AI. Ethanol and arachidonic acid increase alpha 2(I) collagen expression in rat hepatic stellate cells overexpressing cytochrome P450 2E1. Role of H2O2 and cyclooxygenase-2. J Biol Chem. 2000;275:20136-20145. [PubMed] [DOI] |