修回日期: 2004-01-01
接受日期: 2004-02-03
在线出版日期: 2004-08-15
目的: 探察小柴胡汤含药血清对体外CCl4诱导的肝细胞损伤模型的保护作用.
方法: 制备小柴胡汤及药群配方的大鼠含药血清, 体外10 mmoL/L CCl4 诱导肝细胞损伤模型, 观察10%药物血清对损伤肝细胞增生率、ALT、细胞形态学以及凋亡率的影响.
结果: 与正常组比较, 模型组肝细胞增生率显著降低 (1.22±1.00, 1.11±0.09, 1.12±0.18, 1.10±0.08, vs 0.78±0.07, P<0.01), 细胞培养上清液中ALT含量显著升高(948±162, 748±278, 1 081±226, 1 148±163, vs 2110±377, P<0.01); 与模型组比较, 小柴胡汤及其药群配方组的肝细胞增生率显著增高(P<0.01), 细胞培养上清液中ALT含量显著降低(P<0.01). 倒置显微镜、Giemsa及TUNEL染色观察到, 模型组肝细胞存在着明显的坏死和凋亡, 小柴胡汤及药群配方的凋亡细胞明显减少. 与正常组比较, CCl4模型组细胞凋亡显著增高(2.9 467±1.0 007 vs 16.3 175±4.5 358, P<0.01); 与模型组比较, 小柴胡汤及药群配方组的细胞凋亡率显著降低(4.2 117±2.3 733, 6.4 800±2.4 052, 5.6 200±2.0 573, 4.6 440±0.8 825, vs 16.3 175±4.5 358, P<0.01).
结论: CCl4引起的肝损伤同时存在着明显的凋亡和坏死, 小柴胡汤及药群配方含药血清对体外CCl4诱导的肝细胞损伤有保护作用.
引文著录: 孙明瑜, 谢鸣, 伊丽萦, 张娜, 王守勇, 牛福玲, 朱陵群, 王硕仁. 小柴胡汤及药群配方含药血清对CCl4损伤肝细胞凋亡的影响. 世界华人消化杂志 2004; 12(8): 1889-1893
Revised: January 1, 2004
Accepted: February 3, 2004
Published online: August 15, 2004
AIM: To explore the effects of drug-contained serum of different herb compatibilities of Xiao Chaihu Tang (XCHT) on a hepatocytic injury model.
METHODS: The hepatocytic injury model was induced by CCl4 (10 mmoL/L-1), The injured hepatocytes were incubated with CCl4 and drug-contained serum of different herb compatibilities of XCHT for 24 h. The cells were observed under microscope with Giemsa and TUNEL staining. The apoptosis rate was measured by flow cytometry.
RESULTS: Different herb compatibilities of XCHT could improve the hepatocytic proliferation rate, which was injured by CCl4 significantly (1.22±1.00, 1.11±0.09, 1.12±0.18, 1.10±0.08, vs 0.78±0.07, P < 0.01), decrease ALT concentration in cell culture solution (948±162,748±278, 1 081±226, 1 148±163, vs 2 110±377, P < 0.01). There were obvious necrosis and apoptosis in the model group cell observed under the convert microscope and Giemsa and TUNEL staining. CCl4 induced the apoptosis of cells in model group (2.9 467±1.0 007 vs 16.3 175±4.5 358, P < 0.01). The original recipe of XCHT group (G), bupleurum root-scutellaria root group (A) resisted the apoptosis induced by CCl4 (4.2 117±2.3 733, 6.4 800±2.4 052, 5.6 200±2.0 573, 4.6 440±0.8 825, vs 16.3 175±4.5 358, P < 0.01).
CONCLUSION: Drug-contained serum of different herb compatibilities of XCHT can protect hepatocytic injury induced by CCl4in vitro. There are obvious apoptosis and necrosis when CCl4 injures the hepatocyte. The different herb compatibilities of XCHT are of the effects of resisting hepatocytic apoptosis induced by CCl4.
- Citation: Sun MY, Xie M, Yi LY, Zhang N, Wang SY, Niu FL, Zhu LQ, Wang SR. Effects of different herb compatibilities of XCHT on a hepatocytic injury model induced by CCl4in vitro. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1889-1893
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1889.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1889
小柴胡汤由柴胡、黄芩、半夏、生姜、人参、甘草、大枣共7味药组成, 常用于治疗各种急慢性肝病[1-4], 现代药理研究表明, 小柴胡汤具有抗急慢性肝损伤的作用[5-8], 且体内抗肝损伤的主要药味为柴胡和黄芩[9-17]. 我们利用CCl4诱导的体外肝细胞损伤模型, 对小柴胡汤及以柴芩为主的药群配伍的作用进行研究, 并探讨具有保肝作用的人参、大枣和甘草[5,7]与柴胡-黄芩配伍是否有协同作用, 能否增强其保护肝细胞的作用, 而生姜-半夏与柴胡-黄芩相配的作用为何?
动物: ♂SD大鼠, 体质量220-250 g, 购自维通利华实验动物中心. 在室温20±2 ℃环境下分笼饲养, 光照12 h (AM 8: 00-PM 8: 00). 实验前适应环境饲养1 wk. BRL-3A大鼠肝细胞株, 引自中国科学院上海细胞所. 柴胡、黄芩、半夏、生姜、人参、甘草、大枣共7味, 购自北京同仁堂药店. 小柴胡汤按全国统编五版教材《方剂学》所载, 由柴胡12 g, 黄芩9 g, 半夏9 g, 生姜9 g, 人参9 g, 甘草6 g, 大枣12 g组成. 将小柴胡汤分成柴-芩、姜-夏、参-草-枣三组配伍药群, 按原方中各药味的剂量配比组成, 共组合成4个不同配方: 柴-芩(A)、柴-芩+姜-夏(D)、柴-芩+参-草-枣(E)、全方即柴-芩+姜-夏+参-草-枣(G). 各组药液均采用合煎形式, 第1遍煎煮时加7倍水, 第2遍加5倍水. 严格控制煎煮时间, 沸腾后, 用控温电炉保持微沸30 min. 合并2次煎液, 脱脂棉过滤, 90 ℃水浴浓缩至2 kg/L原药浓度, 冷藏保存. RPMI1640培养基: GBICO, 用时溶于1 L双蒸水中, 加入2.0 g NaHCO3, 调PH值7.0-7.2, 0.22 um微孔滤膜过滤除菌. 青霉素100 mg/L、链霉素100 mg/L, 100 mL/L灭活胎牛血清. 胰蛋白酶: Sigma. 胎牛血清: Hyclone, 56 ℃灭活30 min, 分装, -20 ℃保存. CCl4: Sigma. 二甲基亚枫(DMSO): Sigma. MTT: Sigma, 使用时称取25 mg的MTT粉剂, 加入PH为7.4、0.01M的PBS液50 mL中, 磁力搅拌器搅拌30 min后, 用0.22 μm的滤器过滤除菌. 姬姆萨(Giemsa stain): 北京益利精细化工公司. 碘化丙啶(PI): Sigma, 1 g 溶于1L 9 g/L NaCl溶液中, 4 ℃保存. RNase A: Sigma, 25 g溶于2.5 L 9 g/L NaCl溶液中, 煮沸5 min, 分装, -20 ℃保存. TBS缓冲液, 原位细胞凋亡检测试剂盒, DAB显色试剂盒: 武汉博士德生物工程有限公司.
♂SD大鼠30只, 随机分为6组, 每组5只, 即正常对照组、小柴胡汤全方组(G)、柴-芩组(A)、柴-芩+姜-夏组(D)、柴-芩+参-草-枣组(E). 各中药组分别给予中药(剂量相当于人临床有效剂量的12倍)灌胃, 1次/d, 连续给药5 d. 正常对照组给予等体积蒸馏水. 于末次给药2 h后, 腹腔注射100 g/L水合氯醛麻醉, 无菌条件下腹主动脉采血, 置无菌试管内. 待凝固后37 ℃水浴1 h, 3 000 r/min, 离心15 min, 分离血清, -20 ℃冰箱冻存备用. 临用时, 56 ℃恒温30 min灭活, 用无血清培养基稀释, 过滤除菌. BRL-3A肝细胞, 2.5 g/L胰蛋白酶消化液消化3-5 min, 加入胎牛血清及时终止胰蛋白酶反应, 收集消化液, 置于50 mL离心管中. 离心1 000 r/min, 5 min. 用含有100 mL/L胎牛血清的RPMI-1640培养液悬浮细胞, 调细胞密度为1×108/L分装于50 mL培养瓶中. 置于37 ℃、CO2培养箱中培养. 肝细胞培养至对数生长期, 用2.5 g/L 胰蛋白酶消化液消化细胞, 调细胞浓度为1×108/L. 细胞接种于96孔板中, 各孔加入100 μL 细胞液, 置于37 ℃、CO2培养箱中贴壁培养24 h. 随机分为6组, 每列为1组, 按顺序依次为: 正常组(N)、模型组(M)、柴芩组(A)、柴芩+姜夏组(D)、柴芩+参草枣组(E)、全方组(G)组. 各组分别加入100 mL/L A、D、E、G含药血清培养液, 同时各孔加入CCl4(少量DMSO助溶), CCl4终浓度为10 mmoL/L. 置于37 ℃、CO2培养箱中, 静止培养24 h. MTT测定[18], 试验重复3次. ALT测定: 吸取培养上清液, 采用赖氏法测定ALT含量.
1.2.1 细胞形态学观察: 对数生长期肝细胞调细胞浓度为4.5×107/L, 将细胞接种于12孔培养板(或已置入无菌盖玻片), 置于37 ℃, CO2培养箱中, 培养24 h. 分组、CCl4损伤及加药方法同上. 将培养细胞的培养板直接置于倒置显微镜下观察, 比较经过CCl4诱导的和未经诱导的细胞形态、大小和凋亡细胞的出现. 姬姆萨染色[19]取出细胞爬片, 晾干后用甲醇固定10 min, 晾干, 放入姬姆萨染色工作液中, 室温染色10 min. PBS分色, 蒸馏水清洗, 室温干燥24 h. 透明, 封片. 普通光学显微镜下观察细胞形态.
1.2.2 流式细胞仪法[20-21]检测细胞凋亡: 分组及加药、造模方法同上. 将六孔培养板中的液体全部收集到50 mL离心管中, 每个培养孔中加入1 mL 2.5 g/L胰酶以消化细胞, 将消化下来的细胞收集到相应的离心管中, 1 000 r/min, 离心10 min. 收集细胞, 用4 ℃ PBS洗细胞, 1 000 r/min, 离心5 min, 清洗2次. 用预冷的终浓度为700 mL/L乙醇固定细胞, 放置4 ℃冰箱过夜. 固定好的细胞离心收集, 去上清, 再用4 ℃ PBS洗细胞2次, 最后于离心管中留取细胞悬液0.5-0.6 mL, 加入20 mg/L RNase, 于37 ℃水浴30 min. 用50 mg/L浓度的碘化丙啶染色, 4 ℃避光放置60 min. 细胞悬液混匀, 过200目尼龙网, 流式细胞仪(FACS Calibur美国BD公司)检测. 应用Cell Quest软件获取细胞10 000个, 进行凋亡细胞记数, 以MODIFIT软件进行凋亡拟合.
1.2.3 原位末端标记方法检测细胞凋亡(TUNEL染色)[22]: 细胞爬片的制备同上. TUNEL染色操作程序: 取细胞附壁良好的盖玻片, 37 ℃ PBS轻轻冲洗2次, 晾干; 40 g/L多聚甲醛/PBS(0.01 moL/L, PH 7.2)室温固定30 min; PBS冲洗2 min×2次(重新水合), 蒸馏水冲洗2 min×2次; 新鲜配制的30 mL/L H2O2室温作用7 min; 蒸馏水洗2-5 min×3次, 滴加TBS新鲜稀释的蛋白酶K(1: 100), 37 ℃消化3 min; TBS洗 2 min×3次(RT); 甩去多余液体后加标记液20 μL/片, 置湿盒中37 ℃标记2 h. TBS洗 2 min×3次, 每片加封闭液50 μL, 室温30 min, 甩掉(吸取封闭液), 不洗; 用封闭液1: 100稀释生物素化抗地高辛抗体50 μL/片加至标本片上, 置于湿盒中, 37 ℃反应30min; 0.1moL/L TBS洗 2 min×3次, 用0.1 M TBS稀释SABC(不能用封闭液稀释)1: 100, 置于湿盒中, 37 ℃反应60 min; TBS洗 5min×4次, DAB显色, 蒸馏水洗; 苏木素轻度复染, TBS洗, 蒸馏水洗. 脱水、透明, 封片, 镜检, 棕黄色为阳性结果.
统计学处理 各组数据用mean±SD 表示. 各组数据采用方差分析(ANOVA), 多组间比较采用q检验, 全部数据用SPSS10.0统计软件处理.
与正常组(1.14±0.11)相比, 模型组(0.78±0.07)细胞增生率明显降低(P<0.01); 与模型组相比, 小柴胡汤及其药群配方组的细胞增生率明显增高, 均有显著性差异(1.22±1.00, 1.11±0.09, 1.12±0.18, 1.10±0.08 vs 0.78±0.07, P<0.01); 药群配伍组之间比较, 全方组(1.22±1.00)细胞增生率显著高于柴芩(1.11±0.09)、柴芩+姜夏(1.12±0.18)、柴芩+参草枣(1.10±0.08)(P<0.05).
与正常组(165±101 nkat/L)相比, 模型组(2 110±377 nkat/L)细胞培养上清液中ALT含量显著增高(P<0.01). 与模型组相比, 小柴胡汤(948±162 nkat/L)及其药群配方各组细胞培养上清液中ALT含量均显著降低(P<0.01). 药群配方各组之间比较, 柴芩组(748±278 nkat/L)培养上清中ALT含量显著低于柴芩+姜夏(1 081±226 nkat/L)、柴芩+参草枣(1 148±163 nkat/L)组(P<0.01).
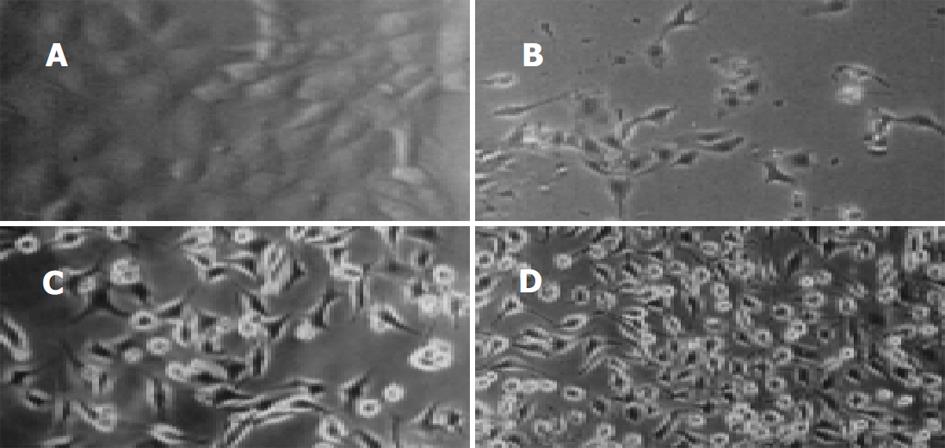
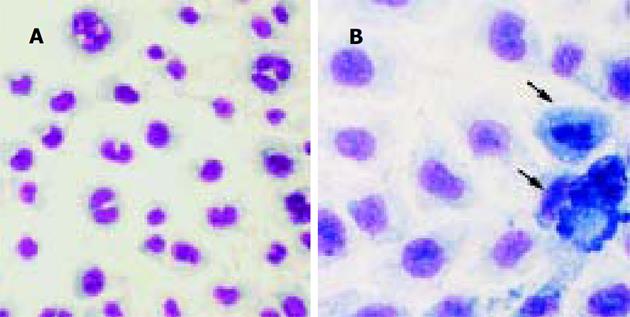
倒置显微镜下观察到, 正常组细胞生长状态良好, 融合成片, 呈圆形、类圆形、多角形或梭形, 比较厚实, 舒展(图1). 模型组细胞可见大片脱落细胞碎片, 细胞质回缩, 细胞间隙增大, 凋亡细胞体积变小, 变形, 细胞凋亡晚期可见凋亡小体. 而坏死细胞的体积胀大, 细胞膜损伤或裂解成碎片(图2). 小柴胡及药群配方各组中可见到小片坏死脱落细胞碎片, 但细胞密度明显大于模型组, 细胞形态尚好(图3-4). Giemsa染色片光镜下观察到, 正常组细胞核染成粉红色, 细胞圆形或类圆形, 细胞质淡蓝色形状规则, 可见细胞分裂相. 模型组细胞分布较稀疏, 处于分裂期细胞明显增多. 多细胞可明显的凋亡形态改变: 细胞出现发泡现象, 细胞染色质浓缩、出现靠近核膜和核着边现象, 核膜裂解、染色质分割成块状; 细胞周围可见多个完整膜包裹的凋亡小体; 偶可见坏死细胞, 细胞肿胀崩解, 形态不规则. 小柴胡汤及药群配方组细胞分布较模型组密集, 细胞形态完整, 处于分裂期细胞多于正常组, 但少于模型组, 偶可见凋亡细胞.
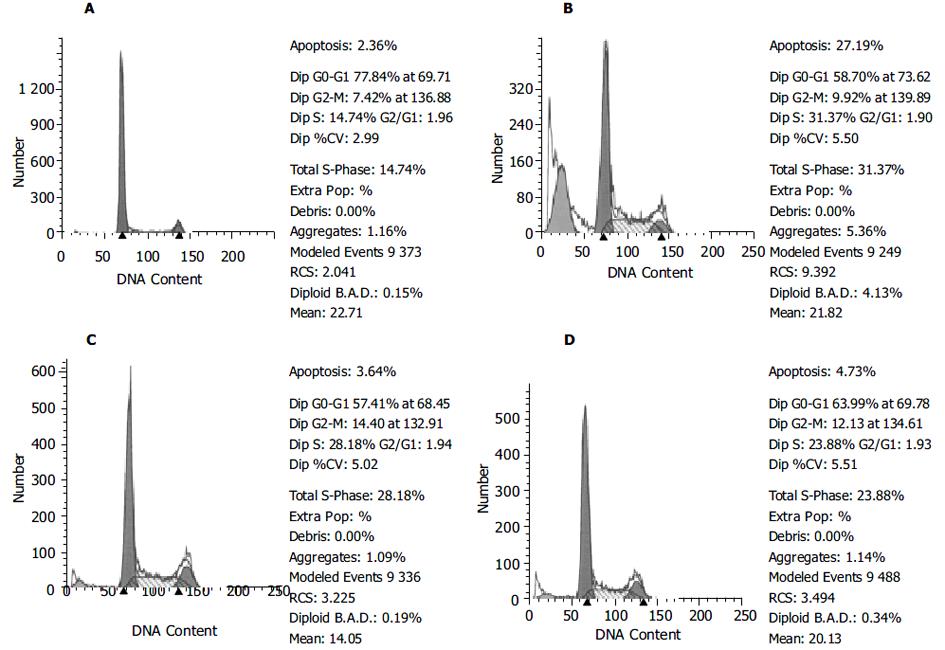
与正常组相比, 模型组细胞凋亡率显著增高(16.3 175±4.5 358 vs 2.9 467±1.0 007, P<0.01); 与模型组相比, 柴芩、柴芩+姜夏、柴芩+参草枣、柴芩+姜夏+参草枣(全方)四个配方组的细胞凋亡率均显著降低(4.2 117±2.3 733, 6.4 800±2.4 052, 5.6 200±2.0 573, 4.6 440±0.8 825, vs 16.3 175±4.5 358, P<0.01); 小柴胡汤及药群配方各组之间比较, 没有显著性差异(P>0.05). 与正常组相比, 模型组G0-G1细胞数显著减少(57.1 967±4.4 468 vs 77.3 740±0.8 057, P<0.05), G2-M细胞和S细胞数显著增加(11.3 317±3.8 819 vs 7.5 040±0.2 881, 31.4 667±7.4 804 vs 15.1 020±0.6 854; P<0.05). 与模型组相比, 柴芩组的G0-G1细胞和S细胞数较模型组分别显著增加和降低(60.5 650±0.7 790 vs 57.1 967±4.4 468, 25.9 367±1.5 182 vs 31.4 667±7.4 804, P<0.05); 柴芩+姜夏和柴芩+参草枣二组的G2-M细胞数较模型组显著增加(16.0 550±1.4 985, 14.6 680±0.8 456 vs 11.3 317±3.8 819, P<0.05)(表1).
| Group | n | Apoptosis (%) | G0-G1(%) | G2-M (%) | S (%) |
| N | 6 | 2.9 467±1.0 007b | 77.3 740±0.8 057a | 7.5 040±0.2 881a | 15.1020±0.6854a |
| M | 4 | 16.3 175±4.5 358 | 57.1 967±4.4 468 | 11.3 317±3.8 819 | 31.4667±7.4804 |
| D | 4 | 6.4 800±2.4 052b | 55.9 475±1.5 836 | 16.0 550±1.4 985a | 27.9950±1.0579 |
| E | 6 | 5.6 200±2.0 573b | 55.7 520±0.6 517 | 14.6 680±0.8 456a | 29.6300±0.7535 |
| A | 5 | 4.6 440±0.8 825b | 60.5 650±0.7 790a | 13.4 967±1.2 290 | 25.9367±1.5182a |
| G | 5 | 4.2 117±2.3 733b | 60.2 860±4.0 115 | 12.0 120±0.9 684 | 27.1040±3.7141 |
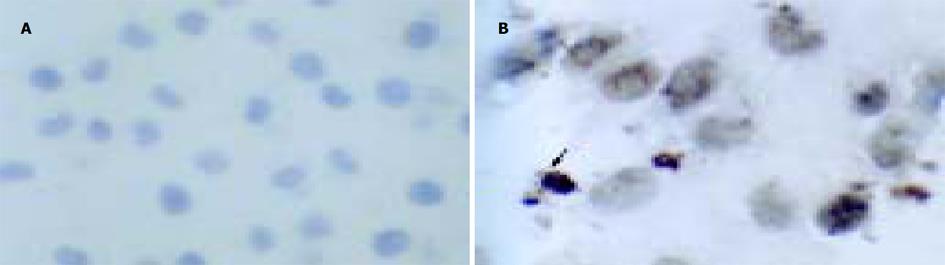
TUNEL染色中的细胞核呈棕黄色是凋亡细胞. 从图中可以看出, 正常组肝细胞核未见到明显的棕黄色染色; 模型组中可见很多细胞核被棕黄色深染的凋亡细胞; 小柴胡汤及其药群配方组中也可散见胞核被棕黄色深染的凋亡细胞, 但数量明显少于模型组.
我们发现体外10 mmoL/L CCl4引起的肝损伤同时存在着明显的凋亡和坏死. 而小柴胡汤和药群配方组只是偶见凋亡, 表明小柴胡汤及药群配方可能具有抗CCl4诱导的肝细胞凋亡的作用. 已有不少研究发现体内给以CCl4引起肝细胞凋亡的证据[22-23], 并了解到CCl4对肝细胞凋亡的影响存在剂量依赖关系, 小剂量时以凋亡多见, 大剂量时则以死亡为主. 目前有关体外CCl4诱导肝细胞凋亡的研究较少. 本研究运用流式细胞仪进行定量分析, 发现10 mmoL/L CCl4可引起肝细胞G1期前出现明显的Ap亚峰即凋亡峰, 凋亡率显著增高.
曾有报道含有黄芩的中药复方制剂和黄芩的主成分黄芩甙作用于原代培养大鼠肝细胞, 结果证实其能显著抑制TNF-α+Act-D诱导的肝细胞凋亡. 柴胡对体外诱导的肝细胞损伤也有较强的保护作用. 但柴胡和(或)黄芩对于体外CCl4诱导的肝细胞损伤的保护作用的研究尚未有见. 而我们的研究结果显示, 柴芩、柴芩+姜夏、柴芩+参草枣、全方四个配伍组的凋亡率均有不同程度降低, 柴芩和全方作用最好, 而在柴芩配伍姜夏或者配伍参草枣时的作用并没有显著的增强, 反而有所降低, 看来并不是简单的加和作用, 其中复杂的配伍关系还有待于深入研究. 研究结果进一步揭示, CCl4可以诱导肝细胞凋亡, 小柴胡汤及药群配方有对抗CCl4 诱导的肝细胞凋亡的作用.
DNA周期分析的结果显示模型组G0-G1期细胞数显著减少, G2-M期细胞和S期细胞数显著增加. 这与Giemsa染色观察到模型组有更多的细胞处于分裂期的结果是一致的, 提示CCl4损伤后可能出现代偿性分裂增生现象. 这与前期的体内试验CCl4损伤组小鼠的肝细胞在损伤区域的周围双核细胞增多及处于分裂期细胞增加的代偿现象是一致的. 提示可能是肝细胞对抗CCl4诱导的坏死和凋亡的一种代偿增生现象. 而柴芩组的S细胞数较模型组显著降低, 提示可能与柴芩对抗CCl4的损伤(坏死和凋亡)从而细胞能保持相对正常的分化有关.
有不少研究表明柴胡和黄芩皆有促进肿瘤细胞凋亡的作用, 而我们的研究显示出柴胡和黄芩能够抑制体外CCl4诱导的肝细胞凋亡, 揭示柴胡、黄芩对受损伤的正常细胞和肿瘤细胞的影响是不同的, 其对CCl4诱导的肝细胞损伤的保护机制还有待于进一步探讨.
编辑: N/A
| 1. | Yagura M, Murai S, Kojima H, Tokita H, Kamitsukasa H, Harada H. Does the control of alanine aminotransferase levels lead to a regression of liver fibrosis in chronic hepatitis C patients? Hepatol Res. 2001;19:144-157. [PubMed] [DOI] |
| 3. | Yagura M, Murai S, Kojima H, Tokita H, Kamitsukasa H, Harada H. Changes of liver fibrosis in chronic hepatitis C patients with no response to interferon-alpha therapy: including quantitative assessment by a morphometric method. J Gastroenterol. 2000;35:105-111. [PubMed] [DOI] |
| 4. | Schuppan D, Krebs A, Bauer M, Hahn EG. Hepatitis C and liver fibrosis. Cell Death Differ. 2003;10 Suppl 1:S59-S67. [PubMed] [DOI] |
| 6. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Yanase K, Namisaki T, Yamazaki M, Tsujinoue H, Imazu H. Extracellular matrix remodeling may predominate over hepatocyte injury in hepatocellular carcinoma development. Oncol Rep. 2003;10:957-962. [PubMed] [DOI] |
| 7. | Kusunose M, Qiu B, Cui T, Hamada A, Yoshioka S, Ono M, Miyamura M, Kyotani S, Nishioka Y. Effect of Sho-saiko-to extract on hepatic inflammation and fibrosis in dimethylnitrosamine induced liver injury rats. Biol Pharm Bull. 2002;25:1417-1421. [PubMed] [DOI] |
| 8. | Shiota G, Maeta Y, Mukoyama T, Yanagidani A, Udagawa A, Oyama K, Yashima K, Kishimoto Y, Nakai Y, Miura T. Effects of Sho-Saiko-to on hepatocarcinogenesis and 8-hydroxy-2'-deoxyguanosine formation. Hepatology. 2002;35:1125-1133. [PubMed] [DOI] |
| 9. | Wang BJ, Liu CT, Tseng CY, Wu CP, Yu ZR. Hepatoprotective and antioxidant effects of Bupleurum kaoi Liu (Chao et Chuang) extract and its fractions fractionated using supercritical CO(2) on CCl(4)-induced liver damage. Food Chem Toxicol. 2004;42:609-617. [PubMed] [DOI] |
| 10. | Wen-Sheng W. ERK signaling pathway is involved in p15INK4b/p16INK4a expression and HepG2 growth inhibition triggered by TPA and Saikosaponin a. Oncogene. 2003;22:955-963. [PubMed] [DOI] |
| 11. | Wu WS, Hsu HY. Involvement of p-15(INK4b) and p-16(INK4a) gene expression in saikosaponin a and TPA-induced growth inhibition of HepG2 cells. Biochem Biophys Res Commun. 2001;285:183-187. [PubMed] [DOI] |
| 12. | Chiang LC, Ng LT, Liu LT, Shieh DE, Lin CC. Cytotoxicity and anti-hepatitis B virus activities of saikosaponins from Bupleurum species. Planta Med. 2003;69:705-709. [PubMed] [DOI] |
| 13. | Jang SI, Kim HJ, Hwang KM, Jekal SJ, Pae HO, Choi BM, Yun YG, Kwon TO, Chung HT, Kim YC. Hepatoprotective effect of baicalin, a major flavone from Scutellaria radix, on acetaminophen-induced liver injury in mice. Immunopharmacol Immunotoxicol. 2003;25:585-594. [PubMed] [DOI] |
| 14. | Zhang JL, Che QM, Li SZ, Zhou TH. Study on metabolism of scutellarin in rats by HPLC-MS and HPLC-NMR. J Asian Nat Prod Res. 2003;5:249-256. [PubMed] [DOI] |
| 15. | Bae HS, Kim YS, Cho KH, Lee KS, Kim JJ, Lee HU, Kim DH. Hepatoprotective activity of reduohanxiao-tang (yuldahanso-tang) is related to the inhibition of beta-glucuronidase. Am J Chin Med. 2003;31:111-117. [PubMed] [DOI] |
| 16. | Nan JX, Park EJ, Kim YC, Ko G, Sohn DH. Scutellaria baicalensis inhibits liver fibrosis induced by bile duct ligation or carbon tetrachloride in rats. J Pharm Pharmacol. 2002;54:555-563. [PubMed] [DOI] |
| 17. | Taira Z, Yabe K, Hamaguchi Y, Hirayama K, Kishimoto M, Ishida S, Ueda Y. Effects of Sho-saiko-to extract and its components, Baicalin, baicalein, glycyrrhizin and glycyrrhetic acid, on pharmacokinetic behavior of salicylamide in carbon tetrachloride intoxicated rats. Food Chem Toxicol. 2004;42:803-807. [PubMed] [DOI] |
| 18. | Mahler S, Desille M, Frémond B, Chesné C, Guillouzo A, Campion JP, Clément B. Hypothermic storage and cryopreservation of hepatocytes: the protective effect of alginate gel against cell damages. Cell Transplant. 2003;12:579-592. [PubMed] [DOI] |
| 19. | Ge YF, Huang YF, Zhang GY, Wang XH, Xu JP. Studies on apoptosis of spermatogenic cells in normal fertile men treated with supraphysiological doses of testosterone undecanoate. Asian J Androl. 1999;1:155-158. [PubMed] |
| 20. | Yao XX, Tang YW, Yao DM, Xiu HM. Effects of Yigan Decoction on proliferation and apoptosis of hepatic stellate cells. World J Gastroenterol. 2002;8:511-514. [PubMed] [DOI] |
| 21. | Qu W, Kasprzak KS, Kadiiska M, Liu J, Chen H, Maciag A, Mason RP, Waalkes MP. Mechanisms of arsenic-induced cross-tolerance to nickel cytotoxicity, genotoxicity, and apoptosis in rat liver epithelial cells. Toxicol Sci. 2001;63:189-195. [PubMed] [DOI] |
| 22. | Nakamoto N, Tada S, Kameyama K, Kitamura K, Kurita S, Saito Y, Saito H, Ishii H. A free radical scavenger, edaravone, attenuates steatosis and cell death via reducing inflammatory cytokine production in rat acute liver injury. Free Radic Res. 2003;37:849-859. [PubMed] [DOI] |
| 23. | Hamasaki K, Nakashima M, Naito S, Akiyama Y, Ohtsuru A, Hamanaka Y, Hsu CT, Ito M, Sekine I. The sympathetic nervous system promotes carbon tetrachloride-induced liver cirrhosis in rats by suppressing apoptosis and enhancing the growth kinetics of regenerating hepatocytes. J Gastroenterol. 2001;36:111-120. [PubMed] [DOI] |