修回日期: 2004-03-01
接受日期: 2004-03-04
在线出版日期: 2004-08-15
目的: 探讨TFPI-2表达与胰腺癌细胞体外和体内浸润能力之间的关系.
方法: 脂质体介导人类TFPI-2真核表达载体pBos-Cite-neo/ TFPI-2转染胰腺癌细胞系Panc-1, G418筛选阳性细胞, RT-PCR, Western blot技术检测转染前后胰腺癌细胞中TFPI-2 mRNA以及相应蛋白质的表达水平; 利用Boyden小室检测转染前后胰腺癌细胞穿膜的细胞数, 比较转染前后胰腺癌细胞的裸鼠成瘤大小, 以此作为评价胰腺癌细胞体外和体内浸润能力的指标.
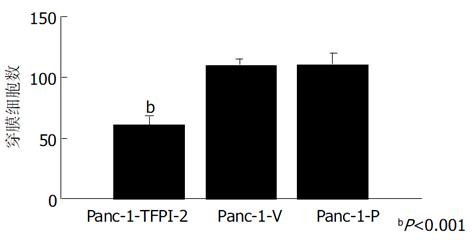
结果: 转染成功的胰腺癌细胞证实有TFPI-2 mRNA和相应蛋白质的表达; 与未转染的细胞相比, 转染TFPI-2的细胞体外浸润能力显著下降(穿膜细胞数为60.7±7.6 , 109.7±5.5 和 110.7±9.0, P<0.001); 3 wk后裸鼠成瘤明显缩小(0.39 cm×0.36 cm, 0.56 cm×0.50 cm 和 0.60 cm×0.52 cm, P<0.001), 病理切片亦证实没有肌层浸润现象.
结论: TFPI-2表达可显著抑制胰腺癌细胞的体外和体内浸润能力, 为进一步开展胰腺癌的基因治疗提供实验依据.
引文著录: 俞建雄, 袁静, 王春友, 陈立波, 周峰. 组织因子途径抑制物2对胰腺癌细胞浸润能力的影响. 世界华人消化杂志 2004; 12(8): 1884-1888
Revised: March 1, 2004
Accepted: March 4, 2004
Published online: August 15, 2004
AIM: To elucidate the relation between TFPI-2 expression and pancreatic cancer cell invasion.
METHODS: Human TFPI-2 expression vector pBos-Cite-neo/TFPI-2 was transfected into pancreatic cancer cell line Panc-1. After being selected by G418, transfected and nontransfected cells were screened for TFPI-2 mRNA and protein by reverse transcription-polymerase chain reaction and Western blot analysis, respectively. The number of transfected or nontransfected cells passing through membrane of Boyden chamber and the ability of tumorigenesis in nude mice was counted as the basis assessing invasive behaviors of the tumor cells.
RESULTS: Expression of mRNA and protein of TFPI-2 was confirmed in transfected cells. In invasion assay, the number of TFPI-2-expressing cells to traverse a Matrigel-coated membrane was obviously decreased compared with that of non-expressing cells (60.7±7.6, 109.7±5.5 or 110.7±9.0, P < 0.001); The size grown in nude mice was significantly smaller than its counterpart at 3 weeks (0.39 cm×0.36 cm, 0.56 cm×0.50 cm or 0.60 cm×0.52 cm, P < 0.001), which were also confirmed no apparent vertical invasion into the muscle layers by pathology.
CONCLUSION: Expression of TFPI-2 may strongly inhibit the invasive ability of pancreatic tumor cells in vitro and in vivo, which provides an experimental basis for the treatment of human pancreatic cancer with gene-therapy.
- Citation: Yu JX, Yuan J, Wang CY, Chen LB, Zhou F. Role of tissue factor pathway inhibitor-2 in pancreatic cancer cell invasion. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1884-1888
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1884.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1884
近年研究表明, 肿瘤细胞分泌的多种丝氨酸蛋白酶以及基质金属蛋白酶(matrix metalloproteinases, MMPs)所参与的细胞外基质(extracellular matrix, ECM)降解是肿瘤细胞实现浸润转移过程中的关键一步[1]. 因而, 减弱这些酶的活性, 保护ECM结构完整可能达到抑制肿瘤细胞浸润转移的目的. 组织因子途径抑制物2(tissue factor pathway inhibitor-2, TFPI-2), 又称胎盘蛋白5(placenta protein 5, PP-5)是一种Mr 32 000的丝氨酸蛋白酶抑制物, 体外可抑制纤溶酶、胰蛋白酶、MMPs在内的多种蛋白酶, 在纤溶、伤口愈合、血管生成以及肿瘤细胞浸润转移等一系列病理生理过程中发挥重要作用[2]. 本研究将TFPI-2基因真核表达载体转染人胰腺癌细胞Panc-1, 观察其对胰腺癌细胞体内外浸润能力的影响.
人源性胰腺癌细胞系Panc-1购自中国医学科学院基础所细胞中心; 裸鼠由华中科技大学同济医学院实验动物中心提供. 试剂: (1)TFPI-2真核表达载体pBos-Cite-neo/TFPI-2和抗TFPI-2多克隆抗体: 协和血液内科仲任博士惠赠. (2)DMEM高糖培养基, G418, Trizol 试剂, Lipofectamine 2000及胎牛血清: 美国Gibco公司产品. (3)M-MLV酶和Taq 酶: 美国Promega公司产品. (4)Matrigel matrix: 美国B.D公司产品.
人胰腺癌细胞Panc-1接种于含100 mL/L小牛血清的DMEM培养液培养瓶内, 置37 ℃、饱和湿度、50 mL/L CO2的培养箱中培养, 每3-5 d消化转代. 取对数生长期Panc-1细胞, 接种于6孔培养板, 每孔含细胞数2×105个, 培养24 h后细胞长至80%-90%融合, 用无血清DMEM培养液洗涤细胞2次以备转染用.
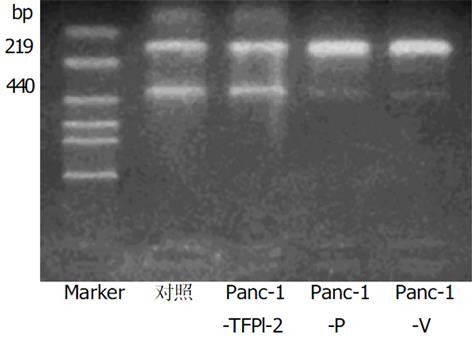
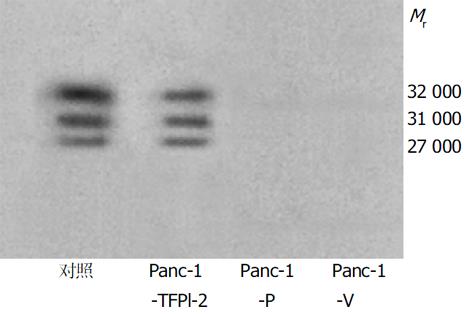
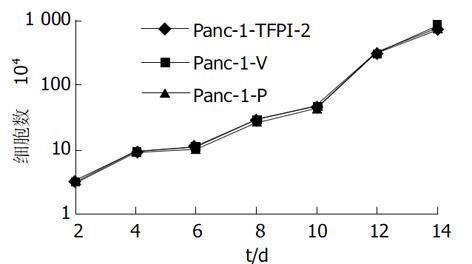
1.2.1 体外实验: 采用脂质体介导的基因转染法. 脂质体为Lipofectamine2000, 真核细胞表达质粒pBos-Cite-neo/TFPI-2含有Neo标记基因. 转染方法按说明书进行, 设为3组细胞, 转染pBos-Cite-neo/TFPI-2表达载体的为实验组, 命名为Panc-1-TFPI-2, 转染空载体和未转染细胞为对照组, 分别命名为Panc-1-V 和Panc-1-P. 用含G418 400 mg/L的100 mL/L胎牛血清的DMEM培养基抗性筛选, 挑选阳性克隆继续在含G418 200 mg/L的培养液中维持生长2 wk, 扩大培养. TFPI-2基因表达情况的检测: (1)逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)检测: 采用RT-PCR技术检测三组细胞中TFPI-2 mRNA的表达: 人类TFPI-2的PCR上、下游引物分别为5'-GTCGATTCTGCTGCTTTTCC-3'和5'-ATGGAATTTTCTTTGGTGCG-3'[3], 合成产物为440 bp; β-actin作为内参照, 上、下游引物分别为5'-GAAACTACCTTCAACTCCATC-3'和5'-CGAGGCCAGGATGGAGCCGCC -3', 产物为219 bp. 用Trizol试剂提取细胞总RNA, 紫外分光光度计检测其浓度和纯度后, 经M-MLV 行逆转录反应, 生成的 cDNA在Taq 酶作用下PCR仪上扩增35个循环. 产物经15 g/L琼脂糖凝胶电泳分析, 紫外灯下观察、摄像. (2)蛋白印迹 (western blot) 分析: 采用Western blot法分析三组细胞TFPI-2蛋白的表达, 抽提CM蛋白方法见参考文献[4]. 样品用10% SDS-聚丙烯酰胺凝胶电泳分离后, 恒压转移到PVDF膜上, 用含5%脱脂牛奶的TBST缓冲液封闭, 4 ℃过夜, 加入TBST 1: 5 000稀释抗TFPI-2多抗, 室温孵育90 min, TBST洗5次, 再用 HRP标记的抗兔二抗孵育60 min, 显色, 照相. (3)生长曲线测定: 观察转染TFPI-2对胰腺癌细胞生长有无抑制作用, 取对数生长期三组Panc-1细胞, 接种于100 mm培养板, 每组设3个复孔, 每孔接种1×104细胞.每隔1 d定时行细胞计数, 取平均值, 连续2 wk. (4) Boyden小室体外浸润实验: 采用Boyden小室检测三组细胞体外穿透人工重组ECM的能力, 具体方法见文献[4]. 每组细胞设三个复孔, 每孔细胞数目大约为5×105个, 体积大约为25 μL, 37 ℃培养6 h, 甲醇固定并Giemsa染色. 每个孔随机计算5个视野(×100)穿膜的细胞数, 求平均数. 穿膜的肿瘤细胞数目多少作为评价肿瘤细胞浸润能力强弱的指标.
1.2.2 体内实验: 取4 wk龄的♂裸鼠(BALB/c -/- )15只, 分为3组, 每组皮下注射实验组(Panc-1-TFPI-2细胞)、对照组(Panc-1-P细胞)与控制组(Panc-1-V细胞)各0.2 mL (细胞密度为5×1010cells/L), 21 d后测量肿瘤大小, 并估算其重量(宽×长2/2). 处死后取接种部位及肝、肺组织行病理切片检查.
统计学处理 采用SPSS11.0统计软件包进行ANOVA检验, 检验水准α = 0.05.
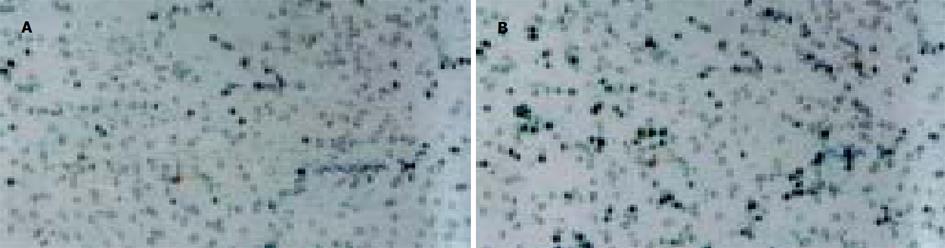
采用脂质体介导转染法, 经G418克隆筛选后获得稳定转染细胞.其基因表达情况检测: (1)TFPI-2基因在胰腺癌细胞中的表达: Panc-1-TFPI-2细胞经RT-PCR检测可见明显的TFPI-2 mRNA表达, 而Panc-1-P细胞和Panc-1-V细胞仅有极低量TFPI-2 mRNA表达(图1). (2) TFPI-2蛋白在胰腺癌细胞中的表达与RT-PCR结果相似, Panc-1-TFPI-2细胞ECM抽提物中有Mr 27 000、31 000、32 000三种TFPI-2蛋白表达, 而Panc-1-P细胞和Panc-1-V细胞ECM抽提物中没有任何一种TFPI-2蛋白的表达(图2). (3) 胰腺癌细胞的生长曲线: 3组生长曲线经ANOVA方差分析表明TFPI-2表达对胰腺癌细胞生长无抑制作用(图3). (4)胰腺癌细胞体外浸润实验: 把Matrigel铺在人工膜表面, 模拟体内ECM环境, 使肿瘤细胞不能自由穿过人工膜, 必须借助分泌的蛋白酶破坏Matrigel后细胞才可以穿过, 以检测肿瘤细胞的浸润能力.本实验中Panc-1-TFPI-2、Panc-1-P和Panc-1-V三组细胞穿过人工膜的细胞数分别为60.7±7.6、109.7±5.5和110.7±9.0, (图4, 5A, B), F = 41.2, P<0.001, 统计学有极显著差异, 说明TFPI-2表达可以明显抑制胰腺癌细胞的体外浸润.
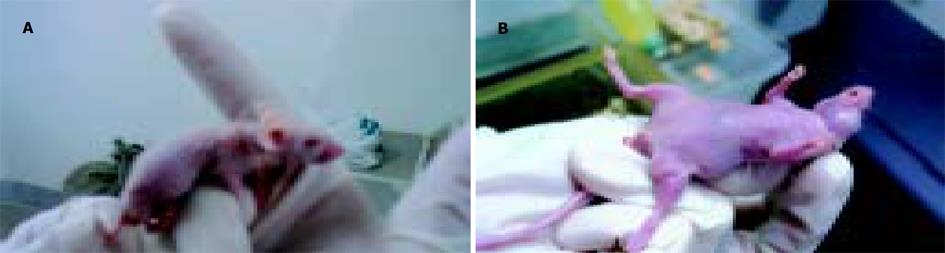
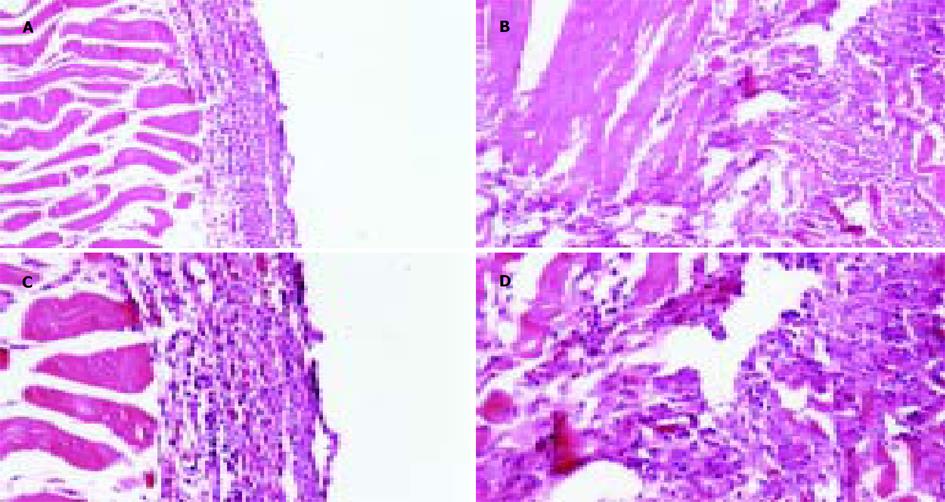
模拟体内环境, 评估肿瘤细胞成瘤能力大小. 结果表明, TFPI-2表达可显著降低胰腺癌细胞的成瘤能力, 实验组裸小鼠成瘤实体明显小于对照组和控制组(相对大小: 0.39 cm×0.36 cm 、0.56 cm×0.50 cm和0.60 cm×0.52 cm, F = 36.8(长值)或 F = 94.4(宽值), P<0.001; 成瘤相对质量: 0.027±0.004 g 、0.081±0.014 g和0.093±0.020 g, F = 30.8, P<0.001), 病理切片发现虽然在第21 d时3组中肝肺并未发现转移灶, 但Panc-1-P组和Panc-1-V组细胞接种的裸小鼠大腿内侧新生物组织被证实是肿瘤组织, 且浸润到肌层, 使肌层组织结构被破坏, 肌纤维排列紊乱, 而Panc-1-TFPI-2组细胞接种的裸小鼠背部新生物组织虽也证实是肿瘤, 但其周边整齐, 没有肌层浸润现象.(表1及图6, 7).
| 细胞类型 | 相对大小(cm) | 相对质量(g) | 肺肝转移 |
| Panc-1-P | 0.56×0.50 | 0.093±0.020 | 0/10 |
| Panc-1-V | 0.60×0.52 | 0.081±0.014 | 0/10 |
| Panc-1-TFPI-2 | 0.39×0.36b | 0.027±0.004b | 0/10 |
浸润和转移是胰腺癌最重要的生物学特性, 与其他肿瘤相比, 胰腺癌发生转移早且较严重, 是导致患者丧失手术机会、5年生存率极差的关键原因所在. 针对肿瘤的发生和发展与肿瘤细胞及其周围内环境密切相关, 因此, 应从肿瘤细胞本身和肿瘤生长的内环境两方面入手进行肿瘤的研究和诊治.随着DNA重组技术的发展和对肿瘤是基因异常持续发展结果的认可, 基因治疗技术这正逐渐成为治疗肿瘤的重要手段之一. 基质金属蛋白酶(matrix metalloproteinase, MMPs)在胰腺癌浸润和转移中发挥至关重要的作用[5], 体外试验证明, 将组织金属蛋白酶抑制物(tissue inhibitor of metalloproteinase, TIMP)转染人胰腺癌细胞Panc-1后, 在不改变MMP2的含量同时, 可显著性降低胰腺癌细胞裸鼠接种的成功率、抑制接种瘤的生长、血管生成和转移, 增加Panc-1的细胞凋亡率[6]; 并显著延长裸鼠负瘤的生存期[7].
定位于7q22的TFPI-2基因, 其产物是广谱的丝氨酸蛋白酶抑制物, 在人类肝脏、肾脏、心脏、骨骼肌等正常组织中都有着高度表达[8], 主要以Mr 32 000的形式分布在ECM中. 体外能强烈抑制纤溶酶、胰蛋白酶、MMP-1和MMP-3在内的多种蛋白酶, 与只有胶原酶抑制作用的TIMP相比, TFPI-2的蛋白酶抑制谱更广, 抑制能力更强, 因而在维持ECM的结构完整, 抑制肿瘤细胞侵袭转移方面有着至关重要的作用. 然而, 一些肿瘤细胞常有TFPI-2基因缺失或染色体7q的改变[9], 不能合成足够的TFPI-2来保护ECM免遭破坏, 从而造成肿瘤细胞侵袭转移能力提高, 加速病情发展. 我们既往的实验结果亦证实在进展期胰腺癌中存在有TFPI-2的严重表达不足[10]. Shinode et al[11]报道TFPI-2可作为血管平滑肌细胞增生的刺激因子在心肌粥样变中发挥重要作用. 而在本实验中, 在给予胰腺癌细胞充分的空间和营养时, TFPI-2并没有对胰腺癌细胞生长启促进或抑制作用, 考虑TFPI-2的丝裂原作用可能与细胞类型有关; 也提示我们TFPI-2不是通过抑制肿瘤细胞生长来抑制肿瘤的浸润和转移. 根据肿瘤细胞对细胞外基质的侵袭破坏过程而设计的Boyden小室是良好的体外浸润模型, 将肿瘤细胞置于上室, 下室中加入趋化因子, 在上室和下室之间分别以matrigel和PVPF膜代替基质及基底膜, 模拟肿瘤细胞降解局部细胞外基质、穿过基底膜的浸润过程[12]. 我们利用成功转染的Panc-1-TFPI-2细胞进行人胰腺癌细胞体外浸润能力的测定, 发现TFPI-2蛋白的表达可以显著抑制其体外浸润能力, 与国外研究人员针对其他肿瘤细胞所做的研究结果相一致[4,13-14]. 但与Neaud et al[3]结果相迥异: 他们发现成肌纤维细胞(myofibroblast)分泌的TFPI-2可加强肝细胞生长因子(hepatocyte growth factor, HGF)(亦由成肌纤维细胞合成)诱导的肝癌细胞侵袭, 并且TFPI-2 cDNA转染的HCC也可以发生自发侵袭现象, 从而提出TFPI-2可能是通过与TF/ FⅦ复合物结合来诱导HCC侵袭转移的, 这一点与TFPI-1(即我们通常所指的TFPI)促进膀胱癌细胞浸润转移作用相类似(膀胱癌细胞自身也表达TF/ FⅦ复合物)[15]. 进一步的裸小鼠种植成瘤能力实验证实TFPI-2是通过维持ECM的完整性来抑制胰腺癌细胞的浸润的. 在实验组中, 肿瘤细胞与周边肌层分界清晰, 而不似对照组和控制组; 虽在3 wk时, 3组均并未发现远处转移, 考虑与接种时间过短有关. 然而, 如何解释实验组中肿瘤的实体标本小于后两组呢?我们推测: 在肿瘤的生长过程中, 存在着无血管期和有血管期两个阶段.在无血管期时, 肿瘤处于增生和凋亡的平衡状态, 直径不超过1-2 mm; 在血管期, 肿瘤通过自分泌或旁分泌途径产生血管内皮生长因子(VEGF)、成纤维细胞生长因子(bFGF)血小板衍生生长因子(PDGF)等促血管生长因子促进肿瘤微血管内皮细胞增生和迁移, 尤其是VEGF, 是血管内皮细胞特有的有丝分裂原[16]. 因此, 在实验组中, 胰腺癌细胞并不象后2组那样, 可以从宿主中获得充分的营养而避免凋亡发生.
胰腺癌高表达组织因子(tissue factor, TF), 并与胰腺癌的分化程度和预后呈强线性负相关, 已作为胰腺癌预后的一重要参考因素[17]. TF可以通过多种重组细胞骨架[18]; 通过上调肿瘤细胞u-PAR表达[19]; 通过调节肿瘤细胞的血管生成-抗血管生成平衡等途径来增强胰腺癌的侵袭转移能力[20]. 虽然TFPI-2对TF/FVII复合物抑制作用较弱, 但其可通过维持ECM完整性来免受肿瘤细胞入侵, 其中势必与TF/FVII复合物发生错综复杂的联系, 进一步的研究, 对于在TFPI-2、TF/FVII复合物和肿瘤转移之间构成一个网络, 更好地阐述肿瘤肿瘤的浸润转移发生机制, 为今后基因治疗奠定理论和实验基础, 实属必要.
编辑: N/A
| 1. | Hofmann UB, Eggert AA, Blass K, Bröcker EB, Becker JC. Expression of matrix metalloproteinases in the microenvironment of spontaneous and experimental melanoma metastases reflects the requirements for tumor formation. Cancer Res. 2003;63:8221-8225. [PubMed] |
| 2. | Rao CN, Reddy P, Reeder DJ, Liu Y, Stack SM, Kisiel W, Woodley DT. Prokaryotic expression, purification, and reconstitution of biological activities (Antiprotease, antitumor, and heparin-binding) for tissue factor pathway inhibitor-2. Biochem Biophys Res Commun. 2000;276:1286-1294. [PubMed] [DOI] |
| 3. | Neaud V, Hisaka T, Monvoisin A, Bedin C, Balabaud C, Foster DC, Desmoulière A, Kisiel W, Rosenbaum J. Paradoxical pro-invasive effect of the serine proteinase inhibitor tissue factor pathway inhibitor-2 on human hepatocellular carcinoma cells. J Biol Chem. 2000;275:35565-35569. [PubMed] [DOI] |
| 4. | Jin M, Udagawa K, Miyagi E, Nakazawa T, Hirahara F, Yasumitsu H, Miyazaki K, Nagashima Y, Aoki I, Miyagi Y. Expression of serine proteinase inhibitor PP5/TFPI-2/MSPI decreases the invasive potential of human choriocarcinoma cells in vitro and in vivo. Gynecol Oncol. 2001;83:325-333. [PubMed] [DOI] |
| 5. | Matsuyama Y, Takao S, Aikou T. Comparison of matrix metalloproteinase expression between primary tumors with or without liver metastasis in pancreatic and colorectal carcinomas. J Surg Oncol. 2002;80:105-110. [PubMed] [DOI] |
| 6. | Bloomston M, Shafii A, Zervos EE, Rosemurgy AS. TIMP-1 overexpression in pancreatic cancer attenuates tumor growth, decreases implantation and metastasis, and inhibits angiogenesis. J Surg Res. 2002;102:39-44. [PubMed] [DOI] |
| 7. | Rigg AS, Lemoine NR. Adenoviral delivery of TIMP1 or TIMP2 can modify the invasive behavior of pancreatic cancer and can have a significant antitumor effect in vivo. Cancer Gene Ther. 2001;8:869-878. [PubMed] [DOI] |
| 8. | Miyagi Y, Koshikawa N, Yasumitsu H, Miyagi E, Hirahara F, Aoki I, Misugi K, Umeda M, Miyazaki K. cDNA cloning and mRNA expression of a serine proteinase inhibitor secreted by cancer cells: identification as placental protein 5 and tissue factor pathway inhibitor-2. J Biochem. 1994;116:939-942. [PubMed] [DOI] |
| 9. | Stumpf E, Aalto Y, Höög A, Kjellman M, Otonkoski T, Knuutila S, Andersson LC. Chromosomal alterations in human pancreatic endocrine tumors. Genes Chromosomes Cancer. 2000;29:83-87. [PubMed] [DOI] |
| 11. | Shinoda E, Yui Y, Hattori R, Tanaka M, Inoue R, Aoyama T, Takimoto Y, Mitsui Y, Miyahara K, Shizuta Y. Tissue factor pathway inhibitor-2 is a novel mitogen for vascular smooth muscle cells. J Biol Chem. 1999;274:5379-5384. [PubMed] [DOI] |
| 12. | Tullberg K, Haidvogl H, Obrist R, Burger MM, Obrecht JP. Selection of highly malignant tumour cells using reconstituted basement membrane matrix. Invasion Metastasis. 1989;9:15-26. [PubMed] |
| 13. | Konduri SD, Tasiou A, Chandrasekar N, Nicolson GL, Rao JS. Role of tissue factor pathway inhibitor-2 (TFPI-2) in amelanotic melanoma (C-32) invasion. Clin Exp Metastasis. 2000;18:303-308. [PubMed] [DOI] |
| 14. | Konduri SD, Tasiou A, Chandrasekar N, Rao JS. Overexpression of tissue factor pathway inhibitor-2 (TFPI-2), decreases the invasiveness of prostate cancer cells in vitro. Int J Oncol. 2001;18:127-131. [PubMed] [DOI] |
| 15. | Fischer EG, Riewald M, Huang HY, Miyagi Y, Kubota Y, Mueller BM, Ruf W. Tumor cell adhesion and migration supported by interaction of a receptor-protease complex with its inhibitor. J Clin Invest. 1999;104:1213-1221. [PubMed] [DOI] |
| 16. | Price DJ, Miralem T, Jiang S, Steinberg R, Avraham H. Role of vascular endothelial growth factor in the stimulation of cellular invasion and signaling of breast cancer cells. Cell Growth Differ. 2001;12:129-135. [PubMed] |
| 17. | Kakkar AK, Lemoine NR, Scully MF, Tebbutt S, Williamson RC. Tissue factor expression correlates with histological grade in human pancreatic cancer. Br J Surg. 1995;82:1101-1104. [PubMed] [DOI] |
| 18. | Ruf W, Fischer EG, Huang HY, Miyagi Y, Ott I, Riewald M, Mueller BM. Diverse functions of protease receptor tissue factor in inflammation and metastasis. Immunol Res. 2000;21:289-292. [PubMed] [DOI] |
| 19. | Taniguchi T, Kakkar AK, Tuddenham EG, Williamson RC, Lemoine NR. Enhanced expression of urokinase receptor induced through the tissue factor-factor VIIa pathway in human pancreatic cancer. Cancer Res. 1998;58:4461-4467. [PubMed] |
| 20. | Poon RT, Lau CP, Ho JW, Yu WC, Fan ST, Wong J. Tissue factor expression correlates with tumor angiogenesis and invasiveness in human hepatocellular carcinoma. Clin Cancer Res. 2003;9:5339-5345. [PubMed] |