修回日期: 2004-01-01
接受日期: 2004-02-26
在线出版日期: 2004-08-15
目的: 比较四氯化碳和猪血清染毒诱导的大鼠肝纤维化模型肝组织病理表现的异同.
方法: 四氯化碳组、猪血清组大鼠分别于每周一、四腹腔注射400 mL/L CCl4(2 mL/kg)、猪血清0.5 mL/鼠, 连续7 wk. 实验末取肝组织, 常规切片, HE染色后光镜下观察肝组织病理改变; Masson三重染色、James染色后光镜下分别观察胶原纤维、网状纤维的增生情况, 并采用病理图像系统进行半定量分析; 另取部分肝组织, 常规处理后电镜下观察超微结构变化.
结果: 猪血清组肝组织纤维间隔纤细, 包含明显的胶原沉积, 间质细胞成分多, 胶原沉积并不弥散, 仅限于纤维间隔, 偶见细胞损伤. 四氯化碳组纤维间隔粗大, 弥散分布, 纤维间隔内细胞成分多; 肝细胞损伤严重且广泛, 脂肪变性明显. 病理图像分析系统半定量分析显示四氯化碳组胶原纤维和网状纤维面密度、数密度、周密度均显著高于猪血清组(P<0.05或P<0.001).
结论: 四氯化碳诱导的肝纤维化程度较猪血清严重.
引文著录: 刘秀英, 胡怡秀, 胡余明, 丘丰, 周月婵, 臧雪冰, 聂焱. 四氯化碳和猪血清肝纤维化模型组织病理比较. 世界华人消化杂志 2004; 12(8): 1875-1879
Revised: January 1, 2004
Accepted: February 26, 2004
Published online: August 15, 2004
AIM: To compare liver pathological changes between two different hepatic-fibrosis models induced by porcine serum and carbon tetrachloride in rats.
METHODS: Hepatic fibrosis was induced in rats by biweekly intraperitoneal injection of porcine serum (0.5 mL) or 400 mL/L carbon tetrachloride (2 mL/kg) for 7 weeks. Five rats were randomly selected from the survivals in each group. Liver tissue was removed, fixed, sliced and stained with hematoxylin and esosin for routine light-microscopy, Masson trichrome for collagen, Jame's double ammoniated siver solution for reticulin, and then subjected to semiquantitative evaluation by pathological image analyzer. Another portion of liver tissue was prepared for electron microscopy.
RESULTS: Liver tissue in rats receiving pig serum displayed narrow fibrotic sepatae including obvious collagen deposition and more mesenchymal constituents, and collagen was confined to the septae. Hepatocellular injury is rare. In contrast, in the livers from rats treated with CCl4, the fibrotic septae were coarse, more cellular and diffuse. The parenchymal damage was more severe and extensive. The fatty metamorphosis of hepatocytes was evident. Semiquantitative analyses suggested that quantity of collagenic fibers and reticular fibers in CCl4 group were significantly higher than those in porcine serum group.
CONCLUSION: Hepatic fibrosis in rats induced by CCl4 is more severe than that induced by porcine serum.
- Citation: Liu XY, Hu YX, Hu YM, Qiu F, Zhou YC, Zang XB, Nie Y. Pathological comparison of hepatic-fibrosis models induced by porcine serum and carbon tetrachloride in rats. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1875-1879
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1875.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1875
建立合适的动物模型对研究肝纤维化至关重要, 人们对纤维化形成病理机制的了解很大程度上取决于可靠的、可重复的动物模型、各种模型之间的共同点, 及人类纤维化的发生过程. 一般来说, 肝纤维化的动物模型按病因可分为8类: 中毒性, 营养性, 免疫性, 胆汁淤积性, 酒精性, 遗传性, 代谢性和转基因动物模型[1]. 尽管胶原沉积增加是各种类型肝纤维化的最终共同途径, 但不同类型的肝纤维化模型细胞外基质的形态存在差别. 四氯化碳是经典的中毒性肝纤维化诱导物, 猪血清则是免疫性肝纤维化的常用异种抗原, 我们从病理形态的角度比较了两种模型的异同, 以期为肝纤维化不同机制研究、临床护肝药物筛选时动物模型的选择提供依据.
Wistar大鼠20只, 体质量150-190 g, 雌雄各半, 由中南大学湘雅医学院实验动物学部提供, 于温度23-25 ℃、湿度55%-65%环境中饲养, 自由摄食、饮水. 猪血清: 从屠宰场取回猪血, 静置数小时后8 000 r/min离心10 min, 回收上清于4 ℃冰箱过夜, 再以8 000 r/min离心10 min, 回收上清, 用0.45 μm滤膜过滤除菌, 分装后于-20 ℃保存备用; CCl4: 化学纯, 湖南省南县八一化工厂生产, 批号860403, 含量>99%, 1 600 g/L. Olympus显微镜, 日立H-600型透射电镜, CMM-3真彩色病理图像分析系统(北航).
随机将20只大鼠均分为2组: 四氯化碳组、猪血清组, 分别于每周一、四腹腔注射400 mL/L CCl4(植物油配制, 2 mL/kg)、猪血清(0.5 mL/鼠), 连续7 wk, 7 wk末处死, 每组中随机抽取5只大鼠, 肝脏同一部位取2-3 mm厚的肝组织块, 用pH7.2磷酸缓冲液配置的40 g/L甲醛固定, 常规石蜡包埋后切片(3-4 um), HE染色, 光镜下观察组织改变. 胶原纤维采用Masson三重染色, 网状纤维采用James(双氨银)染色. 光镜下观察胶原纤维和网状纤维的增生情况, 并用病理图像系统进行定量分析. 另取1 mm3大小的组织块, 置预冷的25 g/L戊二醛固定液中固定, 磷酸缓冲液漂洗, 梯度丙酮脱水, Epon-812环氧树脂包埋, 作超薄切片, 醋酸铀和柠檬酸铅双重染色, 电镜下观察超微结构变化. 肝纤维化分级与计分[2]: 0分: 无纤维化, 1分: 轻度微纤维化, 门脉区扩大, 有纤维增生; 2分: 中度纤维化, 门脉周或门脉-门脉间纤维间隔形成, 但肝小叶结构未受损; 3分: 严重纤维化, 纤维形成, 肝小叶结构破坏, 但无明显肝硬化; 4分: 肝硬化: 出现由纤维间隔包绕的肝细胞结节, 正常肝小叶结构消失. 晚期出现肝细胞再生结节.
统计学处理 数据使用Instat软件进行统计处理.
大鼠解剖后肉眼大体观察, 可见四氯化碳组大鼠肝脏表面呈花斑状, 结节明显可见, 质地坚硬, 有的肝脏表面有白色不透明的薄膜包裹. 猪血清组大鼠肝脏大小正常或稍增大, 肝脏表面欠光滑, 颜色较苍白, 韧性增加.
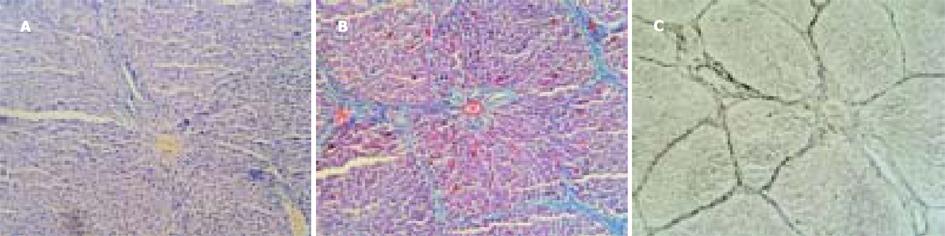
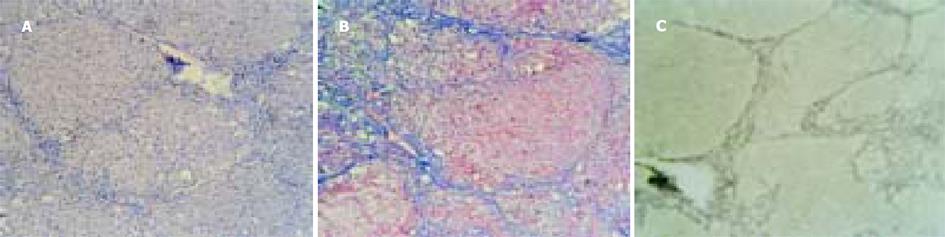
猪血清组大鼠肝组织汇管区增宽, 纤维组织明显增生, 有轻度的单核、淋巴等炎性细胞浸润及胆小管增生. 纤维条索由汇管区呈放射状发出, 包绕肝细胞团形成大小不等的假小叶(图1A), 有大方形、小方形、圆形和不规则形. 炎性渗出物深入纤维间隔的根部, 在某些区域, 深入到周围的小叶周肝细胞, 使此处的肝细胞界板看起来象被部分破坏一样. 肝细胞索排列整齐, 绝大多数肝细胞正常, 偶见肝细胞出现灶性空泡变性或肝小叶周边的界板肝细胞出现碎屑状坏死. 四氯化碳组大鼠肝脏肝小叶结构完全破坏, 纤维增生弥散, 遍布整个小叶. 纤维间隔粗大, 炎性细胞成分多, 纤维间隔连接中央静脉-门脉多见, 假小叶形成完全, 以圆形为主.可见弥漫性肝细胞水样变性(从轻度水肿到胞质疏松化乃至空泡变性程度不等)和脂肪变性, 假小叶内出现灶性、片状肝细胞凝固性坏死或溶解性坏死, 坏死区纤维组织增生, 炎性细胞聚集.肝细胞索排列紊乱, 肝小叶结构完全丧失(图2A). 可见灶性肝细胞再生.
猪血清组大鼠肝脏可见汇管区胶原纤维明显增生, 多数纤维间隔从门脉区放射, 终止于肝实质细胞或邻近的汇管区, 其间可有纤维间隔分支向中央静脉伸展, 形成门脉-门脉、门脉-中央静脉桥接纤维, 导致大小不等的肝细胞结节.多数纤维间隔纤细, 完全包裹肝细胞团形成完整的假小叶.以方形假小叶为主(图1B). 纤维间隔在汇管区汇集, 呈灶性增厚.可见明显的胆小管增生. 中央静脉周围有轻度的胶原纤维增生. 大部分肝细胞索、肝细胞正常, 个别肝细胞出现胞质疏松化. 四氯化碳组大鼠肝脏组织可见粗大的纤维间隔弥散, 包绕肝细胞团形成圆形、类圆形假小叶, 纤维条索内含有多量变性、坏死的肝细胞和淋巴、单核等炎性细胞(图2B), 中央静脉周、门脉区纤维组织增生明显, 门脉-中央静脉之间的纤维桥多见.肝细胞弥漫性变性、坏死. 正常肝小叶结构完全破坏. 按Scheuer PJ的纤维化程度评分[2], 猪血清组5只大鼠纤维化程度共计9分, 而四氯化碳组共计14分. 病理图像分析系统半定量分析显示四氯化碳组胶原纤维阳性目标个数、面密度、数密度、周密度均显著高于猪血清组(P<0.05或P<0.01, 表1).
| 纤维 | 分组 | 阳性目标(个/视野) | 面密度(μm2/μm2) | 数密度(个/μm2) | 周密度(μm/μm2) | ||||
| n | mean±SD | n | mean±SD | n | mean±SD | n | mean±SD | ||
| 胶原 | 猪血清组 | 5 | 110.8±43.8 | 554 | 0.037±0.032 | 554 | 0.0 006±0.0 005 | 554 | 0.015±0.036 |
| 四氯化碳组 | 5 | 254.2±134.6a | 1 271 | 0.095±0.041b | 1 271 | 0.0 013±0.0 013b | 1 271 | 0.039±0.087b | |
| 网状 | 猪血清组 | 5 | 122.6±49.6 | 613 | 0.037±0.020 | 613 | 0.0 007±0.0 005 | 613 | 0.017±0.041 |
| 四氯化碳组 | 5 | 142.2±31.0 | 711 | 0.065±0.011b | 711 | 0.0 007±0.0 003b | 711 | 0.027±0.040b | |
猪血清组可见纤细的网状纤维间隔由门脉区呈星芒状放射, 终止于主质细胞或邻近的汇管区, 其间有纤维间隔伸向中央静脉, 将肝小叶分割成大小不等的肝细胞结节(图1C). 假小叶以多边形为主. 四氯化碳组网状纤维间隔粗、弥散、不规则(图2C), 包绕肝细胞形成圆形、类圆形假小叶. 病理图像分析系统半定量分析显示四氯化碳组网状纤维面密度、数密度、周密度均显著高于猪血清组(P<0.001), 而两组间阳性目标个数无显著差异(表1).
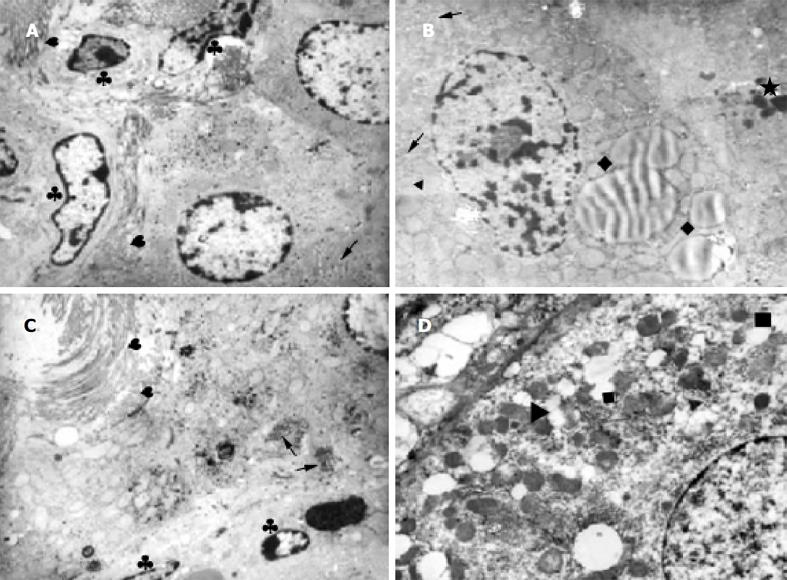
猪血清组(图3A)可见线粒体嵴模糊, 部分内质网扩张, 糖元、脂滴丰富, 纤维细胞增生, 纤维化明显, 胶原纤维沿肝细胞的肝窦侧沉积, 可见Disse腔堵塞. 四氯化碳组可见明显纤维化, 肝细胞肿胀, 肝细胞有多量脂滴, 线粒体空泡变, 肝细胞核固缩. 浆细胞和中性粒细胞浸润, 证实了光镜下所见(图3B-D).
肝硬化是多种慢性肝病的主要并发症, 由细胞外基质的过量产生和降解减少形成[3]. 纤维化是慢性肝炎进展为肝硬化的主要病理机制[4], 是一可逆[5-7]的动态过程[8]. 有多种方法建立肝纤维化动物模型, 不同物质诱导肝纤维化产生的机制不同, 并产生不同的病理和生化改变[1]. 我们发现: (1)四氯化碳诱导的肝纤维化程度较猪血清严重.表现为纤维间隔粗大, 弥散分布, 纤维化遍布整个小叶.而在猪血清模型, 胶原沉积并不弥散, 仅限于纤维间隔. 纤维带纤细, 仅在汇管区周围区域, 薄的胶原纤维带融合形成厚的纤维束; (2)纤维间隔内成分不同.四氯化碳组纤维间隔内细胞成分(坏死、变性的肝细胞和炎性细胞)多, 而猪血清组纤维带包含明显的胶原沉积, 几乎没有炎症反应而间质细胞明显增加; (3)四氯化碳组大鼠肝细胞损伤严重且广泛, 细胞水样变性、脂肪变性广泛分布, 凝固性坏死和溶解性坏死常见, 炎性细胞浸润明显, 肝细胞索排列紊乱, 不同区域之间差异很小. 而猪血清组, 一般在纤维间隔或门脉附近的界板肝细胞, 可见细胞变性, 偶见点状肝细胞坏死, 绝大多数肝细胞正常. 肝细胞索排列整齐, 象征坏死的嗜酸性小体和嗜酸性肝细胞及围绕细胞坏死碎片的炎症细胞聚集很少看到; (4)多量纤维沉积的部位不同.四氯化碳组小叶中央纤维沉积突出, 中央-门脉间纤维带常见. 而猪血清组门脉区纤维沉积显著, 连接汇管区、汇管区和中央静脉的桥接纤维明显可见; (5)主导的假小叶形状不同. 四氯化碳组假小叶以圆形、类圆形为主, 而猪血清组以方形、多边形为主; (6)四氯化碳对肝脏的破坏严重, 光镜下肝小叶的正常结构完全丧失, 假小叶内几乎看不到中央静脉. 而猪血清组虽也有纤维间隔包绕肝细胞团, 但部分肝细胞团中央可见中央静脉, 貌似正常的肝小叶结构. 总之, 猪血清诱导的免疫性肝纤维化的特征为: 胶原纤维间隔纤细, 缺乏明显的炎症反应和显著的肝细胞损伤. 四氯化碳诱导的中毒性肝纤维化特征为: 肝细胞坏死和炎性浸润严重, 全小叶性纤维化, 纤维间隔厚.
四氯化碳和猪血清诱导的肝纤维化模型肝脏病理组织改变不同与其致纤维化机制有关. CCl4通过细胞色素氧化酶代谢为三氯甲基自由基 (CCl3·)而引发一系列的脂质过氧化反应[9]由此导致肝细胞损伤, 通过炎症细胞集聚、释放细胞因子触发间质组织的过量产生. 因此, 四氯化碳所致大鼠肝纤维化中, 炎症和坏死常先于纤维化[10]. 因中央静脉区周围相对小叶周边区肝细胞缺氧, 更易遭受脂质过氧化的袭击, 所以此区纤维沉积显著. 四氯化碳诱导的大鼠肝纤维化形成过程中, 小叶中央区先出现间质组织, 而后门脉管道受累[11]猪血清作为一种异种血清, 其中的白蛋白对大鼠作为异种抗原, 诱导机体产生相应的抗体, 形成抗原-抗体复合物, 沉积于门脉区肝血管和间质组织, 通过免疫复合物介导的细胞毒性反应活化枯否氏细胞而导致肝血管和间质组织结构的改变, 最终引发肝纤维化[12]. 形态学和免疫组化显示免疫复合物在血管和间质组织沉积先于肝纤维化的发生, 而肝细胞无坏死和炎症等显著改变[13]提示间质组织病变是原发损伤[12]. 其病理特征是[14]: 门脉区先出现单核细胞浸润及纤维化反应, 而后出现连接汇管区和中央静脉的纤维间隔形成. 汇管区纤维组织粗大支持这一论点. 纤维间隔或门脉区附近肝细胞损伤是纤维包绕肝细胞的结果.
由于四氯化碳致肝纤维化动物模型造模途径多样、简便、费用低廉、病理特征稳定可靠[15]、复制时间短, 广泛应用于体内研究肝纤维化发生细胞、分子机制[16-17]、血清学标志物与组织病理的相关性及抗纤维化物质的药效评价[18-20]. 猪血清诱导的免疫性肝纤维化与人类肝纤维化的形成原因[21]有一定相似之处, 纤维化较四氯化碳所致肝纤维化持久[22], 而且致纤维化的过程中对肝细胞无损伤[13], 因此在研究肝硬化的产生机制、早期诊断及评价药物疗效、筛选通过免疫机制而抗肝损伤药物方面, 较化学中毒性肝纤维化模型有其不同的特点与优点, 此模型一直用于研究吞噬细胞[23-24]、Ito细胞[25]及肌纤维变性细胞在肝纤维化中的作用及肝纤维化过程中肝内微循环的改变[26].
编辑: N/A
| 1. | Wu J, Norton PA. Animal models of liver fibrosis. Scand J Gastroenterol. 1996;31:1137-1143. [PubMed] [DOI] |
| 2. | Desmet VJ, Gerber M, Hoofnagle JH, Manns M, Scheuer PJ. Classification of chronic hepatitis: diagnosis, grading and staging. Hepatology. 1994;19:1513-1520. [PubMed] [DOI] |
| 3. | Stickel F, Brinkhaus B, Krähmer N, Seitz HK, Hahn EG, Schuppan D. Antifibrotic properties of botanicals in chronic liver disease. Hepatogastroenterology. 2002;49:1102-1108. [PubMed] |
| 4. | Valkova M. Hepatic fibrogenesis. Bratisl Lek Listy. 2002;103:76-85. [PubMed] |
| 5. | Fallowfield JA, Iredale JP. Reversal of liver fibrosis and cirrhosis--an emerging reality. Scott Med J. 2004;49:3-6. [PubMed] [DOI] |
| 6. | Okazaki I, Watanabe T, Hozawa S, Arai M, Maruyama K. Molecular mechanism of the reversibility of hepatic fibrosis: with special reference to the role of matrix metalloproteinases. J Gastroenterol Hepatol. 2000;15 Suppl:D26-D32. [PubMed] [DOI] |
| 7. | Okazaki I, Watanabe T, Hozawa S, Niioka M, Arai M, Maruyama K. Reversibility of hepatic fibrosis: from the first report of collagenase in the liver to the possibility of gene therapy for recovery. Keio J Med. 2001;50:58-65. [PubMed] [DOI] |
| 8. | McCrudden R, Iredale JP. Liver fibrosis, the hepatic stellate cell and tissue inhibitors of metalloproteinases. Histol Histopathol. 2000;15:1159-1168. [PubMed] |
| 9. | Lee TY, Wang GJ, Chiu JH, Lin HC. Long-term administration of Salvia miltiorrhiza ameliorates carbon tetrachloride-induced hepatic fibrosis in rats. J Pharm Pharmacol. 2003;55:1561-1568. [PubMed] [DOI] |
| 10. | Muriel P, Fernández-Martínez E, Pérez-Alvarez V, Lara-Ochoa F, Ponce S, García J, Shibayama M, Tsutsumi V. Thalidomide ameliorates carbon tetrachloride induced cirrhosis in the rat. Eur J Gastroenterol Hepatol. 2003;15:951-957. [PubMed] [DOI] |
| 11. | Wasser S, Lim GY, Ong CN, Tan CE. Anti-oxidant ebselen causes the resolution of experimentally induced hepatic fibrosis in rats. J Gastroenterol Hepatol. 2001;16:1244-1253. [PubMed] [DOI] |
| 12. | Paronetto F, Popper H. Chronic liver injury induced by immunologic reactions: cirrhosis following immunization with heterologous sera. Am J Pathology. 1996;49:1087-1101. |
| 13. | Matsumura Y, Sakaida I, Uchida K, Kimura T, Ishihara T, Okita K. Prolyl 4-hydroxylase inhibitor (HOE 077) inhibits pig serum-induced rat liver fibrosis by preventing stellate cell activation. J Hepatol. 1997;27:185-192. [PubMed] [DOI] |
| 14. | Bhunchet E, Eishi Y, Wake K. Contribution of immune response to the hepatic fibrosis induced by porcine serum. Hepatology. 1996;23:811-817. [DOI] |
| 15. | Fischer-Nielsen A, Poulsen HE, Hansen BA, Hage E, Keiding S. CCl4 cirrhosis in rats: irreversible histological changes and differentiated functional impairment. J Hepatol. 1991;12:110-117. [PubMed] [DOI] |
| 16. | Leclercq IA, Farrell GC, Schriemer R, Robertson GR. Leptin is essential for the hepatic fibrogenic response to chronic liver injury. J Hepatol. 2002;37:206-213. [PubMed] [DOI] |
| 17. | Anselmi K, Subbotin VM, Nemoto E, Gandhi CR. Accelerated reversal of carbon tetrachloride-induced cirrhosis in rats by the endothelin receptor antagonist TAK-044. J Gastroenterol Hepatol. 2002;17:589-597. [PubMed] [DOI] |
| 18. | García L, Hernández I, Sandoval A, Salazar A, Garcia J, Vera J, Grijalva G, Muriel P, Margolin S, Armendariz-Borunda J. Pirfenidone effectively reverses experimental liver fibrosis. J Hepatol. 2002;37:797-805. [PubMed] [DOI] |
| 19. | Zhan Y, Li D, Wei H, Wang Z, Huang X, Xu Q, Lu H. Emodin on hepatic fibrosis in rats. Chin Med J (Engl). 2000;113:599-601. [PubMed] |
| 20. | Chen JC, Tsai CC, Chen LD, Chen HH, Wang WC. Therapeutic effect of gypenoside on chronic liver injury and fibrosis induced by CCl4 in rats. Am J Chin Med. 2000;28:175-185. [PubMed] [DOI] |
| 21. | Koziel MJ. The immunopathogenesis of HBV infection. Antivir Ther. 1998;3:13-24. [PubMed] |
| 23. | Sakaida I, Jinhua S, Uchida K, Terai S, Okita K. Leptin receptor-deficient Zucker (fa/fa) rat retards the development of pig serum-induced liver fibrosis with Kupffer cell dysfunction. Life Sci. 2003;73:2491-2501. [PubMed] [DOI] |
| 24. | Hironaka K, Sakaida I, Matsumura Y, Kaino S, Miyamoto K, Okita K. Enhanced interstitial collagenase (matrix metalloproteinase-13) production of Kupffer cell by gadolinium chloride prevents pig serum-induced rat liver fibrosis. Biochem Biophys Res Commun. 2000;267:290-295. [PubMed] [DOI] |
| 25. | Okuno M, Akita K, Moriwaki H, Kawada N, Ikeda K, Kaneda K, Suzuki Y, Kojima S. Prevention of rat hepatic fibrosis by the protease inhibitor, camostat mesilate, via reduced generation of active TGF-beta. Gastroenterology. 2001;120:1784-1800. [PubMed] [DOI] |
| 26. | Bhunchet E, Fujieda K. Capillarization and venularization of hepatic sinusoids in porcine serum-induced rat liver fibrosis: a mechanism to maintain liver blood flow. Hepatology. 1993;18:1450-1458. [PubMed] [DOI] |