修回日期: 2004-04-01
接受日期: 2004-04-20
在线出版日期: 2004-08-15
目的: 用反义寡核苷酸(ASODN)封闭胰腺癌细胞中Survivin基因的表达, 研究其诱导细胞凋亡的作用及其机制.
方法: 用脂质体介导SurvivinASODN转染人胰腺癌细胞株SW1990细胞, 用AnnexinⅤ-FITC/PI复染、流式细胞术检测及电镜术观察凋亡, 激酶活性检测法测定细胞内caspase-3活性变化, 免疫沉淀法测定细胞内丝裂原活化蛋白激酶p38 (p38MAPK)活性的变化早期细胞变化情况.
结果: 脂质体介导SurvivinASODN转染胰腺癌细胞后细胞内p38MAPK及caspase-3活性较对照组明显升高(55.3% vs 2.9%, 3.2%, 4.5%, 4.8% respectively, P<0.05). 细胞出现典型的凋亡形态学特征, 细胞凋亡率较对照组明显增加(8.81±1.33 vs 47.87±2.91, and 14.73±1.36 vs 23.47±3.61, P<0.05).
结论: 脂质体介导转染Survivin ASODN可以诱导细胞激活, 诱导活化进而诱导细胞发生凋亡.
引文著录: 王亚利, 宋天保, 王西京, 王中卫, 宋潍, 郝小静. Survivin mRNA反义寡核苷酸诱导胰腺癌细胞凋亡. 世界华人消化杂志 2004; 12(8): 1872-1874
Revised: April 1, 2004
Accepted: April 20, 2004
Published online: August 15, 2004
AIM: To investigate and explore the mechanism of apoptosis induced by Survivin antisense oligodeoxynucleotides (ASODN) that blocked out the expression of Survivin in pancreatic carcinoma cell line SW1990.
METHODS: Survivin mRNA ASODN were designed and transfected into SW1990 cells by Lipofectimine. Apoptosis were measured using electron microscope (ECM) for morphology and flow cytometry (FCM) analysis with Annexin-Ⅴ/PI dual staining for apoptotic cell ratio. caspase-3 and p38MAPK activity were measured using colorimetric assay and immuno-precipitation respectively.
RESULTS: The predominant death model of SW1990 cells transfered Survivin mRNA ASODN was apoptosis. The apoptotic ratio in this group was increased significantly than that of control, SODN control and MMODN control groups after survivin ASODN transfection (55.3% vs 2.9%, 3.2%, 4.5%, and 4.8% respectively, P < 0.05). The activity of p38MAPK and caspase-3 were increased significantly after survivin ASODN transfection (8.81±1.33 vs 47.87±2.91, and 14.73±1.36 vs 23.47±3.61,P < 0.05).
CONCLUSION: Survivin plays an important role in apoptosis of pancreatic cancer. Survivin mRNA ASODN transfered with lipofectimine can effectively activate p38MAPK-caspase-3 signal pathway sequentially and induce SW1990 cell apoptosis
- Citation: Wang YL, Song TB, Wang XJ, Wang ZW, Song W, Hao XJ. Survivin mRNA ASODN inducing apoptosis in pancreas cancer cells. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1872-1874
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1872.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1872
Survivin是新近发现的一种抑制细胞凋亡蛋白(inhibitor of apoptosis proteins, IAP)家族成员, 仅特异性地表达于肿瘤组织, 在正常成人组织几乎不表达, 通过阻断细胞凋亡的发生过程, 在促进肿瘤的发生发展过程中发挥重要的作用[1]. 用针对survivin mRNA设计的反义寡核苷酸(antisense oligodeoxynucleotide, ASODN), 通过脂质体介导转染人胰腺癌细胞SW1990抑制其survivin的表达, 对其诱导胰腺癌细胞凋亡及其机制进行初步研究.
人胰腺癌细胞株SW1990细胞购自上海生物研究所细胞库. 完全培养液为RPMI1640+8 mL/L新生牛血清+抗生素. RPMI1640培养液及牛血清均购自Gibco公司脂质体(OligofectamineTM Reagent)购自Life Technologies 公司, Annexin Ⅴ-FITC及PI均购自Sigma 公司, CaspACETM Assay System Colorimetric, Trizol Reagent购自Promega. 公司, p38MAPK活性测定试剂盒购自美国Cell Singaling Technology公司.
脂质体介导寡核苷酸(oligonucleotide, ODN)转染各ODNs设计软件: Oligo 6.4, Omiga 2.0, Vector NTI 5.5, Blast 2.1.硫代磷酸型寡核苷酸由北京奥科生物工程公司合成, 其5'及3'末端硫代修饰(Phosph-orothioate oligodeoxynucleotide, PSODN). 序列如下: ASODN序列5'-GGG GCA CCC ATG CCG CCG CC-3'; 正义寡核苷酸(sense oligonucleotide, SODN)序列: 5'-GGC GGC GGC ATG CGT GCC CC-3'; 错配寡核苷酸(mismatch oligonucleotide, MMODN)序列: 5'-GCC GAC CGC ATG GGT GCG CC 3'. 按照OligofectamineTM Reagent脂质体转染试剂盒说明进行转染: (1)配制转染液(每孔量): A液为无血清培养液175 μL稀释10 μL 20 μmoL/L ODNs, B液为3 μL脂质体用无血清培养液稀释至15 μL; ODNs终浓度为200 nmoL/L; (2)将A液加入B液内, 轻轻混合, 室温静置15 min; (3)无血清培养液洗细胞1次; (4)每孔加入800 μL无血清培养液及200 μL转染液, 轻轻混合, 37 ℃, 5 mL/LCO2继续培养4 h; (5)每孔加入500 μL含45 mL/L血清的培养液, 继续培养24 h; (6)收获细胞, 备检.实验分为I组: 以无血清RPMl 1640培养液代替转染复合物作为空白对照组; Ⅱ组: SODN转染组; Ⅲ组: ASODN转染组; IV组: MMODN转染组. 细胞收获后用0.01 mol/L 4 ℃ PBS洗2次, Hepes缓冲液调整浓度为109/mL; 用100 μL结合有annexin V-Fitc / PI的荧光染色液重悬, 室温避光温育15 min; PBS洗1次; 细胞用400 μL Hepes缓冲液重悬, FCM检测早期凋亡细胞及坏死细胞, CellQuest 相关software 分析. 结果呈点状分布.
1.2.1 透射电镜观察: 弃旧培养液, 加入预冷的PBS, 消化离心, 弃上清夜; 沿管壁缓缓加入预冷的40 g/L戊二醛, 4 ℃固定30 min. 将细胞团块常规脱水、树脂浸透、包埋、修块、超薄切片, 柠檬酸铅和醋酸铀染色, 透射电镜观察照相.
1.2.2 丝裂原活化蛋白激酶p38活性的检测: 收集5×106个细胞, 裂解细胞提取蛋白, 按p38MAPK(mitogen-activated protein kinase p38)活性免疫沉淀法测定试剂盒说明进行检测.
1.2.3 caspase-3活性的测定: 收集2×106个细胞, 按caspase-3活性测定试剂盒(美国Clontech公司产品)说明提取蛋白, 比色法测定caspase-3活性, 以分光光度计在405 nm测定底物裂解产生的荧光强度.
统计学处理 结果以均数±标准差(mean±SD)表示, 采用SPSSl0.0软件进行方差分析, t检验.
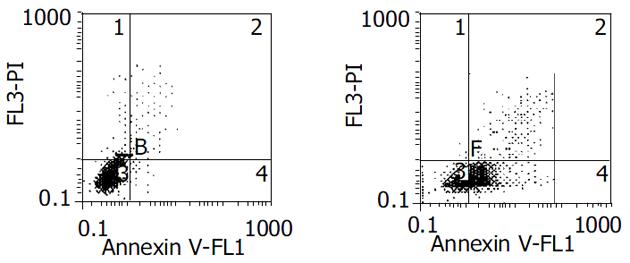
正常活细胞为AnnexinⅤ-/PI-(P3), 凋亡细胞为AnnexinⅤ+/PI-(P4), 继发性坏死为AnnexinⅤ+/PI+(P2), 机械性损伤为AnnexinⅤ-/PI+(P1). 结果可见, 转染SurvivinASODN后胰腺癌细胞凋亡率(55.3%)较转染前(2.9%)及空白对照组(3.2%)、SODN组(4.5%)、MMODN(4.8%)组均明显增加(P<0.05, 图1 A, B).
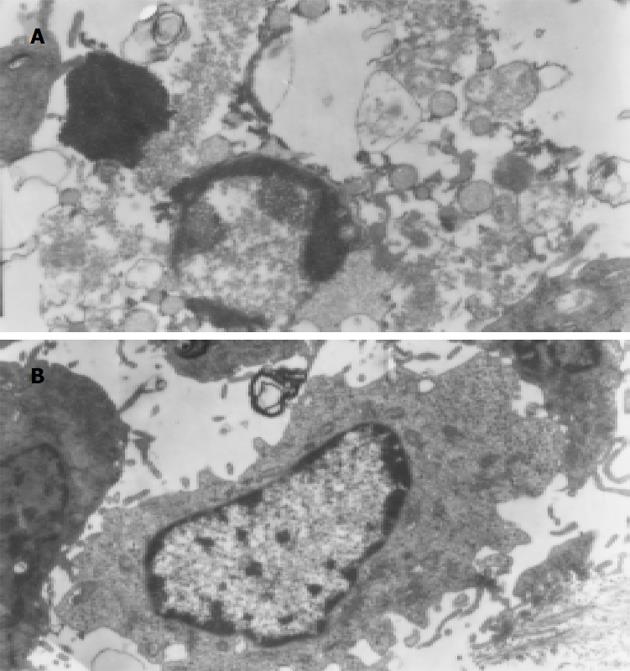
ASODN后出现细胞皱缩3, 核不规则, 核染色质固缩, 呈境界清楚的团块状边集在核膜下, 甚至细胞核碎裂、凋亡小体形成等典型凋亡特征(图2A). 而转染SODN及MMODN 后SW1990细胞膜完整, 体积稍缩小, 核染色质颗粒增粗、沿核膜不均匀边聚等凋亡早期改变(图2B).
空白对照组及正义对照组p38MAPK及 caspase-3基础活性较低, 两组之间差异无显著性; 转染后p38MAPK及caspase-3活性呈剂量依赖性升高, 各转染组较空白对照组及正义对照组均有明显升高(表1).
Survivin是IAP(凋亡抑制蛋白) 家族新成员, 是1997年耶鲁大学的Ambrosini et al[2] 研究组. 利用效应细胞蛋白酶受体-1(effector cell protease receptor-1, EPR-1)cDNA在人类基因组库中筛选出来的, 具有抑制凋亡和调节细胞分裂的双重功能. Survivin参与细胞的生长和分化, 其分布具有明显的组织差异性, 在胚胎发育过程中表达, 在正常分化成熟的组织中不表达, 但在肿瘤中又重新表达[3]. Survivin具有抑制凋亡和调节细胞分裂的双重功能, 他参与细胞增生、分裂、细胞周期及细胞凋亡的调控, 与肿瘤的发生密切相关[4]. caspase是细胞凋亡的核心机制, 级联式激活, 参与凋亡降解中重要底物的剪切. 直接作用于caspase, 主要抑制caspase-3和caspase-7的活性, 阻断细胞凋亡过程[5].caspase-3主要通过以下途径促进凋亡: 裂解DNA修复相关分子; 裂解凋亡抑制蛋白等; 裂解细胞外基质蛋白及骨架蛋白; 裂解其他相关分子[6]. Caspase-3对底物的切割不仅特异, 而且高效. 在凋亡发生的过程中, Caspase-3既可作为凋亡的启动者, 也可作为凋亡的效应物, 从而形成瀑布式连锁反应, 促使凋亡得以完成[7] 实验证明, 利用反义核酸技术干扰survivin的表达或抑制其功能的发挥可抑制有丝分裂并促进自发的细胞凋亡[8-9]. 我们发现, 胰腺癌细胞转染survivin ASODN后, 细胞凋亡率明显增加, 由转染前的3.2%增加至55.3%, 电镜下细胞出现典型的凋亡特征, 并可见凋亡小体的形成, 说明单独抑制胰腺癌细胞中survivin基因的表达即可诱导胰腺癌细胞凋亡, 这是其他抑制凋亡的基因所不具备的特点, 为胰腺癌survivin靶向基因治疗提供了理论依据.
p38MAPK是1993年发现的一类新的MAPK信号通路, p38MAPK的激活在细胞凋亡中具有重要作用. 阻断p38MAPK信号传导通路, 使癌细胞的侵袭和运动以及黏附作用减弱, 抑制肿瘤细胞的转移[10]. 我们发现, 转染survivin ASODN后p38MAPK活性显著性升高, 而正义对照组与空白对照组p38MAPK活性水平差异无显著性, 提示封闭survivin的表达能够诱导p38MAPK的活化. caspase-3在细胞内主要以无活性的酶原形式存在, 当细胞进入凋亡时才被激活. 在多种刺激诱导的凋亡中caspase-3降解凋亡底物的活性最强. 我们发现, 胰腺癌细胞转染survivin ASODN后, caspase-3活性水平显著升高, 提示在细胞中表达的低活性caspase-3可能是被survivin表达所抑制; ASODN封闭survivin基因表达后激活p38MAPK, 进一步再诱导caspase-3活化, 是其诱导胰腺癌细胞凋亡过程中的关键环节. 已有研究证实, survivin在多种肿瘤细胞株中均有表达, 在肺腺癌、鳞癌、胰腺、结肠、乳腺和前列腺癌及淋巴瘤中均检测到survivin的表达[11]. survivin与肿瘤细胞凋亡的丢失、肿瘤的发生有密切关系, 且survivin的表达参与肿瘤的恶性程度、预后不良成正比, 并有可能是与肿瘤细胞耐药的因素之一[12]. Survivin在胰腺癌靶向治疗的有很好的应用前景.
编辑: N/A
| 1. | Chiou SK, Jones MK, Tarnawski AS. Survivin - an anti-apoptosis protein: its biological roles and implications for cancer and beyond. Med Sci Monit. 2003;9:PI25-PI29. [PubMed] |
| 2. | Ambrosini G, Adida C, Altieri DC. A novel anti-apoptosis gene, survivin, expressed in cancer and lymphoma. Nat Med. 1997;3:917-921. [PubMed] [DOI] |
| 3. | Altieri DC. Survivin in apoptosis control and cell cycle regulation in cancer. Prog Cell Cycle Res. 2003;5:447-452. [PubMed] |
| 4. | Sarela AI, Verbeke CS, Ramsdale J, Davies CL, Markham AF, Guillou PJ. Expression of survivin, a novel inhibitor of apoptosis and cell cycle regulatory protein, in pancreatic adenocarcinoma. Br J Cancer. 2002;86:886-892. [PubMed] [DOI] |
| 5. | Johnson AL, Langer JS, Bridgham JT. Survivin as a cell cycle-related and antiapoptotic protein in granulosa cells. Endocrinology. 2002;143:3405-3413. [PubMed] [DOI] |
| 6. | Grütter MG. Caspases: key players in programmed cell death. Curr Opin Struct Biol. 2000;10:649-655. [PubMed] [DOI] |
| 7. | Budd RC. Activation-induced cell death. Curr Opin Immunol. 2001;13:356-362. [PubMed] [DOI] |
| 9. | Xia C, Xu Z, Yuan X, Uematsu K, You L, Li K, Li L, McCormick F, Jablons DM. Induction of apoptosis in mesothelioma cells by antisurvivin oligonucleotides. Mol Cancer Ther. 2002;1:687-694. [PubMed] |
| 10. | Elenitoba-Johnson KS, Jenson SD, Abbott RT, Palais RA, Bohling SD, Lin Z, Tripp S, Shami PJ, Wang LY, Coupland RW. Involvement of multiple signaling pathways in follicular lymphoma transformation: p38-mitogen-activated protein kinase as a target for therapy. Proc Natl Acad Sci U S A. 2003;100:7259-7264. [PubMed] [DOI] |
| 11. | Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene. 2003;22:8581-8589. [PubMed] [DOI] |
| 12. | Altieri DC. Validating survivin as a cancer therapeutic target. Nat Rev Cancer. 2003;3:46-54. [PubMed] [DOI] |