修回日期: 2004-03-12
接受日期: 2004-03-18
在线出版日期: 2004-08-15
目的: 构建表达幽门螺杆菌(H. pylori)融合蛋白HspA-UreB的重组表达质粒, 并研究其免疫学活性.
方法: 定向克隆方法将郑州分离Hp菌株MEL-HP27的hspA和ureB基因融合连接入原核表达载体pET30(a), 构建重组表达质粒pET-HU27. 该质粒转化大肠杆菌BL21后经IPTG诱导, SDS-PAGE分析融合蛋白HspA-UreB表达情况. Ni2+柱亲和层析纯化融合蛋白, 与小鼠免疫血清进行Western blot分析, 检测融合蛋白的免疫反应性.
结果: 特异PCR法与质粒酶切鉴定证实重组表达质粒pET-HU27构建成功. SDS-PAGE分析显示在82.1 KDa处出现特异蛋白带, 占菌体总蛋白的21%, 亲和层析法获得纯度为91%的纯化融合蛋白, 经免疫小鼠制备的血清可以识别该融合蛋白.
结论: 成功构建表达H. pylori HspA-UreB融合蛋白的重组表达质粒, 表达的融合蛋白具有良好的免疫反应性.
引文著录: 代丽萍, 段广才, 范清堂, 郗园林, 张荣光. 幽门螺杆菌融合蛋白HspA-UreB的表达和免疫学活性. 世界华人消化杂志 2004; 12(8): 1818-1822
Revised: March 12, 2004
Accepted: March 18, 2004
Published online: August 15, 2004
AIM: To construct recombinant expression vector expressing HspA-UreB fusion protein of Helicobacter pylori (H. pylori), and to determine its immunoreactivity, in order to develop gene recombinant vaccine against H. pylori infection.
METHODS: The hspA and ureB genes were amplified by PCR from H. pylori MEL-HP27 isolated in Zhengzhou and cloned directionally into vector pNEB193. These two genes were restricted by using two corresponding restriction enzyme separately and cloned together into the fusion expression vector pET-30 (a), and the recombinant plasmid was then used to transform E.coli BL21 (DE3). The positive clones were identified by PCR and restriction enzyme digestion. The recombinant fusion protein HspA-UreB was induced to express from E.coli by IPTG and was analyzed by SDS-PAGE. The fusion protein was purified by use of Ni2+ affinity chromatography and then used to immunize mice. The immunogenecity and immunoreactivity of the fusion protein were analyzed by Western blot.
RESULTS: The hspA-ureB fusion gene was amplified from the recombinant fusion expression plasmid pET-HU27 (pET-HspA-UreB) by PCR, and also the hspA-ureB fusion gene fragment was produced from these plasmids after restriction enzyme digestion. SDS-PAGE and optical density scanning indicated that the fusion protein was expressed in the recombinant vaccine strain BL21 (pET-HU27) as a protein with 82.1 KDa of molecular weight that accounted for 21% of the total bacterial protein. The purity of fusion protein was 91%. Western blot analysis of the purified fusion protein confirmed that it could specifically be recognized by mouse serum.
CONCLUSION: A recombinant vaccine candidate strain expression fusion protein HspA-UreB of H. pylori is constructed and identified successfully, and purified fusion protein has strong immunoreactivity.
- Citation: Dai LP, Duan GC, Fan QT, Xi YL, Zhang RG. Expression and immunocompetence of HspA-UreB fusion protein of Helicobacter pylori. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1818-1822
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1818.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1818
幽门螺杆菌(Helicobacter pylori, H. pylori)感染是慢性萎缩性胃炎、消化性溃疡以及胃癌的重要致病因素[1-4], 世界卫生组织已将H. pylori列为人类 I类生物致癌因子[5], 而且H. pylori感染在世界范围内流行十分广泛, 尤其是在发展中国家. 由于H. pylori感染的治疗方法存在一些弊端, 难以在人群中推广, 因此, 研制一种安全有效的疫苗成为防治H. pylori感染的重要手段[6]. 目前, 虽然已经找到几种具有免疫保护性的H. pylori抗原, 但单独一种抗原免疫动物时效果并不十分理想, 而两种抗原联合作用时保护作用明显增加[7]. 拟将H. pylori两种已被证实具有良好免疫保护性的抗原热休克蛋白A亚单位(heat shock protein subunit A, HspA)和尿素酶B亚单位(urease subunit B, UreB)利用基因工程的方法融合表达, 并分析融合蛋白HspA-UreB的免疫学活性, 为H. pylori联合抗原基因工程疫苗的研究奠定基础.
H. pylori MEL-HP27系本研究室保存, 分离自郑州慢性浅表性萎缩性胃炎患者. 原核表达载体pET30a(+)系Invitrogen公司产品. 大肠杆菌DH5α和BL21(DE3)为本研究室保存. EcoRI、SalI、XhoI、Pyrobest DNA 聚合酶、T4 DNA 连接酶购自大连宝生物工程公司. DNA标准分子质量1 kb DNA Ladder和卡那霉素购自上海生工公司. 辣根过氧化物酶标记的羊抗人、羊抗鼠IgG系北京邦定公司产品. DNA凝胶回收试剂盒系Vitagen产品. 1 mL亲和层析预装柱系Amphamacia公司产品. 其他常规试剂配制按参考文献(分子克隆实验指南. 北京: 科学出版社, 1992).
1.2.1 H. pylori hspA 和ureB基因的克隆:hspA的上游引物5'端加EcoRI酶切位点, 保留起始密码子ATG; 在下游引物5'端加SalI酶切位点, 去除终止密码子TAA. 引物序列: hpr1: 5'-CCC GAA TTC ATG AAG TTT CAA CCA TTA- 3'; hpr2:5'-CGC GTC GAC GTG TTT TTT GTG ATC ATG AC- 3'. ureB的上游引物5'端加SalI酶切位点, 去除起始密码ATG, 下游引物3'加XhoI酶切位点, 保留终止密码TAG, 引物序列: upr1: 5'-CC GTC GAC AAA AAG ATT AGC AGA AAA G- 3'; upr2: 5'- CGC CTC GAG CTA GAA AAT GCT AAA GAG- 3'. 引物由上海生工公司合成. PCR反应条件见参考文献[8-9].
1.2.2 重组表达质粒pET-hspA-ureB的构建和表达:hspA和ureB PCR产物分别经双酶切后利用胶回收试剂盒回收, 然后以hspA-ureB的顺序连接入原核表达载体pET30a(+), 转化大肠杆菌DH5α, 卡那霉素抗性筛选阳性菌落, 特异PCR和质粒酶切电泳鉴定重组质粒. 阳性重组质粒简称pET-HU27. 取小提质粒pET-HU27 1 μL转化BL21(DE3), 小提质粒、酶切鉴定. 构建表达HspA-UreB融合蛋白的重组子BL21(pET-HU27). 从过夜培养的BL21(pET-HU27)菌液中取50 μL, 加入5 mL含50 mg/L卡那霉素的LB培养液中, 250 r/min, 37 ℃振荡培养至对数生长期. 加化学诱导剂IPTG至终浓度为0.3 mmol/L, 继续250 r/min, 35 ℃振荡培养4 h, 制备样品进行SDS-PAGE电泳. 大量诱导的菌液, 4 ℃, 4 000 g离心20 min收集细菌, 1×PBS洗菌1次. 将细菌重悬于纯水5 mL中. 进行超声破碎, 12 000 g离心15 min, 上清备纯化. 0.1 mol/L NiCl2 0.5 mL过柱, 挂镍. Start buffer (20 mmol/L Na2HPO4, 0.5 mol/L NaCl, 10 mmol/L咪唑)10 mL平衡过柱. 5 mL上清液过柱, 流速控制在1 mL/min. Start buffer 10 mL 洗柱, Elution buffer (20 mmol/L Na2HPO4, 0.5 mol/L NaCl, 500 mmol/L 咪唑)5 mL洗脱, 收集洗出物, 电泳观察纯化效果.
1.2.3 融合蛋白HspA-UreB的免疫活性分析: 取1 ml纯化的融合蛋白HspA-UreB与0.5 ml完全弗氏佐剂混匀, 进行超声乳化(200 W, 10 s, 间歇1 min, 共4次). 选择8周龄的昆明小鼠6只, 每只背部皮下两点注射抗原100 μL, 1次/wk, 共免疫 5次. 最后1次免疫后1 wk, 摘眼球取血, 分离血清, -20 ℃保存备用. 蛋白样品经SDS-PAGE后, 凝胶和PVDF膜在转移缓冲液(25 mmol/L Tris, 192 mmol/L 甘氨酸, 20 ml/L甲醇, 0.1 g/L SDS)中浸泡15 min, 于半干式电转印仪25V转印25 min. PVDF膜用蒸馏水洗3次, PBS洗1次, 转入封闭液(PBST+10 g/L脱脂奶粉), 4 ℃封闭过夜. 与血清反应2 h, 洗膜后, 与辣根过氧化物酶标记的第2抗体(1: 1 000)反应1 h, 用DAB(二氨基联苯胺)显色.
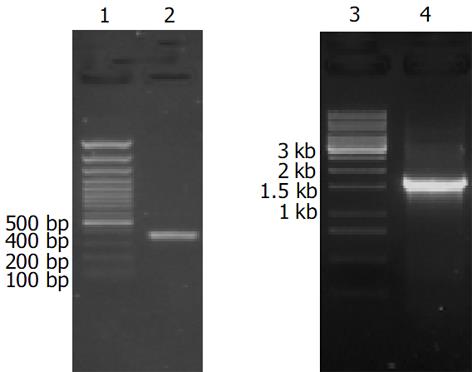
H. pylori菌株MEL-HP27经提取染色体DNA进行PCR扩增, hspA基因(354 bp)和ureB基因(1 707 bp)均扩增出相应大小的基因片段(图1). MEL-HP27 hspA和ureB 的PCR产物经过连接、转化、筛选后, 小提质粒, 对重组质粒进行EcoRI、XhoI双酶切, 获得与预计融合基因大小一致的DNA片段(2 067 bp)(图2). 以hspA的上游引物和 ureB的下游引物为一对引物, 以重组质粒为模板进行扩增, 亦获得了2 067 bp左右的目的片段. 重组质粒pET-HU27构建成功, hspA和ureB基因测序结果与参考文献[8-9] 中的序列一致.
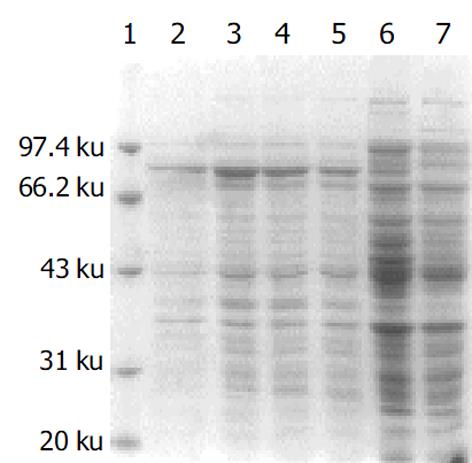
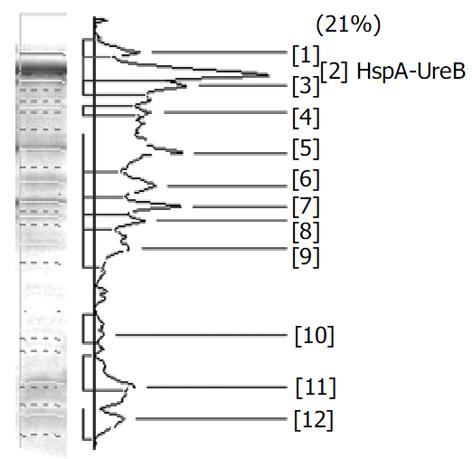
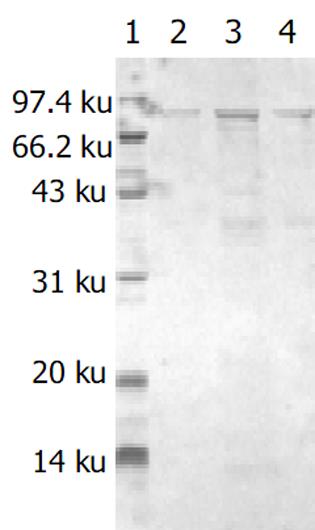
分别带有重组质粒和空质粒的大肠杆菌[即BL21(pET-HU27)和BL21(pET30a)]经IPTG诱导后进行蛋白电泳, 结果在BL21(pET-HU27)的全菌蛋白中检测到了预期分子质量的表达产物(图3). HspA-UreB的分子质量为76.5 KDa, 而pET30质粒中从翻译起始密码ATG到EcoRI之间有154 bp, 约5.6 KDa, 因此融合蛋白实际分子量应为82.1 KDa. 经Genetools 软件分析, 融合蛋白在全菌中所占的比例分别为21%(见图4). 诱导3 h产物经SDS-PAGE电泳后, 转印到PVDF膜上, 与1: 50 H. pylori (+)患者血清进行Westernblot分析, 结果在82.1 KDa左右处出现一条特异反应带, 证实BL21(pET-HU27)可以正确表达融合蛋白HspA-UreB.
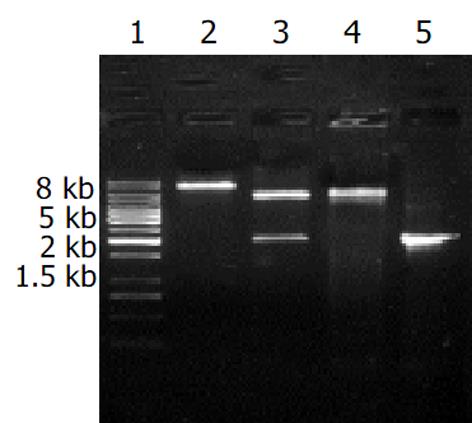
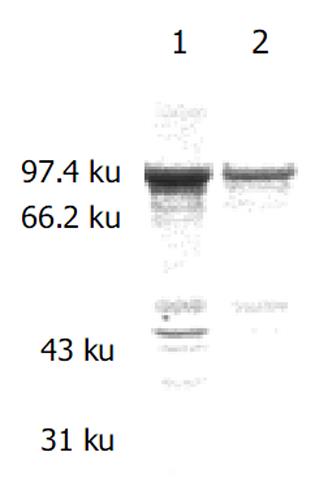
镍离子柱准备好后, 先用Start buffer 平衡柱, BL21(pET-HU27)诱导表达的上清5 mL过柱, Start buffer洗柱后, 用Elution buffer洗脱, 收集洗脱蛋白, SDS-PAGE电泳检查蛋白纯化结果. 共收集5管, 结果融合蛋白主要出现在第1-3管中(图5). 含量高达91%, 浓度约30 mg/L. 亲和层析纯化的融合蛋白经SDS-PAGE电泳后, 电转移至PVDF膜, 先后与1: 30稀释的HspA-UreB免疫小鼠血清和1: 1 000羊抗鼠 IgG-HRP反应后, DAB显色. 结果在82.1 KDa处出现一条特异反应带, 证实纯化的融合蛋白可以刺激小鼠产生相应抗体, 并可以特异性与相应抗体发生反应, 证明其具有免疫原性, 并能与该融合蛋白发生免疫反应(图6).
已经证实具有免疫保护作用的Hp抗原有: UreB[10]、HspA[11]、VacA[12]、过氧化氢酶[13-14]等, 近年来新发现的一些抗原如: Lpp20[15-16]、NAP[17-18]等, 也都有望成为Hp疫苗的保护性抗原候选. 但研究表明, 当多种抗原联合使用免疫动物时, 可产生比一种抗原强的免疫保护作用. 目前, 国内学者正致力于多价抗原Hp基因工程疫苗的研究[19-21,30]. 本研究则选用Hp两种保守性和免疫效果均较好的抗原: HspA和UreB, 构建表达融合蛋白HspA-UreB的原核表达系统, 探讨其免疫学活性, 为Hp多价疫苗的研究奠定基础.
尿素酶(urease, Ure)是目前研究最多也是最深入的一种抗原. 口服尿素酶B亚单位及佐剂可刺激机体产生相应的体液免疫、细胞免疫及黏膜免疫应答[22-24]. Cynthia及其同伴[25]将2.4 kb UreB基因克隆入pET24+并转入E.coli BL21(DE3)中, 纯化尿素酶, 用口服和灌胃两种方法辅以佐剂大肠杆菌毒素(LT)或CT免疫Webster小鼠, H.feli攻击小鼠, 尿素酶检测结果显示保护率60%-100%. Monath et al[26]用重组Ure加CT或LT免疫小鼠, 获得70%-80%的保护率.
热休克蛋白(Heat shock protein, Hsp)是一种高度保守的蛋白质, 幽门螺杆菌的Hsp的属于Hsp60族, Hsp60对尿素酶亚单位分子的穿膜输出和出膜后尿素酶复合体的装配有关系, 而且对处于胃酸局部pH变化和活性蛋白酶中的完整Hp表面的尿素酶有稳定作用[27]. H. pylori 的Hsp由A、B两个亚单位组成, HspA包括两个区域: N区与GroES家族同源物高度保守, 是免疫显性区; C区有27个氨基酸残基, 其中8个是组氨酸残基, 4个是半胱氨酸残基, 上述结构为金属镍离子结合区, 对镍离子的转运、呈递起着重要的作用. 他可以增强尿素酶的活性, 同时又是一种有效的抗原成分, 且位于细菌表面, 相对保守[28]. 有望成为Hp亚单位疫苗的重要候选组分之一[29]. Todoroki et al[11]制备了编码热休克蛋白A的DNA疫苗(pcDNA3.1-HspA), 对C57BL小鼠进行皮下接种, 产生了TH1型免疫反应, 显著地减少H. pylori在胃内的定植, 同时减轻因H. pylori存在的炎症反应. 因此, 以HspA为基础的疫苗不失为一种有效的H. pylori疫苗.
pET原核表达载体系列是目前应用最广泛的高效表达载体之一. pET30a(+)是其中的一种, 所带起始密码子ATG与6个组氨酸和外源基因表达为融合蛋白质, 但是被融合的一段DNA所表达的蛋白质免疫原性很低(仅5.6 KDa), 对重组蛋白质的结构和功能无干扰, 因而表达产物可以直接供免疫使用.
本研究利用PCR法从郑州分离H. pylori MEL-HP27中获得hspA和ureB基因, 然后以hspA-ureB的顺序融合插入pET30a中, 转化大肠杆菌DH5α, 经质粒酶切和特异PCR鉴定重组质粒pET-HU27, 再转入宿主菌BL21(DE3)中, 成功构建表达系统BL21(pET-HU27). 重组菌经IPTG诱导, 结果在82.1 KDa(5.6 KDa+76.5 KDa)处出现一条特异蛋白带, 诱导3 h, 融合蛋白表达量达到最高值, 约占全菌蛋白的21%左右, 与人H. pylori阳性血清杂交时, 该蛋白可以被H. pylori阳性患者血清所识别. 纯化后的蛋白经与小鼠免疫血清进行Western blot分析, 可以被小鼠血清中相应抗体所识别, 证明纯化后的融合蛋白仍具有较好的免疫反应性. HspA与UreB两种蛋白融合表达不但可以增加蛋白结构的复杂性, 从而增加抗原性, 而且在后期蛋白纯化过程中可以简化步骤, 为H. pylori疫苗的成功研究提供方便.
编辑: N/A
| 1. | Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet. 1983;1:1273-1275. [PubMed] |
| 2. | Mendall MA. Transmission of Helicobacter pylori. Semin Gastrointest Dis. 1997;8:113-123. [PubMed] |
| 3. | Blaser MJ. Gastric Campylobacter-like organisms, gastritis, and peptic ulcer disease. Gastroenterology. 1987;93:371-383. [PubMed] [DOI] |
| 4. | Goodwin CS. Duodenal ulcer, Campylobacter pylori, and the "leaking roof" concept. Lancet. 1988;2:1467-1469. [PubMed] [DOI] |
| 5. | Vainio H, Heseltine E, Wilbourn J. Priorities for Future IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Environ Health Perspect. 1994;102:590-591. [PubMed] [DOI] |
| 6. | Mastroeni P, Bowe F, Cahill R, Simmons C, Dougan G. Vaccines against gut pathogens. Gut. 1999;45:633-635. [PubMed] [DOI] |
| 7. | Ferrero RL, Thiberge JM, Kansau I, Wuscher N, Huerre M, Labigne A. The GroES homolog of Helicobacter pylori confers protective immunity against mucosal infection in mice. Proc Natl Acad Sci U S A. 1995;92:6499-6503. [PubMed] [DOI] |
| 8. | 代 丽萍, 段 广才, 郗 园林, 范 清堂. 幽门螺杆菌热休克蛋白A亚单位编码基因的克隆与序列分析. 胃肠病学和肝病学杂志. . |
| 9. | 代 丽萍, 段 广才, 郗 园林, 范 清堂. 幽门螺杆菌尿素酶B亚单位编码基因的克隆与序列分析. 胃肠病学和肝病学杂志. . |
| 10. | Gómez-Duarte OG, Lucas B, Yan ZX, Panthel K, Haas R, Meyer TF. Protection of mice against gastric colonization by Helicobacter pylori by single oral dose immunization with attenuated Salmonella typhimurium producing urease subunits A and B. Vaccine. 1998;16:460-471. [PubMed] [DOI] |
| 11. | Todoroki I, Joh T, Watanabe K, Miyashita M, Seno K, Nomura T, Ohara H, Yokoyama Y, Tochikubo K, Itoh M. Suppressive effects of DNA vaccines encoding heat shock protein on Helicobacter pylori-induced gastritis in mice. Biochem Biophys Res Commun. 2000;277:159-163. [PubMed] [DOI] |
| 12. | Rossi G, Ruggiero P, Peppoloni S, Pancotto L, Fortuna D, Lauretti L, Volpini G, Mancianti S, Corazza M, Taccini E. Therapeutic vaccination against Helicobacter pylori in the beagle dog experimental model: safety, immunogenicity, and efficacy. Infect Immun. 2004;72:3252-3259. [PubMed] [DOI] |
| 13. | Chen M, Chen J, Liao W, Zhu S, Yu J, Leung WK, Hu P, Sung JJ. Immunization with attenuated Salmonella typhimurium producing catalase in protection against gastric Helicobacter pylori infection in mice. Helicobacter. 2003;8:613-625. [PubMed] [DOI] |
| 14. | Miyashita M, Joh T, Watanabe K, Todoroki I, Seno K, Ohara H, Nomura T, Miyata M, Kasugai K, Tochikubo K. Immune responses in mice to intranasal and intracutaneous administration of a DNA vaccine encoding Helicobacter pylori-catalase. Vaccine. 2002;20:2336-2342. [PubMed] [DOI] |
| 15. | Keenan J, Neal S, Allardyce R, Roake J. Serum-derived IgG1-mediated immune exclusion as a mechanism of protection against H. pylori infection. Vaccine. 2002;20:2981-2988. [PubMed] [DOI] |
| 16. | Keenan J, Oliaro J, Domigan N, Potter H, Aitken G, Allardyce R, Roake J. Immune response to an 18-kilodalton outer membrane antigen identifies lipoprotein 20 as a Helicobacter pylori vaccine candidate. Infect Immun. 2000;68:3337-3343. [PubMed] [DOI] |
| 17. | Dundon WG, Nishioka H, Polenghi A, Papinutto E, Zanotti G, Montemurro P, Del GG, Rappuoli R, Montecucco C. The neutrophil-activating protein of Helicobacter pylori. Int J Med Microbiol. 2002;291:545-550. [PubMed] [DOI] |
| 18. | Satin B, Del Giudice G, Della Bianca V, Dusi S, Laudanna C, Tonello F, Kelleher D, Rappuoli R, Montecucco C, Rossi F. The neutrophil-activating protein (HP-NAP) of Helicobacter pylori is a protective antigen and a major virulence factor. J Exp Med. 2000;191:1467-1476. [PubMed] [DOI] |
| 20. | 朱 森林, 陈 旻湖, 陈 洁, 焦 志勇, 李 国庆, 陈 为, 彭 晓忠, 胡 品津. 优化构建UreB/HpaA双价幽门螺杆菌减毒活菌疫苗的免疫保护作用. 中华消化杂志. 2003;23:583-586. |
| 21. | 李 勣, 刘 纯杰, 李 淑琴, 陶 好霞, 刘 秀丽, 张 兆山. 幽门螺杆菌ureB及ureB-hspA融合基因在减毒鼠伤寒沙门菌中的表达及小鼠的免疫应答. 中华微生物学和免疫学杂志. 2003;23:513-516. |
| 22. | Lee MH, Roussel Y, Wilks M, Tabaqchali S. Expression of Helicobacter pylori urease subunit B gene in Lactococcus lactis MG1363 and its use as a vaccine delivery system against H. pylori infection in mice. Vaccine. 2001;19:3927-3935. [PubMed] [DOI] |
| 23. | Liu X, Hu J, Zhang X, Fan D. Oral immunization of mice with attenuated Salmonella typhimurium expressing Helicobacter pylori urease B subunit. Chin Med J (Engl). 2002;115:1513-1516. [PubMed] |
| 24. | Mao YF, Yan J. Construction of prokaryotic expression system of ureB gene from a clinical Helicobacter pylori strain and identification of the recombinant protein immunity. World J Gastroenterol. 2004;10:977-984. [PubMed] |
| 25. | Lee CK, Weltzin R, Thomas WD Jr, Kleanthous H, Ermak TH, Soman G, Hill JE, Ackerman SK, Monath TP. Oral immunization with recombinant Helicobacter pylori urease induces secretory IgA antibodies and protects mice from challenge with Helicobacter felis. J Infect Dis. 1995;172:161-172. [PubMed] [DOI] |
| 26. | Tochikubo K, Isaka M, Yasuda Y, Kozuka S, Matano K, Miura Y, Taniguchi T. Recombinant cholera toxin B subunit acts as an adjuvant for the mucosal and systemic responses of mice to mucosally co-administered bovine serum albumin. Vaccine. 1998;16:150-155. [PubMed] [DOI] |
| 27. | 范 学工, 夏 华向. 幽门螺杆菌感染-基础与临床. 长沙: 湖南科学技术出版社 1997; 33-34. |
| 28. | Kansau I, Guillain F, Thiberge JM, Labigne A. Nickel binding and immunological properties of the C-terminal domain of the Helicobacter pylori GroES homologue (HspA). Mol Microbiol. 1996;22:1013-1023. [PubMed] [DOI] |
| 29. | Michetti P, Corthésy-Theulaz I, Davin C, Haas R, Vaney AC, Heitz M, Bille J, Kraehenbuhl JP, Saraga E, Blum AL. Immunization of BALB/c mice against Helicobacter felis infection with Helicobacter pylori urease. Gastroenterology. 1994;107:1002-1011. [PubMed] [DOI] |