修回日期: 2004-04-15
接受日期: 2004-04-27
在线出版日期: 2004-07-15
目的: 构建含有融合基因FCU1的自杀基因系统, 观察其对体外培养肝癌细胞的杀伤效应.
方法: 将FCU1基因亚克隆于pEGFP-C1载体, 转化大肠杆菌DH5, 阳性重组子转染肝癌细胞HepG2, 绿色荧光蛋白检测FCU1的表达, 用G418筛选出阳性细胞克隆后, 进行体外药物敏感实验, 观察旁观者效应.
结果: FCU1基因正确插入到pEGFP-C1中, pEGFP-FCU1转染成功的细胞在荧光显微镜下可见绿色荧光, 在5-FC作用下细胞的生长抑制率明显高于未转染细胞, 且旁观者效应显著.
结论: 本基因治疗体系具有很好的体外杀肿瘤效果, 为肝癌的基因治疗提供了一个新的选择.
引文著录: 谢娜, 林菊生, 吴斌文, 黎培员. 双功能融合基因在肝癌细胞中的表达与作用. 世界华人消化杂志 2004; 12(7): 1740-1742
Revised: April 15, 2004
Accepted: April 27, 2004
Published online: July 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1740-1742
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1740.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1740
自杀基因/前药系统是一种很有效的肿瘤药物敏感基因疗法, 这种方法已在多种肿瘤的治疗中得到应用. 新型、高效的融合自杀基因FCU1是由FCY1和FUR1两种自杀基因的编码序列经过特定的酶切、连接、定点缺失突变等过程融合而成[1]. FCY1和FUR1基因分别编码胞嘧啶脱氨酶(CDase)和尿嘧啶磷酸核糖转移酶(UPRTase), 可将5-FC直接代谢为5-FU的单磷酸化产物, 在肿瘤自杀基因治疗中可产生双功能杀伤细胞的功效[2-4]. 我们将构建好的自杀基因真核细胞表达载体用一定方式导入肿瘤细胞获得稳定表达的细胞株, 并探讨FCU1/5-FC自杀基因系统对体外培养肝癌细胞的杀伤效应.
pCIneoFCU1由Transgene S.A.惠赠, pEGFP-C1由本实验室保存, 宿主菌DH5由本室保存, 肝癌细胞株HepG2由本室保存, 在含100 mL/L小牛血清、100 IU/mL青/链霉素的DMEM培养基(Gibco公司)中于37 ℃, 50 mL/LCO2培养箱中培养. 限制性内切酶SmaⅠ, XhoⅠ购自MBI公司, DNA回收试剂盒、质粒提取试剂盒购自上海华舜公司, T4DNA ligase购自MBI公司, 脂质体LipoGen购自InvivoGen公司, G418购自Gibco公司, 5-FC购自Sigma 公司.
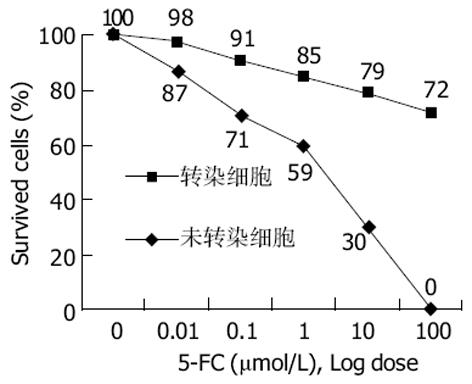
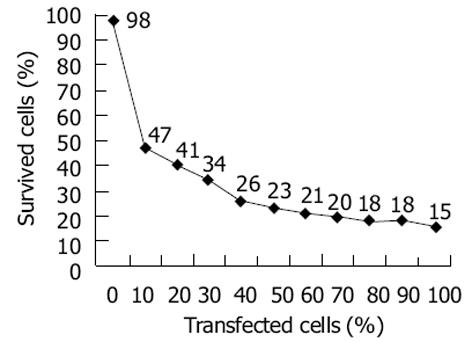
用SmaⅠ、XhoⅠ分别双酶切pEGFP-C1和pCIneoFCU1, 琼脂糖凝胶电泳检测酶切产物并回收目的基因片断, 将载体片段、目的基因片段按摩尔比1: 3混合, 用T4DNA连接酶于4 ℃连接过夜. 取适量连接产物用低温CaCl2法转化DH5, 同时用空载体质粒转化作为阳性对照. 筛选出阳性克隆后, 提取质粒, 琼脂糖凝胶电泳鉴定阳性产物, 即得所需重组体质粒pEGFP-FCU1. HepG2细胞培养至对数生长期时转入6孔板, 每孔5×105个细胞, 重组体质粒pEGFP-FCU1用LipoGen脂质体进行转染, 对照组转染pEGFP-C1空质粒, 48 h后于荧光显微镜下观察结果. 用400 mg/L的G418筛选阳性细胞克隆, 获得稳定表达的单克隆细胞, 记为HepG2/FCU1, 再扩大培养. 检测前药5-FC作用下的细胞生长抑制率, 将HepG2/FCU1细胞以2×105个/孔接种于6孔板中, 24 h后, 6孔细胞分别加不同体积的5-FC使其终浓度依次为0, 0.01, 0.1, 1, 10, 100 mol/L, 每组设3个复孔, 并用未转染细胞HepG2做阴性对照, 连续观察培养6 d后用台盼兰染色排除法分别计数总细胞数和兰染细胞数, 计算细胞生长抑制率. 在96孔板上将转染的细胞与未转染细胞分别以0: 1, 1: 9, 2: 8, 3: 7, 4: 6, 5: 5, 6: 4, 7: 3, 8: 2, 9: 1, 1: 0的比例混合, 每组设3个复孔, 经100 mol/L5-FC 作用6 d后, 用MTT法检测体外旁观者效应[5].
统计学处理 实验数据用方差分析法检验, 组间比较用LSD检验法, 以P<0.05为差异有显著性.
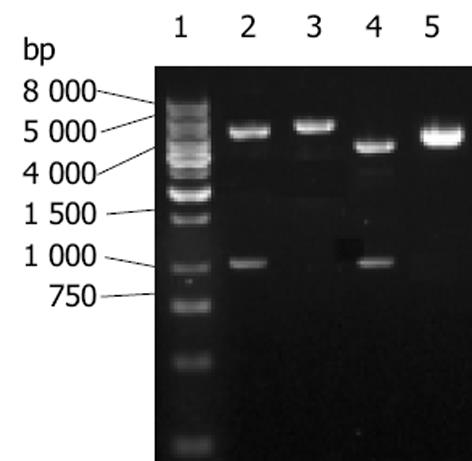
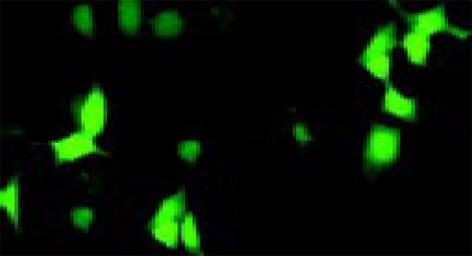
重组体质粒经SmaⅠ, XhoⅠ双酶切, 应获得约1 100 bp(目的基因)和4 500 bp(载体)的两条线性片段, 并与pCIneoFCU1双酶切所得目的基因片段大小一致(图1). pEGFP-FCU1转染HepG2细胞48 h后荧光显微镜下可见绿色荧光(图2), 转染效率约40%. G418筛选至单细胞克隆呈集落生长时, 再进行荧光观察, 记为HepG2/FCU1细胞. HepG2, HepG2 /FCU1及HepG2/EGFP(转染空质粒组)细胞的倍增时间分别为(40.4±0.1) h, (42.8±0.1 h), (41.5±0.1 h), 方差分析显示3组间差异无显著性 (P>0.05), 表明外源基因的转入与表达不影响细胞的生长速度.
肝癌是全球高发肿瘤之一, 最常见的肝细胞癌一般对化疗高度耐药, 目前惟一的治愈方法只有部分肝叶切除术和肝移植[6-7]. 基因治疗是一种新的有前景的治疗形式, 其基本原理就是将遗传物质导入细胞以产生生物学的治疗效应. 病毒或细菌中的一些酶可将无毒或低毒的前药转化为致死性的毒性化合物, 自杀基因治疗即是将编码这些酶的基因导入到靶细胞中, 因此也称为"病毒介导的酶/前药治疗(virus-directed enzyme/prodrug therapy, VDEPT)"[8]. TK/GCV(thymidine kinase/ganciclovir)和CD/5-FC系统是目前肝癌基因治疗中应用最广泛的前药激活系统, 许多体内和体外实验均证实有较好的抑制肿瘤细胞生长的作用[9-13]. 自杀基因的一个显著特点就是所谓的旁观者效应(bystander effect), 即转染细胞中的毒性药物代谢物可弥散至邻近组织中, 增加受作用的瘤细胞数目. 因此, 即使仅有部分肿瘤细胞被转染时也可取得显著的杀瘤效果. 一些双位点模型研究表明, 同时在肝的两叶内分别接种野生型的结肠癌细胞和转染有CD基因的结肠癌细胞, 在用5-FC治疗后, 两个病灶均消退, 这意味着旁观者效应甚至可在较远的部位发生作用[14]. 融合基因FCU1既能编码CD基因, 又编码UPRTase基因, 其表达产物是一个具有双功能的高效杀伤系统, Philippe Erbs et al的研究表明, FCU1/5-FC系统能显著抑制多种肿瘤细胞的生长, 转染了FCU1基因的肿瘤细胞对前药5-FC的敏感性比单纯转染FCY1基因的肿瘤细胞高出100倍, 且其旁观者效应明显强于单独转染FCY1或FUR1基因、亦或是同时转染两个基因的细胞[1,15-16]. 我们在实验中初步探讨了FCU1/5-FC系统的体外抗肿瘤作用, 为进一步研究该自杀基因在肿瘤基因治疗中的应用奠定了良好的基础.
编辑: N/A
| 1. | Erbs P, Regulier E, Kintz J, Leroy P, Poitevin Y, Exinger F, Jund R, Mehtali M. In vivo cancer gene therapy by adenovirus-mediated transfer of a bifunctional yeast cytosine deaminase/uracil phosphoribosyltransferase fusion gene. Cancer Res. 2000;60:3813-3822. [PubMed] |
| 2. | Erbs P, Exinger F, Jund R. Characterization of the Saccharomyces cerevisiae FCY1 gene encoding cytosine deaminase and its homologue FCA1 of Candida albicans. Curr Genet. 1997;31:1-6. [PubMed] [DOI] |
| 3. | Kievit E, Bershad E, Ng E, Sethna P, Dev I, Lawrence TS, Rehemtulla A. Superiority of yeast over bacterial cytosine deaminase for enzyme/prodrug gene therapy in colon cancer xenografts. Cancer Res. 1999;59:1417-1421. [PubMed] |
| 4. | Kanai F, Kawakami T, Hamada H, Sadata A, Yoshida Y, Tanaka T, Ohashi M, Tateishi K, Shiratori Y, Omata M. Adenovirus-mediated transduction of Escherichia coli uracil phosphoribosyltransferase gene sensitizes cancer cells to low concentrations of 5-fluorouracil. Cancer Res. 1998;58:1946-1951. [PubMed] |
| 5. | Lv SQ, Yang H, He JQ, Wang B, Yoshimura I, Liu YS. Effects of CD/5-FC suicide gene therapy system on human malignant glioma cells in vitro. Sheng Wu Hua Xue Yu Sheng Wu Wu Li Xue Bao (Shanghai). 2003;35:430-434. [PubMed] |
| 6. | Badvie S. Hepatocellular carcinoma. Postgrad Med J. 2000;76:4-11. [DOI] |
| 8. | Moolten FL. Drug sensitivity ("suicide") genes for selective cancer chemotherapy. Cancer Gene Ther. 1994;1:279-287. [PubMed] |
| 9. | Narita M, Bahar R, Hatano M, Kang MM, Tokuhisa T, Goto S, Saisho H, Sakiyama S, Tagawa M. Tissue-specific expression of a suicide gene for selective killing of neuroblastoma cells using a promoter region of the NCX gene. Cancer Gene Ther. 2001;8:997-1002. [PubMed] [DOI] |
| 10. | van Dillen IJ, Mulder NH, Vaalburg W, de Vries EF, Hospers GA. Influence of the bystander effect on HSV-tk/GCV gene therapy. A review. Curr Gene Ther. 2002;2:307-322. [PubMed] [DOI] |
| 11. | Nowak AK, Lake RA, Kindler HL, Robinson BW. New approaches for mesothelioma: biologics, vaccines, gene therapy, and other novel agents. Semin Oncol. 2002;29:82-96. [PubMed] [DOI] |
| 12. | Qiao J, Doubrovin M, Sauter BV, Huang Y, Guo ZS, Balatoni J, Akhurst T, Blasberg RG, Tjuvajev JG, Chen SH. Tumor-specific transcriptional targeting of suicide gene therapy. Gene Ther. 2002;9:168-175. [PubMed] [DOI] |
| 13. | Yazawa K, Fisher WE, Brunicardi FC. Current progress in suicide gene therapy for cancer. World J Surg. 2002;26:783-789. [PubMed] [DOI] |
| 14. | Pierrefite-Carle V, Baque P, Gavelli A, Benchimol D, Bourgeon A, Milano G, Saint-Paul MC, Rossi B. Regression of experimental liver tumor after distant intra-hepatic injection of cytosine deaminase-expressing tumor cells and 5-fluorocytosine treatment. Int J Mol Med. 2000;5:275-278. [PubMed] [DOI] |
| 15. | Desaknai S, Lumniczky K, Esik O, Hamada H, Safrany G. Local tumour irradiation enhances the anti-tumour effect of a double-suicide gene therapy system in a murine glioma model. J Gene Med. 2003;5:377-385. [PubMed] [DOI] |
| 16. | Tiraby M, Cazaux C, Baron M, Drocourt D, Reynes JP, Tiraby G. Concomitant expression of E. coli cytosine deaminase and uracil phosphoribosyltransferase improves the cytotoxicity of 5-fluorocytosine. FEMS Microbiol Lett. 1998;167:41-49. [PubMed] [DOI] |