修回日期: 2004-03-25
接受日期: 2004-04-05
在线出版日期: 2004-07-15
目的: 分析胃癌组织中DNA甲基化酶Dnmt1和hMSH2表达情况的相关性及与肿瘤生物学行为之间的关系.
方法: 以real-time RT PCR法检测28例胃癌组织中Dnmt1和hMSH2 mRNA的表达, 亚硫酸氢钠变性后测序分析hMSH2启动子区甲基化状态.
结果: 在28例胃癌组织中有9例(32%)DNMT1 mRNA的高表达, 10例hMSH2(35.7%)的低表达, 在hMSH2低表达的胃癌组织中有2例存在DNA启动子区的高甲基化. 两个基因mRNA的表达与胃癌生物学行为包括肿瘤大小、淋巴结转移、组织学类型均无明显相关性.
结论: 胃癌组织中存在Dnmt1的高表达, DNA甲基化在一定程度上参与了hMSH2基因表达的缺失.
引文著录: 程中华, 房静远, 杨丽, 陈萦, 陆嵘, 朱红音, 顾伟齐, 陈晓宇, 彭延申, 施尧. hMSH2在胃癌组织中的表达及其与DNA甲基化之间的关系. 世界华人消化杂志 2004; 12(7): 1731-1733
Revised: March 25, 2004
Accepted: April 5, 2004
Published online: July 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1731-1733
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1731.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1731
肿瘤组织多有DNA甲基化的紊乱. DNA甲基化由DNA甲基化酶(DNA methylatransferase, Dnmt)催化, 他能将甲基供体提供的甲基集团转移至胞嘧啶5位碳上形成5-甲基胞嘧啶.DNA甲基化酶包括参与甲基化的形成(Dnmt3a 和Dnmt3b的主要作用)和维持(主要是Dnmt1)两类酶. 人类DNA错配修复系统(mismatch repair system, MMR)是由一系列特异性修复DNA碱基错配的酶分子组成, 此系统的存在能避免遗传物质产生突变, 保证DNA复制的高保真度. hMSH2是目前研究较广泛的DNA错配修复基因, 他的失活可导致DNA错配修复能力的降低, 引起微卫星不稳定性(microsatellite instability, MSI), 可使癌基因激活或抑癌基因失活, 诱发细胞癌变[1]. 现已发现, 癌发生过程中导致错配修复基因失活的另一方式为DNA甲基化的改变, 这种改变常伴有错配修复基因表达的丢失[2-3]. 目前对于hMSH2启动子甲基化情况的研究还较少. 我们研究了胃癌组织中DNA甲基化酶Dnmt1和hMSH2表达情况的相关性及与肿瘤生物学行为之间的关系, 并进一步分析了hMSH2启动子区的甲基化状态.
2001-05/2002-07组织学确诊为胃癌的手术患者28例, 临床资料完整, 术前均未进行任何抗肿瘤治疗. 癌组织取自肿块中央非坏死部分, 癌旁组织取自距癌灶边缘5 cm以内的黏膜组织, 正常组织取自距肿块10 cm以上的正常黏膜组织. 所有标本均经本院两位高年资病理科医生证实. 患者平均年龄58.4岁. 行胃癌根治术27例, 姑息性胃大部切除术1例. 病理类型: 溃疡性腺癌6例, 浸润溃疡15例, 弥漫浸润腺癌7例. 临床分期: Ⅰ期2例, Ⅱ-Ⅲ期26例. 淋巴结转移: 21例存在淋巴结转移, 7例不存在.
RNA的提取和cDNA的合成见文献[4]. 定量PCR检测Dnmt, hMSH2的表达方法见文献[4]. 具体引物和探针见表1. hMSH2 DNA亚硫酸氢钠变性后测序.DNA经亚硫酸氢盐修饰能够使没有甲基化的胞嘧啶转变为尿嘧啶, 后者在PCR扩增中以胸腺嘧啶形式扩增, 而原有甲基化的胞嘧啶则保持胞嘧啶不变.处理步骤: 取5 g DNA加NaOH至终浓度为0.2 moL/L, 37 ℃变性10 min. 向变性DNA中加入新鲜配置的10 mmoL/L的氰醌30 ul及3 moL/L的亚硫酸氢钠(pH = 5) 520 ul, 加入矿物油200 ul. 样品于50 ℃孵育16 min. 修饰后的DNA根据说明书用Wizerd DNA纯化树脂(Promega)纯化, 用50 ul水洗脱.加5.5 ul 3 moL/L NaOH至洗脱液, 室温放置5 min. 加17 uL 10 moL/L的醋酸胺, 1 uL的糖原及500 uL的950 mL/L冰冷乙醇, 过夜.14 000 r/min 4 ℃离心30 min, 以700 mL/L乙醇洗沉淀物. 真空干燥, 加20 uL水稀释.处理后的DNA行潮式PCR, 基因bank号AB006445, 引物序列循环1为: 正义5'-TGT TTA GAA AGA AAA AGG GA-3'; 反义5'-AAA CCT CCT CAC CTC CT-3'. 循环2为: 正义5'-AAA TAT TGG GAG GAG GAG GA-3'; 反义5'-ACC CAC TAA ACT ATT TCC CA-3'. 产物片断357 bp, 位于第一外显子上游启动子-32~-388. 两次PCR反应体系均为: 3 L MgCl2 (25 mmoL/L), 2 L dNTP(2.5 mmoL/L), 10 pmoL上下游引物, 模板2 uL. 产物送上海申友生物科技公司测序.
| Gene | 正义引物 (5'→3') | 反义引物(5'→3') | 探针 |
| β-actin | CTG GCA CCC AGC ACA GAT | GGA CAG CGA GGC CGA ATG | ATC ATT GCT CCT CCT GAG |
| Dnmt1 | GCA CCT CAT TTG CCG AAT ACA | TCT CCT GCA TCA GCC CAA ATA | AGT CCC GAG TAT GCG C |
| HMSH2 | ATC CAA GGA GAA TGA TTG GTA TTT G | CAA AGA GAA TGT CTT CAA ACT GAG AGA | CAT ATA AGG CTT CTC CTG GC |
统计学处理t检验, x2检验, 相关分析法.
定量RT-PCR反应良好, 扩增符合要求. 28例胃癌组织中有9例(32%)Dnmt1高表达, 10例(36%)不同程度的低表达; 癌组织平均Dnmt1为5.08±10.11, 明显高于正常组织均值1(P = 0.04). hMSH2 10例(35.7%)低表达, 3例(10.7%)高表达, 其余无明显变化.癌组织平均hMSH2为1.86±3.01, 与正常组织无明显差异(P = 0.14). 在mRNA表达水平上, Dnmt1与hMSH2无显著相关性(P = 0.53).
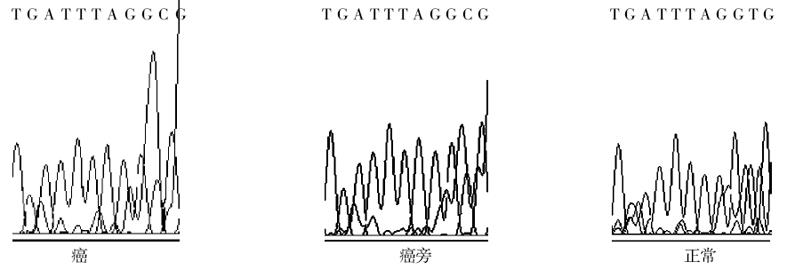
将10例hMSH2 mRNA低表达的样品DNA进行测序, 分析其启动子区甲基化情况. 用亚硫酸氢钠测序法可以检测到其中2例存在癌组织DNA启动子区的高甲基化.测序结果见图1. 正常组织中单链DNA CpG中的未甲基化的胞嘧啶已被亚硫酸氢钠脱氨基而变成U, U经PCR扩增后被T代替; 反之, 在癌和癌旁组织相应的甲基化序列中, CpG二核苷酸中的胞嘧啶保持不变, 说明他们因甲基化而未被亚硫酸氢盐修饰, 而CpG二核苷酸以外的胞嘧啶由于未被甲基化, 都变成T(U).
不但如我们前文所述[4]Dnmt1转录水平与胃癌生物学行为不明确关系, 且hMSH2基因mRNA表达与肿瘤大小、淋巴结转移、组织学类型均无明显相关性.
基因不稳在胃癌的发生中起重要作用.这种基因不稳可以分为二种不同的形式, 即染色体不稳和微卫星不稳.hMLH1和hMSH2是错配修复基因系统中最重要的成员.胃癌hMLH1突变均发生在MSI阳性的癌组织, 但相当一部分MSI阳性胃癌组织并未发现hMLH1和hMSH2基因的突变, 因此可能有其他机制参与了这种缺陷. 目前认为肿瘤发生过程中导致hMLH1失活的另一重要方式为DNA甲基化的改变, 这种改变可引起hMLH1表达的丢失[5]. Dnmt1是体内最重要的DNA甲基化酶, 他能维持DNA的甲基化修饰. 在癌细胞中, Dnmt1基因表达升高往往先于高甲基化改变, 一般认为Dnmt1活性升高是癌组织的一个具有特征的早期分子改变. 很多肿瘤组织存在着不同程度的Dnmt1高表达[6-7]. 但目前对于DNA甲基化是否能引起hMSH2表达缺失仍有异议[8-9].
我们发现32%的胃癌组织存在Dnmt1的高表达, 癌区Dnmt1的表达均值显著高于正常黏膜区(P = 0.04); Dnmt1的表达与肿瘤大小、淋巴结转移、组织学类型均无明显相关性. 这一结果与日本学者得到的结论相近[10]. 同时, 我们还发现胃癌组织中的Dnmt1高表达以及DNA甲基化在一定程度上参与了hMSH2基因表达的缺失. 我们同时发现这两例存在hMSH2癌组织启动子高甲基化的病例其Dnmt1在mRNA的表达上并无明显变化, 我们猜测Dnmt1可能通过影响hMLH1而非hMSH2的甲基化状态, 从而导致微卫星不稳定, 并进一步参与了肿瘤的进程. 在本次实验中我们没有观察到Dnmt1和hMSH2与肿瘤各种生物学行为之间有相关性. 我们拟进一步研究DNA甲基化与微卫星不稳定之间的关系.
编辑: N/A
| 1. | Tang R, Changchien CR, Wu MC, Fan CW, Liu KW, Chen JS, Chien HT, Hsieh LL. Colorectal cancer without high microsatellite instability and chromosomal instability--an alternative genetic pathway to human colorectal cancer. Carcinogenesis. 2004;25:841-846. [PubMed] [DOI] |
| 2. | Fang DC, Wang RQ, Yang SM, Yang JM, Liu HF, Peng GY, Xiao TL, Luo YH. Mutation and methylation of hMLH1 in gastric carcinomas with microsatellite instability. World J Gastroenterol. 2003;9:655-659. [PubMed] [DOI] |
| 3. | Kang GH, Lee S, Shim YH, Kim JC, Ro JY. Profile of methylated CpG sites of hMLH1 promoter in primary gastric carcinoma with microsatellite instability. Pathol Int. 2002;52:764-768. [PubMed] [DOI] |
| 4. | 程 中华, 房 静远, 杨 丽, 陈 萦, 陆 嵘, 陆 娟, 朱 红音, 顾 伟齐. 人胃癌组织DNA甲基化酶、去甲基化酶与肿瘤相关基因的表达. 中华消化杂志. 2004;24:203-206. |
| 5. | Sakata K, Tamura G, Endoh Y, Ohmura K, Ogata S, Motoyama T. Hypermethylation of the hMLH1 gene promoter in solitary and multiple gastric cancers with microsatellite instability. Br J Cancer. 2002;86:564-567. [PubMed] [DOI] |
| 6. | Girault I, Tozlu S, Lidereau R, Bièche I. Expression analysis of DNA methyltransferases 1, 3A, and 3B in sporadic breast carcinomas. Clin Cancer Res. 2003;9:4415-4422. [PubMed] |
| 7. | Sato M, Horio Y, Sekido Y, Minna JD, Shimokata K, Hasegawa Y. The expression of DNA methyltransferases and methyl-CpG-binding proteins is not associated with the methylation status of p14(ARF), p16(INK4a) and RASSF1A in human lung cancer cell lines. Oncogene. 2002;21:4822-4829. [PubMed] [DOI] |
| 8. | Kim HC, Kim CN, Yu CS, Roh SA, Kim JC. Methylation of the hMLH1 and hMSH2 promoter in early-onset sporadic colorectal carcinomas with microsatellite instability. Int J Colorectal Dis. 2003;18:196-202. [PubMed] |
| 9. | Saito T, Oda Y, Kawaguchi K, Takahira T, Yamamoto H, Sakamoto A, Tamiya S, Iwamoto Y, Tsuneyoshi M. Possible association between tumor-suppressor gene mutations and hMSH2/hMLH1 inactivation in alveolar soft part sarcoma. Hum Pathol. 2003;34:841-849. [PubMed] [DOI] |
| 10. | Kanai Y, Ushijima S, Kondo Y, Nakanishi Y, Hirohashi S. DNA methyltransferase expression and DNA methylation of CPG islands and peri-centromeric satellite regions in human colorectal and stomach cancers. Int J Cancer. 2001;91:205-212. [PubMed] [DOI] |