修回日期: 2004-04-26
接受日期: 2004-05-09
在线出版日期: 2004-07-15
目的: 通过观察门脉高压症患者脾动脉和脾静脉的病理学改变和门静脉高压时其血管内皮细胞eNOS, ET-1, PKC, NF-κB的表达以及Ⅰ, Ⅲ型前胶原mRNA在门脉高压症时脾静脉壁的表达, 从而探讨门静脉局部内皮源性血管活性物质异常与内皮细胞应力信号转导通路激活的关系和细胞外基质在门脉高压性血管病变发生中的作用以及门脉高压症、内脏高动力循环和门脉高压性内脏血管病变三者之间的相互关系.
方法: 采用光镜和电镜方法观察20例门脉高压症患者和10例正常对照组的脾动脉和脾静脉的形态学改变; 用免疫组化和免疫荧光激光扫描共聚焦显微镜技术检测20例门静脉高压症患者脾静脉和15只门静脉高压大鼠模型门静脉内皮细胞eNOS, ET-1, PKC, NF-κB的表达, 探讨门静脉高压时其血管内皮细胞eNOS, ET-1表达改变与信息分子PKC, NF-κB的关系; 用逆转录聚合酶链反应检测Ⅰ、Ⅲ型前胶原mRNA 在20例门静脉高压症患者脾静脉壁的表达.
结果: 光镜下可见脾动脉内膜破损, 内弹性膜和弹力纤维断裂和变性; 脾静脉内膜局灶性增厚, 内皮细胞不完整, 附壁血栓形成, 中膜平滑肌显著增厚, 纤维结缔组织明显增多. 电镜下可见脾动脉平滑肌细胞变性, 坏死, 表型从收缩型向合成型转化, 红细胞、血小板聚集在破损内皮周围; 脾静脉血管平滑肌细胞以合成型为主, 其胞质中含有丰富的粗面内质网和高尔基体, 整个管壁沉积有大量胶原纤维, 并排列紊乱, 内膜损伤, 血液有形成分聚集, 内皮表面形态不规则, 凹凸不平. PKC的阳性表达见于细胞的胞质、胞膜. 门静脉高压患者脾静脉和实验组大鼠模型门静脉内皮细胞PKC表达呈阳性或强阳性, 其血管平滑肌细胞也可见阳性信号. 对照组则呈阴性或弱阳性表达. eNOS, ET-1与NF-κB双重免疫荧光标记的激光扫描共聚焦显微镜检测显示荧光定位均主要在血管内皮, 三者在门静脉高压症患者脾静脉和实验组大鼠模型门静脉内皮的荧光信号强度均显著高于对照组. 门静脉高压症患者脾静脉壁Ⅰ型前胶原mRNA表达强度与非门脉高压症患者无显著性差异(P>0.05); 门静脉高压症患者脾静脉壁Ⅲ型前胶原mRNA表达强度明显高于非门脉高压症患者(P<0.01).
结论: 门静脉高压时其血管内皮细胞ET-1和eNOS表达上调与该通路激活有关. Ⅲ型前胶原及胶原可能是门静脉高压症时导致血管构型改建的重要细胞外基质, 门脉高压症时合并有脾动脉和脾静脉病变, 门脉高压症和内脏高动力循环以及内脏血管病变之间互为因果关系.
引文著录: 李涛, 李海洋, 张彤, 倪吉元, 杨镇. 门脉高压症脾血管病变的研究. 世界华人消化杂志 2004; 12(7): 1616-1622
Revised: April 26, 2004
Accepted: May 9, 2004
Published online: July 15, 2004
AIM: To investigate the relationship among portal hyper-tension, splanchnic hyperdynamic disturbances and splanchnic angiopathy by observing splenic arterial and venous pathological changes, to discuss the relationship between the abnormal local endothelium-derived vasoactive substances in portal veins and the activation of the pathway of mechanical force signal transduction in vascular endothelial cells by investigating the expression of eNOS ET-1 PKC NF-κB in vascular endothelial cells of portal hypertension, and to explore the role of extracellular matrix in the pathogenesis of portal hypertensive angiopathy by detecting the expression of type I and type II procollagen mRNA in splenic vein of portal hypertensive patients.
METHODS: Splenic arteries, veins from portal hypertensive patients (n = 20) and normal people (n = 10) were removed and observed under optical and electron microscopes. Immunohistochemistry and double labeling immunofluorescence combined with laser scanning confocal microscope were used to investigate the expression of eNOS ET-1 NF-κB and PKC protein in endothelial cells of splenic veins from portal hypertensive patients (n = 20) and portal veins from Wistar rats (n = 15). Total RNA was extracted and type I and type II procollagen mRNAs in splenic vein of portal hypertensive patients (n = 20) were examined by using the method of reverse transcriptional polymerase chain reaction with semiquantitative method.
RESULTS: The endothelium of splenic arteries was damaged and the internal elastic membrane and medial elastic fibers of the splenic artery wall were broken and degenerated. The endothelium of splenic veins was remarkably thickened and endothelial cells integrated with the formation of mural thrombus. The tunica media thickened significantly because of hypertrophy of smooth muscle. Fiber and connective tissues increased in amount. Under the electron microscope, atrophy, apoptosis and phenotypic changes were seen in smooth muscle cells of splenic arteries. There were some red blood cells and pathelets congregation around the damaged endothelium. Synthesis type of smooth muscle cells accounted for a large part of the total cells in splenic veins. There were plentiful rough endoplasmic reticulum and Golgi complex within the cytoplasm of smooth muscle cells. The endothelium of splenic veins was damaged, indicating that a lot of collagen fibers and some blood components accumulating around the damaged endotheliun.The positive signal of PKC was observed in cytoplasm and cell membrane.The PKC expression in endothelial cells in the splenic/portal vein of portal hypertensive patients/rats showed positive or strong positive signal, and positive signal were also observed in some smooth muscle cells in these specimens. But the PKC expression in endothelial cells in the control groups was negative or mild positive.The result of eNOS, ET-1 and NF-κB expression examined by double labeling immunofluorescence combined with laser scanning confocal microscope showed that the fluorescence were mostly localized in the endothelium of vessel. The intensity of fluorescence in the portal hypertensive patients/rats were significantly higher than that in control group. Human I procollagen mRNA expression of portal hypertensive patients in splenic vein showed a in-significant pattern with control group (P > 0.05), however, human III procollagen mRNA expression in portal hypertensive patients were much higher than that of control group (P < 0.01).
CONCLUSION: In this study, the mechanical signal pathway of endothelial cell is activated in portal hypertension and the upregulation of ET-1 and eNOS are related with the activation of this pathway. Type III procollagen and collagen may be one of the major extracellular matrix which deposits and results in neointimal formation and vascular remodeling in the pathogenesis of portal hypertensive vasopathy. Our research also shows that pathological changes of splenic arteries and veins are accompanied with portal hypertension. There may be an interactive relationship among portal hypertension, splanchnic hyperdynamic disturbances and splanchnic angiopathy.
- Citation: Li T, Li HY, Zhang T, Ni JY, Yang Z. Splenic angiopathy in portal hypertension. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1616-1622
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1616.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1616
随着门静脉压力的升高, 内脏血管可发生明显的病理改变, 如广泛的门体交通支形成和内脏大动脉、静脉的构型改建等, 称为门静脉高压性血管病变, 他既是内脏血管对高动力循环状态的适应与代偿, 又可加剧门静脉高血压, 同时也是曲张静脉破裂出血的直接原因之一[1-2]. 我们采用光镜和电镜的方法对门脉高压症患者的内脏血管进行观察, 以探讨门脉高压症和内脏高动力循环以及内脏血管病变之间的相互关系; 采用免疫组化和免疫荧光激光扫描共聚焦显微镜技术检测门静脉高压症患者脾静脉和门静脉高压大鼠模型门静脉内皮细胞eNOS, ET-1, PKC, NF-κB的表达, 探讨门静脉高压时其血管内皮细胞eNOS, ET-1表达改变与信息分子PKC, NF-κB的关系; 用逆转录聚合酶链反应检测Ⅰ, Ⅲ型前胶原mRNA 在门静脉高压症患者脾静脉壁的表达, 探讨其在门脉高压性血管病变发生中的作用及意义如下.
2002-06/2002-10在同济医院肝脏外科中心和蔡甸区血防所门脉高压症患者20例, 男15例, 女5例, 平均年龄41岁. 肝功能ChildA级14例, B级6例. 内镜检查均有中度或重度食管胃底静脉曲张, 并脾功能亢进和脾肿大. 病理证实血吸虫肝纤维化12例, 肝炎后肝硬化8例. 有1次或多次上消化道大出血病史8例. 行单纯脾切除术12例, 行脾切除加贲门周围血管离断术8例. 对照组为10例无肝硬化的外伤性脾破裂患者, 男6例, 女4例, 平均年龄38岁, 均行急诊脾切除术. 术中均取脾门附近的一段脾动脉和脾静脉. 雄性Wistar大鼠, 质量180-220 g, 构自本校实验动物中心. 共25只, 随机分为门静脉高压组(实验组, 15只)和对照组, 10只). 参照Benoit et al (Am J Physiol 1984; 247: G485)介绍的方法, 采用门静脉部分结扎制作大鼠门静脉高压模型, 术后2 wk处死尚存活的动物(实验组12只, 对照组10只), 可见实验组大鼠门静脉系统血管较对照组明显增多、增粗, 取门静脉主干约1 cm. eNOS, ET-1, 多克隆兔抗及NF-κB单克隆鼠抗、荧光素FITC、Cy3购自武汉博士德生物工程有限公司, PKC检测试剂盒购于北京中山公司, 共聚焦激光扫描显微镜为德国Leica TCS-SP. PCR仪: 美国PTC-200型, MJ Research Inc公司生产; UVP凝胶成像分分析系统: 英国UVP公司生产; M-MLV逆转录酶, Oligo(dT)15 Primer, DNTP, TaqNA聚合酶, 美国Promega公司生产; PCR Marker: 大连宝生物工程公司生产.
1.2.1 光镜和电镜观察: 血管标本用40 g/L中性缓冲甲醛固定后常规石蜡包埋连续切片(5 μm厚)HE染色, 光学显微镜(Olympus)下观察. 将新鲜血管标本切成1 mm3 1 min内置于25 mg/L戊二醛作前固定2 h, pH7.4磷酸缓冲液冲洗, 再以10 g/L锇酸在4 ℃作后固定2 h, 然后用递增浓度的酒精和丙酮脱水, 环氧树脂Epon812包埋, 切成超薄切片, 铅铀(醋酸-铀-柠檬酸铅)双染, OPTON EM 10C型透射电镜(德国产)观察. 另酒精脱水后, 临界点干燥, 真空喷镀, 置于日立S-520型扫描电镜观察并拍照.
1.2.2 免疫组化染色: (1)切片常规脱蜡至水, 蒸馏水新鲜配制30 mL/L H2O2, 室温10 min以灭活内源性过氧化物酶, 蒸馏水洗3次, 滴加正常山羊血清封闭液, 室温30 min, 减少非特异性背景染色. 甩去多余液体, 不洗. 滴加一抗(1: 100), 4 ℃过夜, 0.1 moL/L PBS洗5 min×3次. 滴加生物素化二抗, 37 ℃ 30 min, 0.1 moL/L PBS洗5min×3次. 滴加试剂SABC, 37 ℃30 min, 0.1 moL/L PBS洗5 min×4次. DAB显色: 使用DAB显色试剂盒. 取蒸馏水1 mL, 加试剂盒中A, B, C试剂各一滴, 混匀后加至切片. 室温显色, 镜下控制反应时间3-10 min, 蒸馏水洗涤. 苏木素轻度复染. 脱水, 透明, 封片. 显微镜下观察. 以PBS替代一抗作为阴性对照, 以已知阳性片作为阳性对照. PKC阳性呈棕黄色, 定位于细胞质中. 光镜下选取内皮细胞区域输入HPIAS-1000医学彩色全自动图像分析系统分析, 结果用平均吸光度表示. (2)另滴加一抗 NF-κB(1: 100)+eNOS / ET-1(1: 100), 4 ℃过夜, 0.1 moL/L PBS洗5 min×3次. 滴加生物素化鼠IgG+FITC(1: 50), 37 ℃ 25 min, 0.1 moL/L PBS洗5 min×3次. 滴加生物素化兔IgG+Cy3(1: 50), 37 ℃ 25 min, 0.1 moL/L PBS洗5 min×4次. 水溶性封片剂封片, 共聚焦显微镜下观察. 我们用488 nm波长的蓝色激光激发FITC, 在510-530 nm下接收, 此时FITC发出绿色荧光; 用568 nm波长的绿色激光激发Cy3, 在600-650 nm下接收, 此时Cy3发出红色荧光. 观察时先在光镜下找到待检区域, 然后分别激发FITC和Cy3, 检测内皮细胞区域的荧光分布和强度, 其中绿色荧光的分布和强度反映NF-κB的定位和表达强度, 红色荧光则反映eNOS / ET-1的表达情况, 结果以单位面积的平均荧光强度表示.
1.2.3Ⅰ, Ⅲ型前胶原mRNA的表达: (1) RT-PCR引物采用Primer Primer5.0版本设计, 人(1)I型前胶原(Genbank Z-74615): 上游引物5'-ACCGCAAACCTTTCTACTTC-3'.下游引物5'-GGT5GTCTGTCTCCCCTCACTC-3'. 产物长度465 bp.人(1)III型前胶原(GenbankX-14420)上游引物5'-TGAAGGGGCAGGGAACAAC-3'.下游引物5'-AAGGCGAGTAGGAGCAGT-3'. 产物长度384 bp. 人GAPDH (Genbankm 33197)作为看家基因内参照. 上游引物5'-GGATTTGGTCGTATTGGG-3'.下游引物5'- GGAAGAGGTGATGGGATT-3'. 产物长度384 bp. 脾静脉组织总RNA提取采用Trizol一步法提取: 从-80 ℃冰箱中取出组织, 解冻; 切取约100 mg组织置平皿中剪碎; 将组织转入匀浆器中, 加入Trizol试剂1 mL, 研磨匀浆; 将匀浆的组织转入1.5 mL EP管, 超声粉碎5 s×4次; 加入氯仿0.2 mL, 剧烈振荡15 s, 静置5 min; 12 000 g 2-8 ℃离心15 min; 取上层水相, 约0.6 mL, 加入异丙醇0.5 mL, 静置10 min; 12 000 g 2-8 ℃离心5 min, 弃上清, 加入DEPC水处理的75%乙醇1 mL; 7 500 g 2-8 ℃离心5 min, 弃乙醇, 室温放置5-10 min至即将干燥; 加入DEPC处理水50 mL, 溶解RNA, 60 ℃温育10 min. RNA定量, 以上操作均在冰上进行. 每分样品取总RNA 5 mg, 加入Oligo(dT) 15 μL(1 μg), 补足DEPC水至27 μL, 70 ℃温育5 min变性. 变性后加入5×Buffer 8 μL, 4×dNTP 2 μL, RNA酶抑制剂 1 μL, MMLV 2 μL (400 U). 总体积40 μL进行42 ℃ 1 h逆转录反应, 再经过95 ℃ 5 min 变性. PCR 反应体系: 10×Buffer 5 μL, 25 mM MgCl2 3 μL, 4×dNTP 1 μL (10 Pmol/mL原液), 上游引物1 μL(10 Pmol/mL原液)下游引物1 L(10 Pmol/mL原液), cDNA 5 μL, Taq酶 1 μL (3 u/μL), DEPC处理水 33 μL, 总体积 50 μL, 反应条件(1)I型前胶原: 退火温度55 ℃, 30循环; (1)III型前胶原: 退火温度52 ℃, 30循环; GAPDH: 退火温度51 ℃, 30循环. 取PCR扩增产物10 mL加样于15 g/L琼脂糖凝胶, 电泳缓冲液为新鲜配制的TAE液, 电压为5 V/cm, 紫外灯下观察结果. 每一份标本重复实验3次. 采用英国UVP凝胶成像分析系统对PCR产物电泳条带进行密度分析, 目的基因表达强度=目的基因RT-PCR产物吸光度÷GAPDH RT-PCR产物吸光度.
统计学处理 所有数据均以均数±标准差(mean±SD) 表示, 采用SPSS 11.0统计分析软件, 经方差齐性检验后, 用单因素方差分析(ANOVA)和t检验进行分析, aP<0.05被认为具有统计学意义.
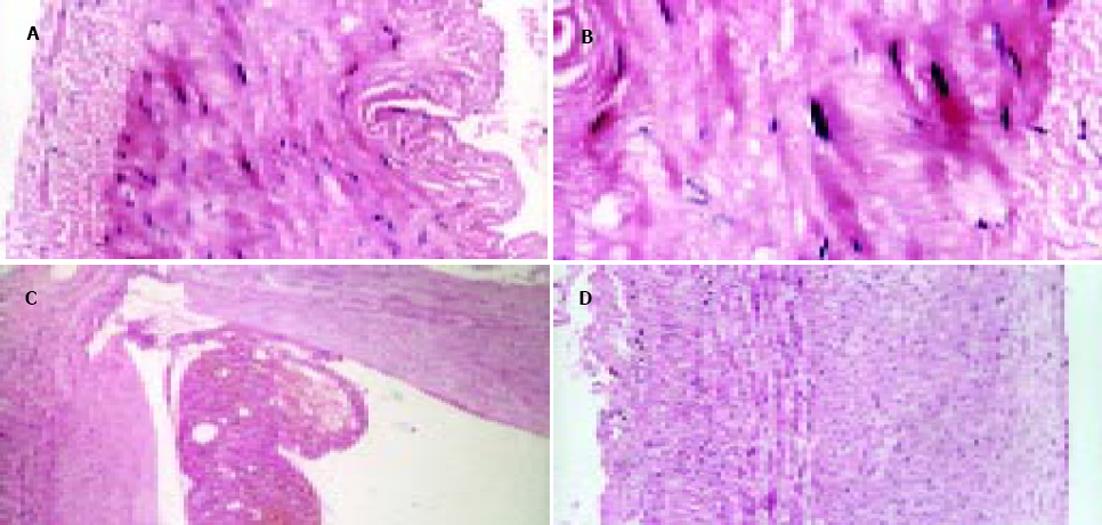
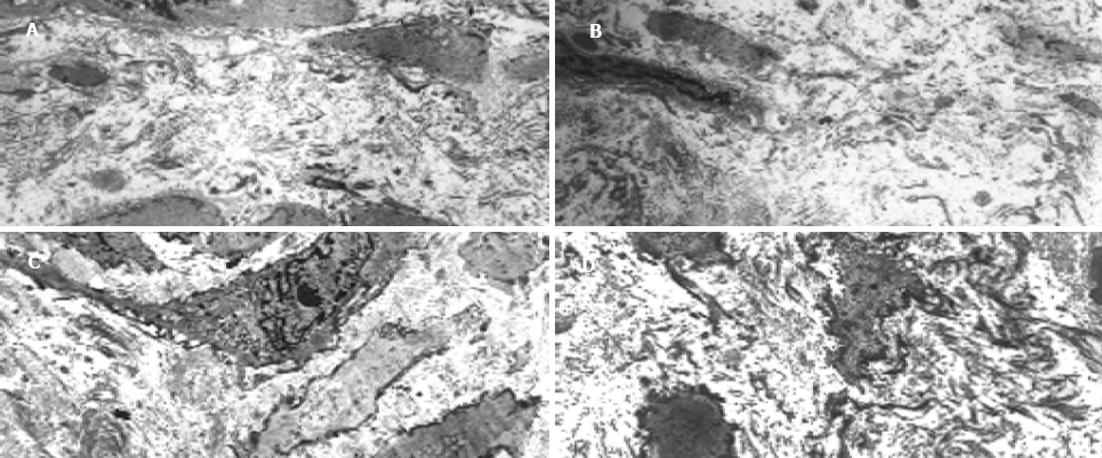
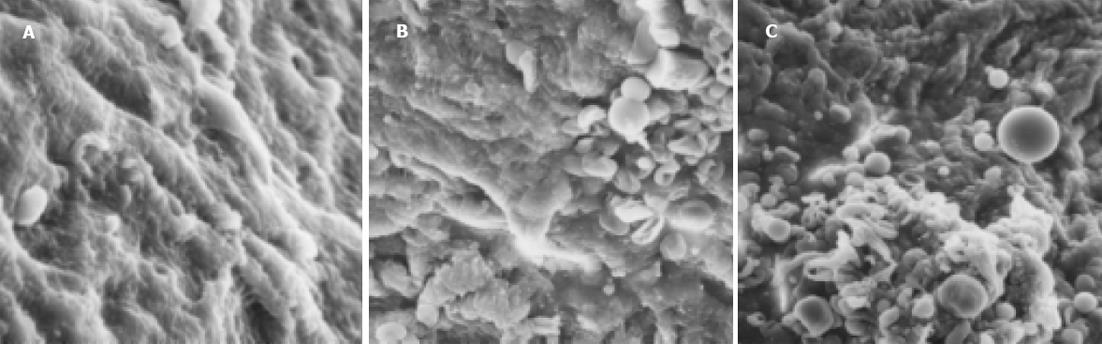
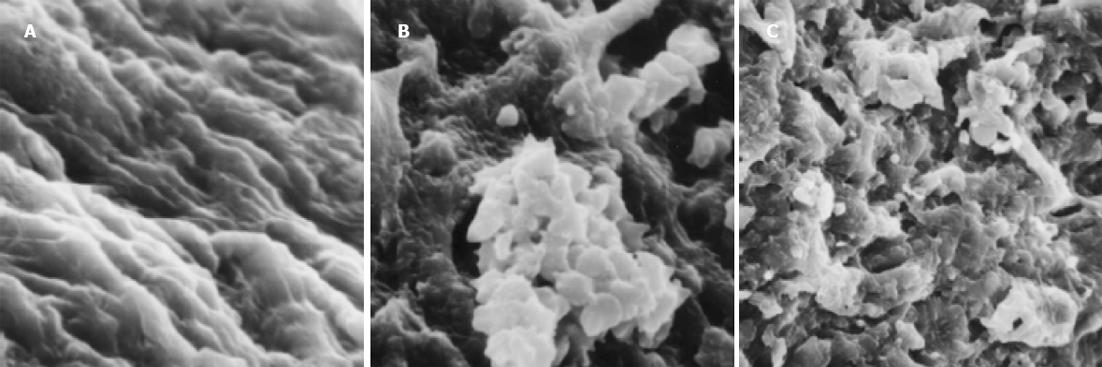
与非肝硬化患者相比, 肝硬化患者脾脏明显增大, 脾动脉壁和脾静脉壁明显增厚, 管径明显增加, 弹性减弱. 光镜下正常脾动脉壁内膜光滑, 有完整的内皮细胞, 内膜下无平滑肌细胞. 中膜由多层平滑肌纤维组成, 其间夹杂有胶原纤维和弹性纤维. 肝硬化患者脾动脉的内膜明显增厚, 内皮细胞不完整, 内弹力膜断裂, 中膜平滑肌紊乱(图1A, B). 正常脾静脉内膜完整, 内皮细胞无破坏, 肝硬化患者脾静脉内膜局灶性增厚, 内皮细胞不完整, 内膜损伤, 附壁血栓形成(图1C, D). 透射电镜下正常脾动脉平滑肌细胞呈梭形, 细胞核呈长圆形. 胞质中有肌丝、线粒体、内质网、高尔基复合体等细胞器和糖原颗粒. 肝硬化患者脾动脉内皮损伤, 内弹性膜断裂, 弹性纤维亦有断裂. 中膜平滑肌细胞数量增多, 并迁移至内膜下, 部分萎缩、变性, 局部胞质坏死形成空泡. 线粒体数目增多, 嵴消失, 形成空泡. 整个管壁内胶原纤维明显增多并排列紊乱. 部分肌细胞胞质内出现较多粗面内质网、核糖体及高尔基体, 而肌丝减少, 表明平滑肌细胞由收缩型向合成型转变(图2A, B). 正常脾静脉内膜光滑, 内皮细胞无破坏, 肝硬化患者脾静脉壁内膜损伤, 血管平滑肌细胞以合成型为主, 其胞质中含有丰富的粗面内质网和高尔基体, 整个管壁沉积有大量胶原纤维, 并排列紊乱(图2C, D). 扫描电镜下正常脾静脉内膜光滑, 有完整的内皮细胞(图3A), 肝硬化患者脾静脉内膜损伤, 内皮细胞不完整, 血液有形成分聚集, 内皮表面形态不规则, 凹凸不平(图3B, C). 正常脾动脉内膜完整, 内皮细胞无破坏(图4A), 肝硬化患者脾动脉内膜损伤, 红细胞、血小板聚集在损伤部位周围(图4B, C).
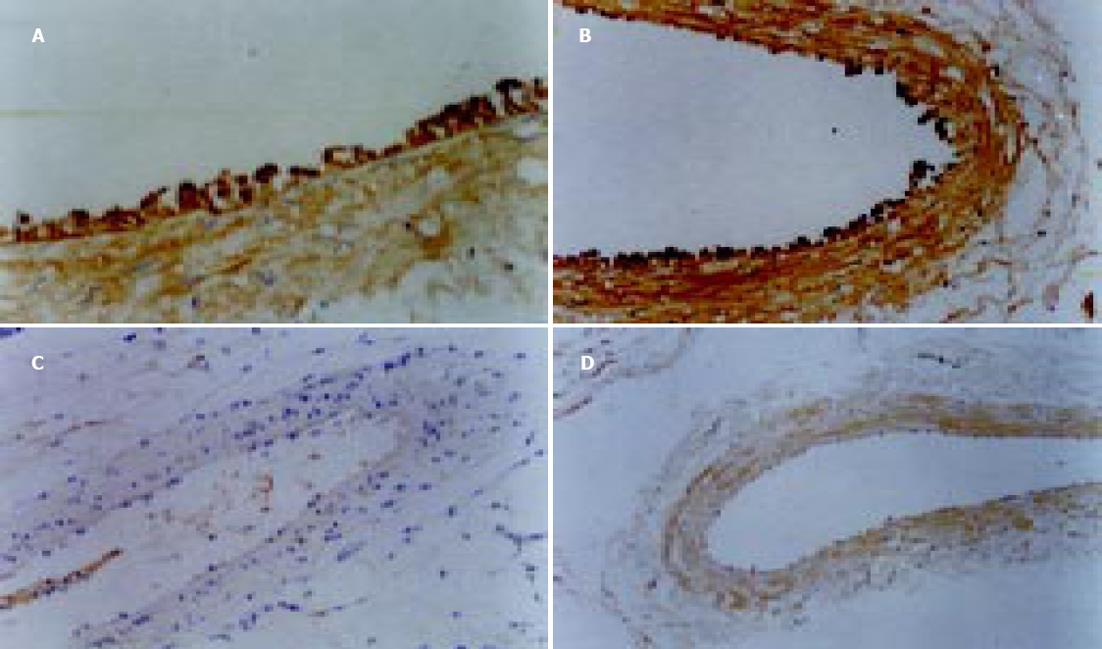
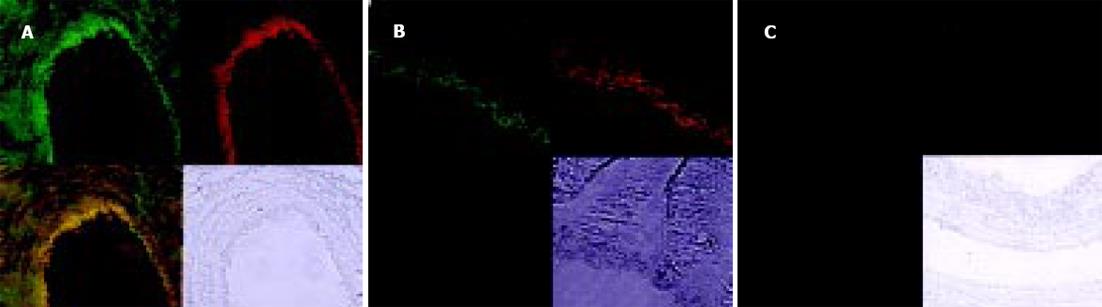
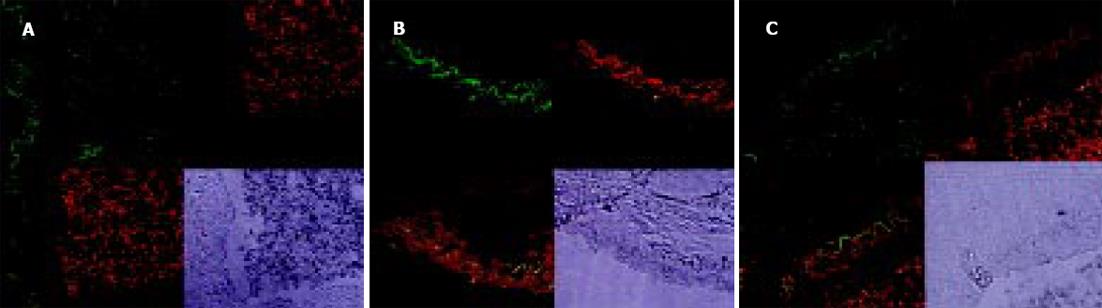
PKC的阳性表达见于细胞的胞质、胞膜. 门静脉高压患者脾静脉和实验组大鼠模型门静脉内皮细胞PKC表达呈阳性或强阳性(图5A, B), 其血管平滑肌细胞也可见阳性信号. 对照组则呈阴性或弱阳性表达(图5C, D). eNOS、ET-1与NF-κB的荧光定位均主要在血管内皮, 三者在门静脉高压患者脾静脉和实验组大鼠模型门静脉内皮的荧光信号强度均显著高于对照组(图6A-C; 图7A-C; 表1).
| 分组 | n | ENOS | ET-1 | NF-κB |
| 患者门脉高压组 | 18 | 95.6±28.3 | 107.4±30.1 | 90.1±31 |
| 对照组 | 10 | 57.9±27.4 | 56.4±18.9 | 48.4±19.3 |
| 分组 | ||||
| 大鼠门脉高压组 | 12 | 88.7±28.5 | 91.0±32.5 | 90.3±32.9 |
| 对照组 | 10 | 50.9±16.5 | 51.1±19.0 | 48.1±19.1 |
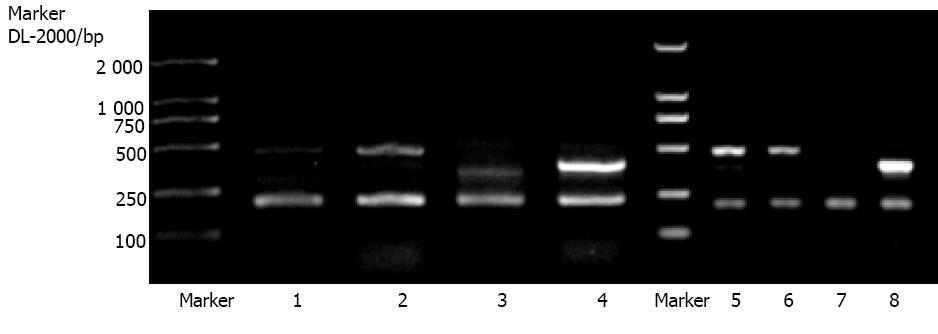
门脉高压症患者脾静脉壁Ⅰ型前胶原mRNA表达强度为0.3 868±0.03 582, 非门脉高压症患者为0.3 642±0.03 318, 二组间差异无显著性(P>0.05)(图6B).门脉高压症患者脾静脉壁Ⅲ型前胶原mRNA表达强度为1.1 855±0.2 140, 非门脉高压症患者为0.1 095±0.1 558, 门脉高压症时脾静脉壁Ⅲ型前胶原表达明显增高(P<0.01 图8).
门脉高压症脾静脉内膜损伤较重, 这是由于门脉压力和血流量增高的结果. TCM表明, 平滑肌细胞的表型发生转变, 因为在损伤因子如细胞因子[3-4]、生长因子[5]、剪切力[6-7]、氧应激[8]增加等作用下, VSMC可由正常的收缩型转变为合成型[9-10], 合成型VSMC的收缩蛋白表达受抑制, 而产生大量细胞外基质(ECM), 并向内膜下迁移. 光镜下可见中膜平滑肌增厚, 这是血管对压力增高的一种适应性代偿反应, 脾动脉中膜平滑肌细胞变性、萎缩, 表型从收缩型向合成型转变, 是因为压力和流量负荷增加压迫管壁滋养血管而引起供血不足, 造成血管壁缺血性损伤所致. 扫描电镜下可见脾动脉内膜的损伤, 但其损伤程度较静脉轻, 这主要是由于门静脉系统直接最先受累的缘故. 另外, 光镜下可见脾动脉的内弹力膜断裂, 这是由于门脉高压症时内脏处于高动力循环状态, 血流量及流速增加, 对血管壁的侧压力及切应力增大, 血管长期处于充血扩张状态, 这种机械、物理刺激引起内皮细胞脱落, 弹力膜断裂. 内弹力膜断裂使血管壁缓冲血流冲击能力下降, 当血流量增大时, 无法通过弹力膜的作用收缩血管, 调节血流量, 有利于高动力循环的发展.
eNOS, ET-1阳性信号主要位于血管内皮细胞, 而PKC和NF-κB除在内皮细胞上表达外, 在血管平滑肌细胞也有一定程度的表达. 门静脉高压症患者和大鼠模型其脾/门静脉血管内皮细胞ET-1表达显著高于对照组, 提示门静脉系统血管内皮细胞ET-1的合成增多是导致门静脉高压局部ET-1浓度增高的重要因素. ET-1通过与其特异性受体结合发挥强大的缩血管作用, 使门静脉回流阻力增加而进一步增高门静脉压力. 对门静脉高压时ET-1合成增多的原因国内外已有研究. 我们认为, 除了内毒素和各种细胞因子的作用外, 这种血流动力学的改变可能是刺激内皮细胞ET-1合成增多的重要因素之一. 我们以内皮细胞为对象, 探讨其eNOS的表达变化与门静脉高压的关系. 结果表明, 门静脉高压患者和大鼠其脾/门静脉内皮细胞 eNOS表达均显著高于对照组, 提示门静脉高压时局部NO的增高与其内皮细胞eNOSmRNA表达的上调有密切关系. PKC是重要的细胞内信号传导分子, NF-κB是内皮细胞上可被机械力激活的主要转录因子之一, 参与许多基因的表达调控, 本结果表明, 在门脉高压患者和大鼠, 其脾/门静脉内皮细胞PKC、NF-κB的表达显著高于对照组, 因此我们认为在门静脉高压时, 门静脉血流动力学的改变可激活局部内皮细胞的PKC、NF-κB信号传导通路.
胶原纤维是一种重要的血管细胞外基质蛋白, 可保持血管壁的韧性与强度. 本结果表明, 门脉高压症时脾静脉壁Ⅲ型前胶原mRNA表达较非门脉高压症患者增高约5-6倍(bP<0.01), 而Ⅰ型前胶原mRNA表达与非门脉高压症患者相比差异无显著性(P>0.05), 我们认为Ⅲ型前胶原mRNA在门脉高压症脾静脉壁的高表达, 可能是促进血管构型改建的一个重要因素. 关于I, III型前胶原基因表达调控过程, 目前并不十分清楚. 已发现有多种因子可促进VSMC上调I, III型前胶原mRNA的表达, 如FGF[11], Ang-II[12]等, 综上所述, 门静脉血中ET-1和NO的增高是由于门静脉系统内皮细胞合成增多所致, 内皮细胞合成NO的增多与其eNOS表达上调有关. 门静脉高压时其血管内皮细胞的机械应力信号通路被激活, 内皮细胞ET-1和eNOS表达上调与该通路激活有关. Ⅲ型前胶原及胶原可能是门静脉高压症时导致血管构型改建的重要细胞外基质, 门脉高压症时合并有脾动脉和脾静脉病变, 肝硬化等导致的肝内血流受阻是门脉高压症形成的始动因素, 一方面, 门脉高压症可促进内脏高动力循环和内脏血管病变的形成和发展. 另一方面, 内脏血管病变又可促进门脉高压症和内脏高动力循环的形成与发展. 这三个因素在肝硬化门脉高压症的发病机制中具有相互作用的关系, 并共同参与形成曲张静脉破裂出血.
编辑: N/A
| 1. | Yang Z, Ren D, Li D, Qiu F. [Portal hypertensive vasculopathy of splenic artery]. Zhonghua Wai Ke Za Zhi. 1999;37:412-414. [PubMed] |
| 2. | Yang Z, Zhang L, Li D, Qiu F. Pathological morphology alteration of the splanchnic vascular wall in portal hypertensive patients. Chin Med J (Engl). 2002;115:559-562. [PubMed] |
| 3. | Jiang B, Xu S, Brecher P, Cohen RA. Growth factors enhance interleukin-1 beta-induced persistent activation of nuclear factor-kappa B in rat vascular smooth muscle cells. Arterioscler Thromb Vasc Biol. 2002;22:1811-1816. [PubMed] [DOI] |
| 4. | King KE, Iyemere VP, Weissberg PL, Shanahan CM. Krüppel-like factor 4 (KLF4/GKLF) is a target of bone morphogenetic proteins and transforming growth factor beta 1 in the regulation of vascular smooth muscle cell phenotype. J Biol Chem. 2003;278:11661-11669. [PubMed] [DOI] |
| 5. | Wu J, Cunnick JM. Trans-regulation of epidermal growth factor receptor by lysophosphatidic acid and G protein-coupled receptors. Biochim Biophys Acta. 2002;1582:100-106. [PubMed] [DOI] |
| 6. | Hosokawa H, Aiuchi S, Kambe T, Hagiwara Y, Kubo T. Mechanical stretch-induced mitogen-activated protein kinase activation is mediated via angiotensin and endothelin systems in vascular smooth muscle cells. Biol Pharm Bull. 2002;25:1588-1592. [PubMed] [DOI] |
| 7. | Standley PR, Cammarata A, Nolan BP, Purgason CT, Stanley MA. Cyclic stretch induces vascular smooth muscle cell alignment via NO signaling. Am J Physiol Heart Circ Physiol. 2002;283:H1907-H1914. [PubMed] [DOI] |
| 8. | Komai N, Morishita R, Yamada S, Oishi M, Iguchi S, Aoki M, Sasaki M, Sakurabayashi I, Higaki J, Ogihara T. Mitogenic activity of oxidized lipoprotein (a) on human vascular smooth muscle cells. Hypertension. 2002;40:310-314. [PubMed] [DOI] |
| 9. | Lincoln TM, Dey N, Sellak H. Invited review: cGMP-dependent protein kinase signaling mechanisms in smooth muscle: from the regulation of tone to gene expression. J Appl Physiol (1985). 2001;91:1421-1430. [PubMed] |
| 10. | Hayashi K, Takahashi M, Nishida W, Yoshida K, Ohkawa Y, Kitabatake A, Aoki J, Arai H, Sobue K. Phenotypic modulation of vascular smooth muscle cells induced by unsaturated lysophosphatidic acids. Circ Res. 2001;89:251-258. [PubMed] [DOI] |
| 11. | Pickering JG, Ford CM, Tang B, Chow LH. Coordinated effects of fibroblast growth factor-2 on expression of fibrillar collagens, matrix metalloproteinases, and tissue inhibitors of matrix metalloproteinases by human vascular smooth muscle cells. Evidence for repressed collagen production and activated degradative capacity. Arterioscler Thromb Vasc Biol. 1997;17:475-482. [PubMed] [DOI] |
| 12. | Touyz RM, He G, El Mabrouk M, Schiffrin EL. p38 Map kinase regulates vascular smooth muscle cell collagen synthesis by angiotensin II in SHR but not in WKY. Hypertension. 2001;37:574-580. [PubMed] [DOI] |