修回日期: 2004-04-10
接受日期: 2004-04-27
在线出版日期: 2004-07-15
目的: 研究HBV慢性感染患者血清HBV载量与外周血单个核细胞(PBMC)凋亡的关系.
方法: 无菌条件下分离42例HBV阳性患者及健康献血员10名外周血单个核细胞(PBMC), 在PHA的刺激下培养72 h后收集细胞. 采用脱氧核糖核酸末端标记方法 (terminal deoxyribonucleotidyl transferase-mediated biotinylated dUTP nick-end labeling, TUNEL)、流式细胞术(flow cytometry, FCM)检测HBV慢性感染患者PBMC凋亡, 并用HBV-PCR定量试剂盒检测血清HBV-DNA的含量. 对不同组的PBMC凋亡及血清HBV-DNA含量进行单因素方差分析, 并对凋亡情况及血清HBV-DNA含量进行相关性分析.
结果: TUNEL法与FCM检测HBV阳性患者PBMC, 证实PBMC存在凋亡, 慢性乙型肝炎轻度组、中度组与肝硬化组凋亡率明显升高分别为(29.3%±9.3%, 24.8%±10.8%, 28.8%±5.0%), 与健康对照(18.0%±6.4%)比较凋亡率显著升高(P<0.05). 血清HBV-DNA含量在慢性乙型肝炎轻度组最高(14.3×107cp/L±24.8×107cp/L), 与其他组比较病毒含量明显增高(P<0.05). HBV慢性感染患者血清病毒载量与其PBMC凋亡率有一定的相关性, r = 0.338, P = 0.014 (P<0.05).
结论: HBV慢性感染患者PBMC存在凋亡, 其凋亡率较健康组明显增加. 慢性乙型肝炎轻度患者血清病毒含量最高, 其凋亡率亦最高. 凋亡状况与乙型肝炎的慢性化、机体的免疫状态相关. HBV慢性感染患者PBMC凋亡与其血清病毒载量有相关性.
引文著录: 宋蕊, 王玉梅, 石理兰, 冯国和, 马力, 窦晓光. HBV慢性感染患者PBMC凋亡与血清病毒载量. 世界华人消化杂志 2004; 12(7): 1574-1577
Revised: April 10, 2004
Accepted: April 27, 2004
Published online: July 15, 2004
AIM: To investigate the relationship between the serum HBV DNA quantification and the PBMCs apoptosis of the chronic hepatitis B.
METHODS: Peripheral blood mononuclear cells (PBMCs) were isolated from 10 healthy blood donors and 42 patients with HBV positive. PBMCs were cultured with PHA for 72 h in vitro. Then we used TUNEL and flow cytometry to assay the apoptosis. The HBV-DNA extracted from the serum in patients by PCR was quantified by ELISA. We used the one way ANOVA to analysis the apoptosis and the HBV-DNA quantity, and made correlation analysis between the apoptosis and the HBV-DNA quantity.
RESULTS: We identified the apoptosis by TUNEL and flow cytometry in cultured PBMCs. The apoptosis rate in mild type of chronic hepatitis B, moderate type of chronic hepatitis B and cirrhosis were (29.3% ± 9.3%, 24.8% ± 10.8%, 28.8% ± 5.0%), compared to the healthy group (18.0% ± 6.4%). Serum HBV-DNA level was the highest in mild type of chronic hepatitis B (14.3×107 cp/L ± 24.8×107 cp/L), which was higher than other groups(P < 0.05). The serum HBV-DNA level in mild type of chronic hepatitis B is the highest. The serum HBV-DNA level had the correlation with the apoptosis in PBMC (r = 0.338, P = 0.014).
CONCLUSION: There is apoptosis in PBMC of the HBV chronic infections. The serum virus level is the highest in mild type of chronic hepatitis B, while its apoptosis is also the highest. The immune and HBV virus persistent condition are related to the apoptosis. The percentage of the apoptosis in PBMC has the correlation with the virus level in serum of the HBV chronic infections.
- Citation: Song R, Wang YM, Shi LL, Feng GH, Ma L, Dou XG. Relationship between PBMC apoptosis and serum HBV level in HBV positive patients. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1574-1577
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1574.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1574
乙型肝炎病毒(HBV)常导致慢性感染, 易发展为重型肝炎[1]. 其慢性化、重型化的机制均与机体的免疫功能异常密切相关, 这种异常是否与活化的淋巴细胞凋亡有关目前尚不完全清楚[2]. 目前认为, HBV本身对肝细胞无直接致病作用, 而HBV所致的免疫损伤可能是乙型肝炎重要的发病机制之一[3]. HBV为泛嗜性病毒, 在肝外组织细胞尤其是外周血单个核细胞(peripheral blood mononuclear cells, PBMC)中可以复制[4]. 有研究发现在PBMC中存在HBV的高度盘卷的cccDNA[5], 提示PBMC可以作为HBV转录和翻译的场所[6]. 我们采用脱氧核糖核酸末端标记方法 (terminal deoxyribonucleotidyl transferase-mediated biotinylated dUTP nick-end labeling, TUNEL)与流式细胞术(flow cytometry, FCM)检测PBMC的凋亡状态, 并采用HBV-DNA定量PCR检测试剂盒检测血清HBV-DNA 含量, 通过对PBMC凋亡的检测及患者血清HBV-DNA病毒量的检测, 探讨PBMC凋亡与HBV慢性感染患者血清HBV病毒载量的关系, 阐明PBMC凋亡在HBV慢性感染患者发病机制中的作用.
中国医科大学附属第二医院感染科HBV阳性患者42例, 健康对照10名, 男39例, 女13例, 年龄18-64岁(平均38岁). 诊断均符合2000年西安会议"病毒性肝炎防治方案"的诊断标准. 根据临床指标及症状分为5组, HBV携带者9例, 慢性乙型肝炎轻度组10例, 慢性乙型肝炎中度组8例, 慢性乙型肝炎重度组7例, 肝炎后肝硬化组(HBV阳性)8例. HBsAg及抗HBc-IgG均阳性, 排除HAV, HCV, HDV和HEV感染, 排除近3 mo应用糖皮质激素、干扰素等影响免疫功能药物的患者. 淋巴细胞分离液 (上海生化二厂)、RPMI 1640培养液及新生小牛血清(GIBCO公司)、植物血凝素(PHA)(广州生物制剂公司)、RNA酶(武汉博士德生物制品有限公司)、细胞凋亡检测试剂盒(cell death detection kit, POD)(武汉博士德生物制品有限公司)、PI染液(Sigma公司)、流式细胞仪(美国Beclon-Dickinson公司产品)、HBV-DNA定量PCR检测采用乙型肝炎病毒(HBV)核酸扩增(PCR)酶免疫定量(ELISA)试剂盒(上海浩源生物科技有限公司).
无菌抽取HBV阳性患者空腹静脉血8 mL, 肝素抗凝6 mL, 密度梯度离心法分离外周血单个核细胞, 分离血清2 mL. 应用HBV-DNA定量检测试剂盒检测血清HBV-DNA含量(方法按说明书). 用含10 mL/L新牛血清的RPMI-1640培养液稀释提取细胞成1×106/mL, 加入PHA 100 g, 37 ℃, 50 mL/L CO2培养箱温育72 h, 收取培养细胞.
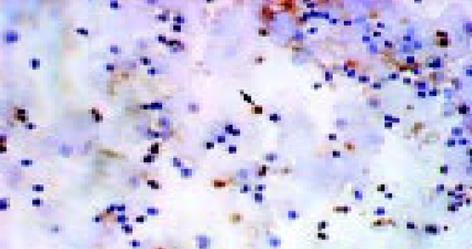
1.2.1 凋亡的检测: TUNEL法: 细胞凋亡检测试剂盒(cell death detection kit, POD). 将培养的细胞收集, 用PBS洗涤细胞2次, 去上清, 留细胞沉淀, 将细胞涂片, 并用40 g/L多聚甲醛固定. 细胞涂片用3 mL/L H2O2室温处理10 min. 蒸馏水洗涤2 min 3次. 加入Proteinase K37 ℃消化3 min. 0.1 mol/L PBS洗2 min 3次. 加标记缓冲液, 置湿盒中, 37 ℃标记2 h. 0.1 mol/L PBS洗2 min 3次. 加封闭液, 室温30 min, 甩掉封闭液, 加生物素化抗地高辛抗体37 ℃反应30 min 0.1 mol/L PBS洗2 min 3次.加SABC, 37 ℃ 60 min反应. 0.1 mol/L PBS洗5 min 4次. DAB显色, 苏木素复染. 脱水、透明, 封片. 流式细胞仪检测(Flow Cytometry FCM): 收取培养的细胞, 用PBS洗涤细胞2次, 加700 mL/L乙醇1 mL -20 ℃固定过夜. 离心去掉固定液, 再用PBS洗涤细胞2次, 加RNA酶(1 g/L)20 L37 ℃水浴30 min, 加入PI(50 mg/L) 500 L, 4 ℃孵育30 min以上后上流式细胞仪. 以G0/G1峰左侧出现的亚二倍体细胞群峰型来检测凋亡的细胞, 每次计数105个细胞.
1.2.2 HBV-PCR定量检测: 取血清20 L+病毒裂解液20 L, 混匀37 ℃ 1 h, 加入样品中和液40 L, 混匀. 取出15 L加入盛有15 L主反应液的薄壁反应管中, 加入扩增仪进行PCR反应. 反应后加入变性液30 L, 混匀, 加入杂交液100 L, 37 ℃ 1 h. 洗板5次, 控干然后加酶联液100 L, 37 ℃ 15 min. 再次洗板, 控干, 加入显色液100 L, 避光10 min, 加终止液100 L, 酶标仪读数.
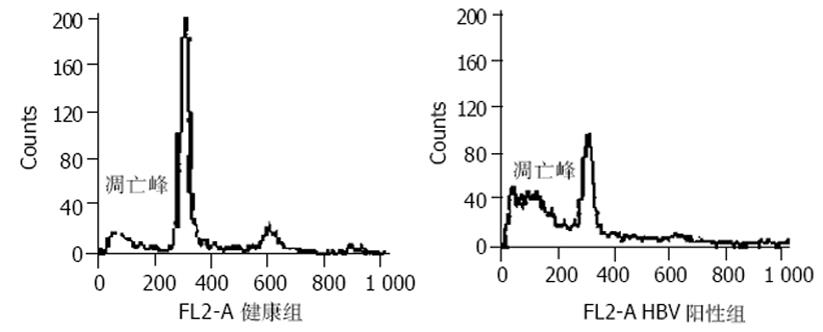
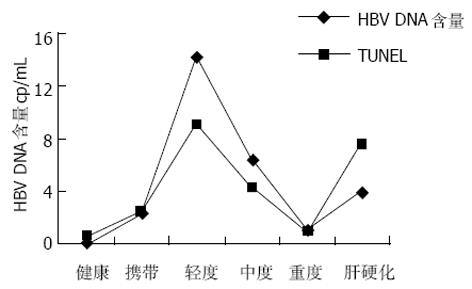
TUNEL法检测PBMC凋亡结果(图1, 表1), FCM检测PBMC凋亡结果(图2, 表1), 血清HBV-DNA含量的检测结果(表1). HBV阳性患者PBMC存在凋亡, HBV阳性患者PBMC凋亡率均较健康组高, 慢性乙型肝炎轻度组与肝硬化组凋亡率明显升高与健康组比较P<0.01, 与重度组相比P<0.05; 慢性乙型肝炎中度组凋亡率亦升高与健康组比较P<0.05; 慢性乙型肝炎轻度组凋亡率最高; 重度组与HBV携带组凋亡率亦增高, 但与健康组比较P>0.05. 轻度组的血清HBV-DNA含量最高, 与重度组相比P<0.05; 与其他组比较P>0.05.
PBMC凋亡率与血清HBV-DNA含量有相关性, 相关系数r = 0.338, P = 0.014.
HBV本身并不直接导致肝细胞损伤, 病毒的复制和病毒抗原的表达可激发机体的免疫反应造成肝脏细胞炎症[7], 多数研究认为HBV引起的慢性肝炎主要是免疫损伤所致, 乙型肝炎感染免疫状态研究对于进一步分析乙型肝炎的发病机制有重要的作用[8]. 自1972年Kerr et al明确了细胞凋亡(apoptosis)的概念以来, 许多学者对病毒性肝炎肝细胞凋亡进行了广泛研究[9]. 动物实验研究表明, 肝细胞凋亡是肝衰竭的一个早期过程[10]. 肝细胞凋亡与慢性乙型肝炎患者病理损伤有关, 但这些研究都停留在单纯探讨肝细胞凋亡方面, 而其他细胞凋亡与肝病关系研究尚少[11]. 有研究报道新鲜分离的外周血淋巴细胞对凋亡抵抗性很强, 几乎不能查见凋亡细胞[12], 本研究应用TUNEL及FCM检测乙型肝炎患者PBMCs凋亡, 实验结果表明PBMCs培养后检测到凋亡, 未培养的PBMCs未检测到凋亡(预实验检测新鲜提取的PBMCs, 未检测到凋亡). 有研究提出在体内凋亡小体很快被周围巨噬细胞所吞噬, 相反, 在体外, 巨噬细胞接触凋亡小体机会减少, 因此在培养细胞中凋亡增加[13], 本研究结果也证实了这一点.
在PHA等丝裂原刺激培养过程中PBMC逐渐对PHA等再刺激诱导的凋亡敏感, 这种淋巴细胞经活化后再发生凋亡的现象称为活化诱导的细胞死亡(activation-induced cell death, AICD)[14]. AICD与免疫功能的负调节有密切关系, 活化的淋巴细胞能否及时清除对于调节机体免疫反应应答程度起了重要作用[15]. 一方面, 感染细胞凋亡是机体细胞免疫清除病毒感染的一种手段, 另一方面, 病毒可利用调节反应性淋巴细胞凋亡等手段力求在体内繁殖、复制及弥散[16]. 但迄今有关慢性乙型肝炎免疫细胞状态和淋巴细胞凋亡的关系尚不清楚[17]. 细胞凋亡与免疫学之间存在着极为密切的关系, 如参与免疫系统的发育调节; 参与免疫反应的调节, 外周T、B细胞在被激活同时, 也启动了凋亡控制系统; 参与T细胞介导的杀伤机制, 包括诱导靶细胞凋亡[18]. 血清HBV-DNA含量高低反映了病毒在体内复制水平[19]. 乙型肝炎病变活动是宿主免疫对病毒及其抗原的应答状态[20]. 在对抗病毒感染过程中, 细胞免疫起了重要作用[21] . PBMC是T 、B淋巴细胞、单核巨噬细胞及自然杀伤细胞等免疫活性细胞的集合体, 在机体免疫反应尤其是细胞免疫反应中起重要的作用[22]. 在肝炎发病过程中, 肝炎病毒侵犯PBMC使其发生免疫反应可能引起机体免疫紊乱, 成为慢性肝炎发病原因之一[23]. 因此研究肝炎病毒感染的PBMCs有助于对肝炎病毒的致病机制进行深入研究[24].
我们发现, 在HBV慢性感染患者PBMC中存在凋亡, 其凋亡率均较健康对照组增高, 而慢性乙型肝炎轻度及肝硬化组PBMC凋亡率较健康组明显增高(P<0.01). 慢性乙型肝炎患者轻度组血清病毒载量与其他组比较亦最高, 与重度组比较差异有显著性(P<0.05). 本试验证明, HBV慢性感染患者PBMC凋亡率与血清病毒载量有相关性. 考虑HBsAg携带者处于免疫耐受阶段, 病毒处于相对静止状态, HBV慢性化主要是人体细胞免疫功能低下所致, 故凋亡较低. 慢性乙型肝炎轻度患者处于免疫耐受的高复制期, HBV复制活跃, 病毒量与病变程度成反比, 病毒复制水平较高, 肝内病变以变性为主, 凋亡较高. 随着感染的持续, 病毒复制水平逐渐降低[25], 肝内病变以变性和坏死同时存在. 在重度组, 肝细胞以坏死为主, 反应性淋巴细胞活化低下, 淋巴细胞耗竭, 因此其PBMC的凋亡率下降. AICD调节是一种生理性调节机制, 可限制淋巴细胞发生过强过度的免疫反应, 但同时可致外周免疫耐受[26], 结果显示HBV慢性感染患者PBMC存在AICD现象. 在肝细胞损伤的过程中, 肝细胞凋亡由T细胞活化的抗原识别启动抗原非特异性效应子的级联系统, 在HBV慢性感染患者中阻止肝细胞肿瘤发生[27].
本实验从慢性乙型肝炎患者外周血单个核细胞凋亡及血清HBV病毒载量的情况, 分析了HBV慢性感染患者免疫状况, 为HBV慢性感染的发病机制提供了一定的依据. 今后将对PBMC中HBV-DNA载量与PBMC凋亡的关系进行进一步研究.
编辑: N/A
| 1. | Rivero M, Crespo J, Fabrega E, Casafont F, Mayorga M, Gomez-Fleitas M, Pons-Romero F. Apoptosis mediated by the Fas system in the fulminant hepatitis by hepatitis B virus. J Viral Hepat. 2002;9:107-113. [DOI] |
| 2. | Benedict CA, Norris PS, Ware CF. To kill or be killed: viral evasion of apoptosis. Nat Immunol. 2002;3:1013-1018. [PubMed] [DOI] |
| 3. | Pasquetto V, Wieland S, Chisari FV. Intracellular hepatitis B virus nucleocapsids survive cytotoxic T-lymphocyte-induced apoptosis. J Virol. 2000;74:9792-9796. [PubMed] [DOI] |
| 5. | Cabrerizo M, Bartolomé J, Caramelo C, Barril G, Carreno V. Molecular analysis of hepatitis B virus DNA in serum and peripheral blood mononuclear cells from hepatitis B surface antigen-negative cases. Hepatology. 2000;32:116-123. [PubMed] [DOI] |
| 6. | Lee JY, Chae DW, Kim SM, Nam ES, Jang MK, Lee JH, Kim HY, Yoo JY. Expression of FasL and perforin/granzyme B mRNA in chronic hepatitis B virus infection. J Viral Hepat. 2004;11:130-135. [PubMed] [DOI] |
| 7. | Wang KX, Peng JL, Wang XF, Tian Y, Wang J, Li CP. Detection of T lymphocyte subsets and mIL-2R on surface of PBMC in patients with hepatitis B. World J Gastroenterol. 2003;9:2017-2020. [PubMed] [DOI] |
| 8. | Diepolder HM, Gruener NH, Gerlach JT, Jung MC, Wierenga EA, Pape GR. Different levels of T-cell receptor triggering induce distinct functions in hepatitis B and hepatitis C virus-specific human CD4(+) T-cell clones. J Virol. 2001;75:7803-7810. [PubMed] [DOI] |
| 11. | Su F, Theodosis CN, Schneider RJ. Role of NF-kappaB and myc proteins in apoptosis induced by hepatitis B virus HBx protein. J Virol. 2001;75:215-225. [PubMed] [DOI] |
| 13. | Kiyici M, Gurel S, Budak F, Dolar E, Gulten M, Nak SG, Memik F. Fas antigen (CD95) expression and apoptosis in hepatocytes of patients with chronic viral hepatitis. Eur J Gastroenterol Hepatol. 2003;15:1079-1084. [PubMed] [DOI] |
| 14. | Ji W, Wang HF, Feng CQ. Activation-induced cell death in peripheral blood mononuclear cells (PBMCs) from patients with chronic hepatitis B may be related to abnormal production of interleukin 12 and 10. J Viral Hepat. 2001;8:30-33. [PubMed] [DOI] |
| 15. | Hou CS, Wang GQ, Lu SL, Yue B, Li MR, Wang XY, Yu JW. Role of activation-induced cell death in pathogenesis of patients with chronic hepatitis B. World J Gastroenterol. 2003;9:2356-2358. [PubMed] [DOI] |
| 16. | Tsamandas AC, Thomopoulos K, Zolota V, Kourelis T, Karatzas T, Ravazoula P, Tepetes K, Petsas T, Karavias D, Karatza C. Potential role of bcl-2 and bax mRNA and protein expression in chronic hepatitis type B and C: a clinicopathologic study. Mod Pathol. 2003;16:1273-1288. [PubMed] [DOI] |
| 17. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] [DOI] |
| 18. | Kottilil S, Bowmer MI, Trahey J, Howley C, Gamberg J, Grant MD. Fas/FasL-independent activation-induced cell death of T lymphocytes from HIV-infected individuals occurs without DNA fragmentation. Cell Immunol. 2001;214:1-11. [PubMed] [DOI] |
| 19. | Simon K, Rotter K, Zalewska M, Gładysz A. HBV-DNA level in blood serum as a predictor of good response to therapy with interferon-alpha-2b of patients with chronic hepatitis B. Med Sci Monit. 2000;6:971-975. [PubMed] |
| 20. | Rabe C, Cheng B, Caselmann WH. Molecular mechanisms of hepatitis B virus-associated liver cancer. Dig Dis. 2001;19:279-287. [PubMed] [DOI] |
| 21. | Tsutsui H, Adachi K, Seki E, Nakanishi K. Cytokine-induced inflammatory liver injuries. Curr Mol Med. 2003;3:545-559. [PubMed] [DOI] |
| 23. | Yin XM, Ding WX. Death receptor activation-induced hepatocyte apoptosis and liver injury. Curr Mol Med. 2003;3:491-508. [PubMed] [DOI] |
| 25. | Murakami Y, Minami M, Daimon Y, Okanoue T. Hepatitis B virus DNA in liver, serum, and peripheral blood mononuclear cells after the clearance of serum hepatitis B virus surface antigen. J Med Virol. 2004;72:203-214. [PubMed] [DOI] |
| 26. | Zender L, Hutker S, Liedtke C, Tillmann HL, Zender S, Mundt B, Waltemathe M, Gosling T, Flemming P, Malek NP. Caspase 8 small interfering RNA prevents acute liver failure in mice. Proc Natl Acad Sci U S A. 2003;100:7797-7802. [PubMed] [DOI] |
| 27. | Nakamoto Y, Kaneko S. Mechanisms of viral hepatitis induced liver injury. Curr Mol Med. 2003;3:537-544. [PubMed] [DOI] |