修回日期: 2004-03-01
接受日期: 2004-03-18
在线出版日期: 2004-07-15
目的: 明确三氧化二砷(As2O3)注射液对人类大肠癌细胞株的诱导凋亡作用, 并探讨其分子机制.
方法: 采用四甲基偶氮唑蓝(MTT)比色法、AO/EB荧光染色法、透射电镜观察、DNA电泳、流式细胞术法及免疫组化等方法, 系统地观察了As2O3注射液对体外培养的人类大肠癌细胞株LoVo和CoLo-320的生长活力、细胞凋亡、细胞周期及其相关基因表达的影响.
结果: 用不同浓度(0.5, 1.0, 2.0, 4.0 mg/L) As2O3作用LoVo和CoLo-320细胞不同时间(24, 48, 72 h), 均能显著抑制其生长(P<0.05), 用药后诱导其出现了典型的细胞凋亡的形态学和生化学改变, 癌细胞Bcl-2基因表达明显下降, Bax和Fas基因表达显著增强(P<0.01).
结论: As2O3注射液对人类大肠癌细胞具有显著的诱导凋亡作用, 这一作用受到多种基因的调控, 即Bcl-2基因表达下调, Bax和Fas基因表达上调.
引文著录: 刘琳, 邱少敏, 赵伟, 夏海鸣, 秦叔逵, 陈惠英. 三氧化二砷诱导人类大肠癌细胞凋亡的分子机制. 世界华人消化杂志 2004; 12(7): 1550-1554
Revised: March 1, 2004
Accepted: March 18, 2004
Published online: July 15, 2004
AIM: To study the possible apoptosis-inducing effect of arsenic trioxide (As2O3) on the different types of human large intestinal carcinoma cell, and its molecular mechanisms.
METHODS: As2O3's action on the cell growth, apoptosis, periodic return and the expression of related genes of the two human large intestinal carcinoma cell lines LoVo and CoLo-320 in vitro was observed by MTT assay, acridine orange (AO)/ethidiumbromide (EB) flurescent staining, electron microscopy detection, DNA gel electrophoresis, flow cytometry, and immunohistochemical staining.
RESULTS: After treated by As2O3 at different concentration(0.5, 1.0, 2.0, 4.0 mg/L) for various times (24, 48, 72 h), the human large intestinal carcinoma cell LoVo and CoLo-320 showed strongly inhibitory effect on growth (P < 0.05) and also the cells showed typical morphological and biochemical characteristic changes of apoptosis, with bcl-2 gene expression down-regulated, and bax and Fas gene expression up-regulated (P < 0.01).
CONCLUSION: As2O3 has significant apoptosis-inducing effect on large intestinal carcinoma cells, which is regulated by several genes.
- Citation: Liu L, Qiu SM, Zhao W, Xia HM, Qin SK, Chen HY. Molecular mechanism of arsenic trioxide inducing apoptosis in human large intestinal carcinoma cell line. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1550-1554
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1550.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1550
三氧化二砷(As2O3, 亚砷酸)注射液治疗急性早幼粒细胞白血病(APL), 取得了令世人瞩目的进展[1-6]. As2O3注射液治疗实体瘤的作用受到了广泛重视[7-15] . 我们发现As2O3注射液具有抗肝癌作用, 并对其作用机制进行了深入研究, 结果令人鼓舞[16-23]. 为进一步拓展该药治疗消化系统恶性肿瘤的适应证, 我们采用不同种类人结肠腺癌细胞株LoVo和CoLo-320作为对象, 研究As2O3注射液的抗大肠癌作用.
人结肠腺癌细胞株LoVo和CoLo-320, 均引自中国科学院上海细胞生物研究所细胞库. 用含100 mL/L小牛血清的RPMI1640培养液传代培养, 当细胞生长活力良好时使用. 1 g/L As2O3溶液, 即亚砷酸注射液, 国药准字X19990191, 哈尔滨伊达药业公司产品. 使用时以RPMI1640培养液稀释至所需浓度. RPMI1640培养液, 含100 mL/L新生小牛血清和青、链霉素各1×105 u/L. 四甲基偶氮唑蓝(MTT), 购自Fluka公司, 用PBS溶液将其稀释至5 g/L, 压滤除菌, 4 ℃避光保存. 蛋白酶K和RNase A均购自德国宝灵曼公司. 鼠抗人Bcl-2、Bax和Fas mAb, 为福州迈新生物技术开发公司产品.
MTT法测定细胞抑制率. 将密度为2×107/L细胞接种于40孔细胞培养板中, 待细胞贴壁后分别加入不同浓度的药物, 设复孔和对照孔, 置37 ℃, 50 mL/L 5% CO2条件下培养至预定时间, 每孔加入MTT30 L, 继续培养4 h, 加0.02 moL/L盐酸异丙醇100 L/孔, 振荡混匀, 于酶联仪波长570 nm处测出各孔吸光度A值, 按下式计算细胞生长抑制率: 细胞抑制率=(1- 给药孔平均A值/对照孔平均A值)×100%. AO/EB荧光染色法: 分别计数活细胞数(VN)、早期凋亡细胞(VA)、晚期凋亡细胞(NVA)、和死亡细胞(NVN), 细胞凋亡率按以下公式计算: 细胞凋亡率=[(VA+NVA)/(VN+VA+NVA+NVN)]×100%. 收集实验组和对照组细胞, 按常规透射电镜制样方法固定、包埋和染色, 于H-300型透射电镜下观察并拍照. 取6×106细胞加入细胞裂解液悬起细胞, 加入100 g/L SDS 100 L, 2.5 kg/L蛋白酶K10 L, 55℃保温1 h, 再加入无DNase活性的RNaseA10 L (1 kg/L ), 37℃保温1 h, 再加入等体积的饱和酚/氯仿/异戊醇(25: 24: 1)抽提2次, 再用氯仿/异戊醇抽提1次, 加入二倍体积的无水乙醇, 1/10体积3 moL/L醋酸钠, 置于-20 ℃ 1 h, 用80%乙醇清洗一次, 真空干燥, 加入TE缓冲液60-100 L. 取样品20 L加入上样缓冲液2 L, 进行15 g/L琼脂糖凝胶电泳. 收集1×106细胞乙醇固定, 离心去掉上清, 加RnaseA200 L 37 ℃水浴30 min, 再加入PI染色液800 L混匀, 至4 ℃避光30 min, 上机测试(美国 Becton Dickinson公司产品), 所用软件为ModFIT和CELLQUEST. 免疫组化按链霉菌抗生物素蛋白-过氧化酶(SP)免疫组化染色试剂盒说明书操作. 结果判断标准: 阳性细胞为胞质内、胞核和胞膜上显示棕色均匀颗粒. 按阳性细胞数和染色强度分为: -(阳性细胞数<5%), +(阳性细胞数占5%-25%, 胞质呈浅棕色), ++(阳性细胞数占25%-50%, 胞质呈棕色颗粒状), +++(阳性细胞数>50%, 胞质呈深棕色颗粒状, 染色较深).
统计学处理 采用t检验和x2检验进行显著性检验.
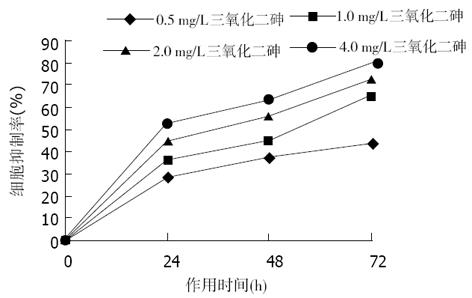
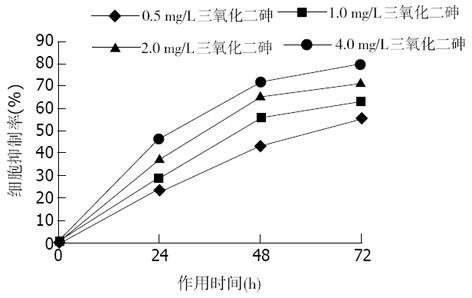
应用As2O3后, 结肠癌细胞的生长受到不同程度抑制, 其抑制作用随药物浓度增加和作用时间延长而增强. 用不同浓度As2O3作用LoVo和CoLo-320细胞相同时间以及相同As2O3浓度处理不同时间的细胞抑制率相比, 均有明显差异(P<0.05, 图1, 图2).
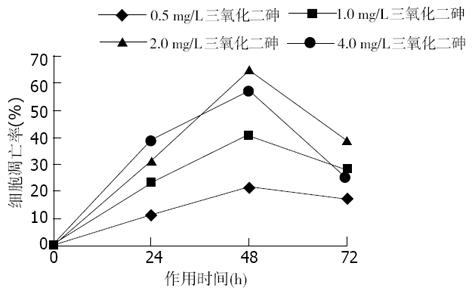
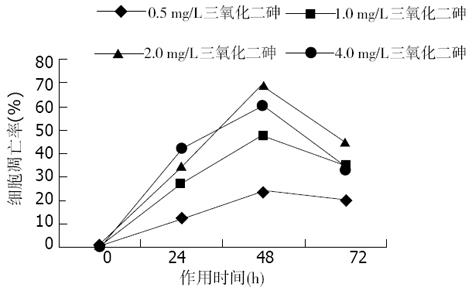
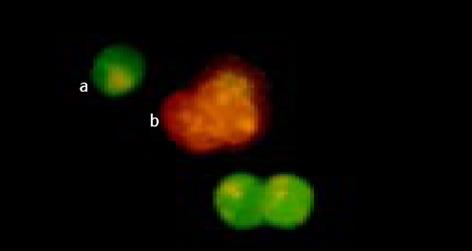
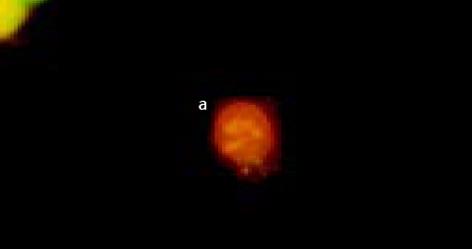
经不同浓度As2O3作用不同时间后, 于荧光显微镜下均可观察到LoVo和CoLo-320细胞出现典型的细胞凋亡形态学改变, 主要表现为早期凋亡细胞核染色质着绿色并呈固缩状或碎片状, 晚期凋亡细胞核染色质着橘色并呈固缩状或碎片状. 半定量计数结果表明, As2O3能有效地诱导两株人大肠癌细胞凋亡, 其诱导凋亡作用与药物亦呈明显的量效与时效关系(P<0.05, 图3-6).
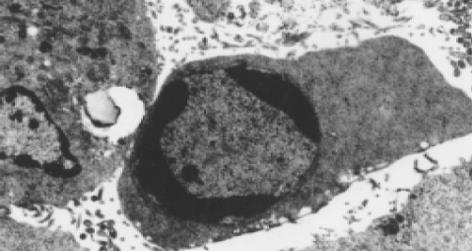
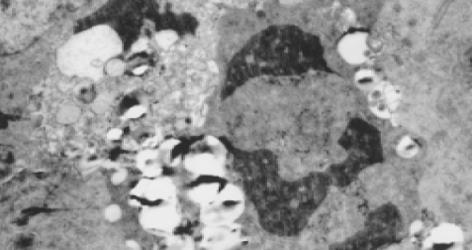
经A2O3作用后部分LoVo和CoLo-320细胞出现细胞皱缩, 胞质浓缩, 可见胞质起泡及凋亡小体形成, 细胞核固缩, 核内染色质聚集于核膜内侧呈团块或新月状, 细胞表面微绒毛减少, 甚至消失; 未加药组细胞胞膜完整, 表面微绒毛丰富, 细胞器结构正常, 核仁较大, 可见有多个核仁, 染色质均匀, 常染色质丰富(图7, 图8).
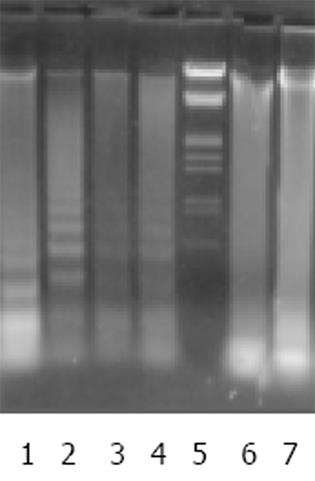
不同浓度的As2O3作用LoVo和CoLo-320细胞48 h后, 细胞DNA在琼脂糖凝胶电泳上出现明显的DNA梯状降解, 而未加药组细胞DNA无此现象(图9).
As2O3作用LoVo和CoLo-320细胞不同时间后, 在流式细胞仪DNA组方图上, 各组均可见凋亡细胞呈特征性的亚二倍峰(凋亡峰), 细胞周期分布显示2 mg/L As2O3作用24-72 h可使LoVo和CoLo-320细胞生长阻滞于S期(表1).
| 细胞 | G0/G1 | S | G2/M | ||
| LoVo | 对照 | 57.44 | 25.92 | 16.64 | |
| 用药 | 24 h | 40.13 | 47.30 | 12.57 | |
| 48 h | 53.32 | 31.52 | 15.17 | ||
| 72 h | 48.46 | 34.83 | 16.71 | ||
| CoLo-320 | 对照 | 53.76 | 28.37 | 17.87 | |
| 用药 | 24 h | 46.10 | 39.49 | 14.41 | |
| 48 h | 38.22 | 42.13 | 19.65 | ||
| 72 h | 44.21 | 43.19 | 12.60 |
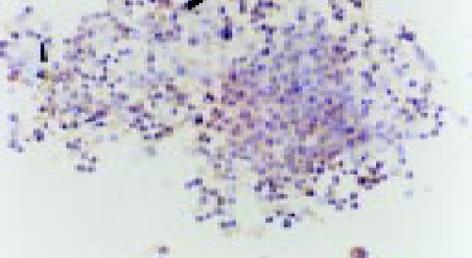
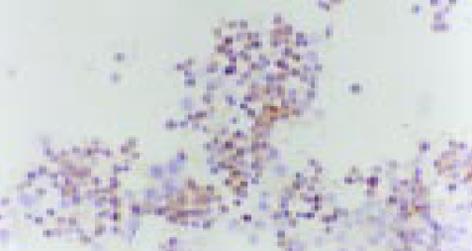
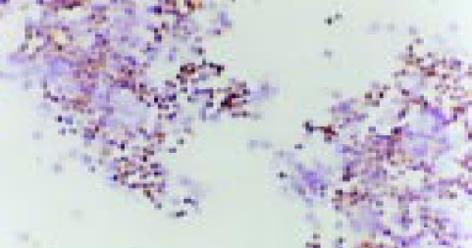
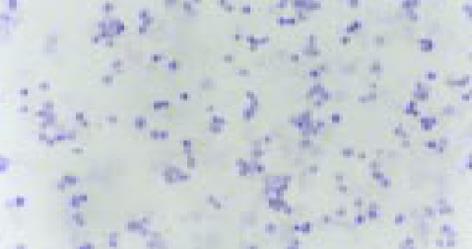
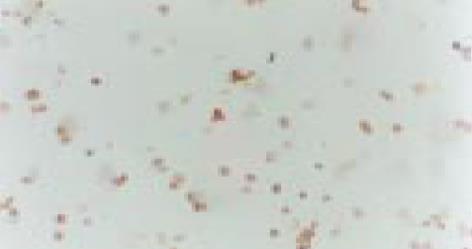
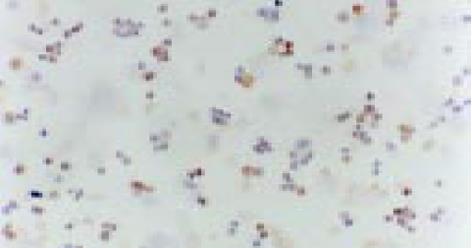
经2 mg/L As2O3处理人肠癌LoVo和CoLo-320细胞48 h后, 其Bcl-2基因表达明显下降, Bax和Fas基因表达显著增强(表2, 图10-15).
| 用药情况 | 标本数(片) | Bcl-2 | bax | Fas | ||||||||||
| - | + | ++ | +++ | - | + | ++ | +++ | - | + | ++ | +++ | |||
| LoVo | 用药前 | 6 | 0 | 0 | 1 | 5 | 6 | 0 | 0 | 0 | 4 | 2 | 0 | 0 |
| 用药后 | 6 | 6 | 0 | 0 | 0 | 0 | 0 | 1 | 5 | 0 | 0 | 1 | 5 | |
| CoLo-320 | 用药前 | 6 | 0 | 0 | 0 | 6 | 4 | 2 | 0 | 0 | 5 | 1 | 0 | 0 |
| 用药后 | 6 | 6 | 0 | 0 | 0 | 0 | 0 | 0 | 6 | 0 | 0 | 2 | 4 | |
恶性肿瘤的发生发展与凋亡调节紊乱密切相关[24-26]. 抗肿瘤药物的疗效不仅取决于他们对靶细胞的杀伤作用, 也取决于其诱导凋亡作用, 不少药物都是通过诱导或增强肿瘤细胞的凋亡发挥抗癌作用的, 寻找高效低毒的肿瘤细胞凋亡诱导剂已成为肿瘤治疗的新思路[27-30]. 三氧化二砷(As2O3)是一种良好的急性早幼粒细胞白血病(APL)细胞凋亡诱导剂[1-2,4], 而且As2O3对多种实体瘤细胞亦有良好的诱导凋亡作用[8,10-11,13-14,17]. 进一步探索As2O3治疗实体瘤, 尤其是对化疗抗拒的大肠癌的可能性实属必要. 我们发现, 两株人大肠癌细胞经As2O3处理后, 在荧光显微镜下观察到典型凋亡细胞出现, 并呈量效和时效特点, 凋亡细胞核呈固缩状或碎裂状; 透射电镜观察, 可见细胞皱缩, 胞质浓缩, 染色质聚集于核膜内侧呈团块状或新月帽状, 可见质膜起泡及凋亡小体形成; 细胞DNA在琼脂糖凝胶电泳上出现明显梯形条带(ladder); 在DNA组方图上可见凋亡峰. 以上结果证明, As2O3可有效诱导人类大肠癌细胞凋亡. 经As2O3作用后, 通过对两株人大肠癌细胞生长活力和诱导凋亡情况的动态观察, 我们发现药物作用细胞后0-72 h内, 细胞抑制率一直随时间的延长而增强, 而细胞凋亡率却在48 h达到高峰后开始下降, 这提示我们As2O3引起的人大肠癌细胞死亡是非典型死亡, 即凋亡和坏死现象共存, As2O3在诱导人大肠癌细胞凋亡的同时也发挥了一定的细胞毒作用; 药物作用48 h后, 细胞抑制率与细胞凋亡率成负相关的另一可能原因是在凋亡后期发生继发性的细胞膜改变而成为继发性坏死.
凋亡是一种受基因调控的细胞主动死亡过程, 目前认为与肿瘤细胞凋亡相关的基因主要有Bcl-2基因家族、P53基因、apo-1/fas基因和c-myc基因等[31]. 本研究表明, LoVo和CoLo-320细胞Bcl-2大量表达, 同时伴有Bax和Fas基因的杂合性缺失, 而经As2O3处理后, 明显下调Bcl-2基因的表达, 增强Bax和Fas基因表达, 使Bcl-2/Bax比值减少, 这应是As2O3诱导LoVo和CoLo-320细胞凋亡的分子机制之一. 此外, 流式细胞术研究结果发现, 经As2O3处理后, 两株大肠癌细胞周期分布与对照细胞明显不同, As2O3改变了大肠癌细胞的周期分布, 使S期细胞所占比例升高. As2O3作用的这一细胞动力学特性提示该药可能为细胞周期特异性药物, 这与以往多位作者的研究结果基本一致As2O3.
总之, As2O3在体外对上述不同种类两株人大肠癌细胞株均有显著的抑制作用, 这种作用与诱导细胞凋亡密切相关, 并具有量效性、时效性和周期特异性, 其作用机制可能与下调抑凋亡基因Bcl-2表达, 增强促凋亡基因Bax和Fas表达及细胞周期阻滞有关. 本研究为临床上应用As2O3治疗人类大肠癌和其他恶性肿瘤提供了可靠实验依据.
编辑: N/A
| 1. | Chen GQ, Shi XG, Tang W, Xiong SM, Zhu J, Cai X, Han ZG, Ni JH, Shi GY, Jia PM. Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL): I. As2O3 exerts dose-dependent dual effects on APL cells. Blood. 1997;89:3345-3353. [PubMed] |
| 2. | Shen ZX, Chen GQ, Ni JH, Li XS, Xiong SM, Qiu QY, Zhu J, Tang W, Sun GL, Yang KQ. Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL): II. Clinical efficacy and pharmacokinetics in relapsed patients. Blood. 1997;89:3354-3360. [PubMed] |
| 3. | Carmosino I, Latagliata R, Avvisati G, Breccia M, Finolezzi E, Lo Coco F, Petti MC. Arsenic trioxide in the treatment of advanced acute promyelocytic leukemia. Haematologica. 2004;89:615-617. [PubMed] |
| 4. | Zhu J, Okumura H, Ohtake S, Nakamura S, Nakao S. The molecular mechanism of arsenic trioxide-induced apoptosis and oncosis in leukemia/lymphoma cell lines. Acta Haematol. 2003;110:1-10. [PubMed] [DOI] |
| 5. | Zhang P, Wang S, Hu L, Qiu F, Yang H, Xiao Y, Li X, Han X, Zhou J, Liu P. [Seven years' summary report on the treatment of acute promyelocytic leukemia with arsenic trioxide--an analysis of 242 cases]. Zhonghua Xue Ye Xue Za Zhi. 2000;21:67-70. [PubMed] |
| 6. | Zhou J, Meng R, Wang Y, Yang BF. [Clinical observation and following up of two administration methods of arsenic trioxide in treatment of acute promyelocytic leukemia]. Zhonghua Yi Xue Za Zhi. 2004;84:405-408. [PubMed] |
| 7. | Huang SG, Kong BH, Ma YY, Jiang S. [Impact of arsenic trioxide on proliferation and metastasis of drug-resistant human ovarian carcinoma cell line]. Ai Zheng. 2002;21:863-867. [PubMed] |
| 8. | Gu QL, Li NL, Zhu ZG, Yin HR, Lin YZ. A study on arsenic trioxide inducing in vitro apoptosis of gastric cancer cell lines. World J Gastroenterol. 2000;6:435-437. [DOI] |
| 9. | Maeda H, Hori S, Ohizumi H, Segawa T, Kakehi Y, Ogawa O, Kakizuka A. Effective treatment of advanced solid tumors by the combination of arsenic trioxide and L-buthionine-sulfoximine. Cell Death Differ. 2004;11:737-746. [PubMed] [DOI] |
| 10. | Deng Y, Lin C, Zhang X, Chen D, Xiao P, Wu M. [Arsenic trioxide induced human esophageal cancer Ec109 cell apoptosis with downregulation of c-myc gene expression]. Zhongguo Yi Xue Ke Xue Yuan Xue Bao. 2000;22:67-70. [PubMed] |
| 11. | Li X, Ding X, Adrian TE. Arsenic trioxide induces apoptosis in pancreatic cancer cells via changes in cell cycle, caspase activation, and GADD expression. Pancreas. 2003;27:174-179. [PubMed] [DOI] |
| 12. | Li D, Du C, Lin Y, Wu M. Inhibition of growth of human nasopharyngeal cancer xenografts in SCID mice by arsenic trioxide. Tumori. 2002;88:522-526. [PubMed] |
| 16. | Chen H, Qin S, Pan Q. [Antitumor effect of arsenic trioxide on mice experimental liver cancer]. Zhonghua Gan Zang Bing Za Zhi. 2000;8:27-29. [PubMed] |
| 17. | Liu L, Qin S, Chen H, Wang J, Chen H, Ma J, Liu W. [An experimental study on arsenic trioxide-selectively induced human hepatocarcinoma cell lines apoptosis and its related genes]. Zhonghua Gan Zang Bing Za Zhi. 2000;8:367-369. [PubMed] |
| 18. | Wang W, Qin SK, Chen BA, Chen HY. Experimental study on antitumor effect of arsenic trioxide in combination with cisplatin or doxorubicin on hepatocellular carcinoma. World J Gastroenterol. 2001;7:702-705. [PubMed] |
| 19. | Qian J, Qin S, He Z. [Arsenic trioxide in the treatment of advanced primary liver and gallbladder cancer]. Zhonghua Zhong Liu Za Zhi. 2001;23:487-489. [PubMed] |
| 20. | Qian J, Qin S, He Z, Wang L, Chen Y, Shao Z, Liu X. [Arsenic trioxide for the treatment of medium and advanced primary liver cancer]. Zhonghua Gan Zang Bing Za Zhi. 2002;10:63. [PubMed] |
| 24. | Amarante-Mendes GP, Finucane DM, Martin SJ, Cotter TG, Salvesen GS, Green DR. Anti-apoptotic oncogenes prevent caspase-dependent and independent commitment for cell death. Cell Death Differ. 1998;5:298-306. [PubMed] [DOI] |
| 25. | Green DR, Martin SJ. The killer and the executioner: how apoptosis controls malignancy. Curr Opin Immunol. 1995;7:694-703. [PubMed] [DOI] |
| 26. | Martin SJ, Green DR. Apoptosis and cancer: the failure of controls on cell death and cell survival. Crit Rev Oncol Hematol. 1995;18:137-153. [PubMed] [DOI] |
| 27. | Martin SJ, Green DR. Apoptosis as a goal of cancer therapy. Curr Opin Oncol. 1994;6:616-621. [PubMed] [DOI] |
| 31. | Chung TK, Cheung TH, Lo WK, Yim SF, Yu MY, Krajewski S, Reed JC, Wong YF. Expression of apoptotic regulators and their significance in cervical cancer. Cancer Lett. 2002;180:63-68. [PubMed] [DOI] |