修回日期: 2004-02-10
接受日期: 2004-02-24
在线出版日期: 2004-07-15
目的: 采用反义寡核苷酸封闭肝癌细胞中survivin基因的表达, 研究其对肝癌细胞生长的抑制作用.
方法: 针对survivin mRNA翻译起始位点设计并合成反义寡核苷酸(antisense oligonucleotide, ASODN); 采用脂质体介导survivin ASODN转染人肝癌细胞株SMMC-7721细胞, western-blot及原位杂交方法检测survivin蛋白及mRNA表达, 流式细胞仪检测细胞凋亡率的变化, 检测转染前后细胞贴壁率及细胞生长抑制率变化, 绘制细胞生长曲线.
结果: 脂质体介导survivin反义寡核苷酸转染肝癌细胞后survivin蛋白及 mRNA表达分别从69.59及75.61降低至10.71及22.94, 细胞贴壁率从90.68%降低至33.16%, 细胞凋亡率从0.7%增加至31.35%, 均有显著差异. 转染后对细胞生长的抑制作用可以维持大约1 wk, 在转染后第3 d抑制率最高可达71.8%.
结论: 脂质体介导转染survivin反义寡核苷酸可以有效降低细胞内survivin基因的表达, 诱导细胞发生凋亡, 抑制肝癌细胞生长.
引文著录: 陈涛, 贾玉容, 赵铁军, 尹致良. survivin反义寡核苷酸对肝癌细胞生长抑制作用的研究. 世界华人消化杂志 2004; 12(7): 1546-1549
Revised: February 10, 2004
Accepted: February 24, 2004
Published online: July 15, 2004
AIM: To investigate the inhibitory effect of survivin antisense oligonucleotide (ASODN) on the expression of survivin gene and proliferation of human hepatocellular carcinoma cell line SMMC-7721.
METHODS: The 20mer antisense oligonucleotide (ASODN) targeted to the promotor region of survivin mRNA was designed and synthesized. The expression of survivin gene in hepatocellular carcinoma cell line SMMC-7721 was blocked by means of ASODN transfection mediated by DOTAP liposomal reagent. The changes of survivin protein and mRNA expression after transfection were assessd by Western blot and in situ hybridization, respectively. The apoptotic rate was detected by flow cytometer. The changes of cell adherent rate, cell growth activity, and the inhibitory rate of cell growth were also studied.
RESULTS: The expression of survivin protein and mRNA was decreased markedly after survivin ASODN transfection (69.59 vs 10.71, and 75.61 vs 22.94, P < 0.01). Meanwhile, the cell adherent rate also decreased markedly (90.68% vs 33.16%, P < 0.01) while the apoptotic rate increased markedly (0.7% vs 31.35%, P < 0.01). The inhibitory effect on the cell growth could maintain about a week after transfection, and the highest inhibitory rate could be 71.8% three d after transfection.
CONCLUSION: Transfection of ASODN targeted to the promotor region of survivin mRNA by DOTAP liposomal transfection reagent can down-regulate the expression of survivin protein and mRNA significantly in 7721 cell line and inhibit the proliferation of cancer cells. survivin may be an important target in the therapy of hepatocellular carcinoma.
- Citation: Chen T, Jia YR, Zhao TJ, Yin ZL. Inhibitory effect of antisense oligonucleotide on the expression of survivin gene and proliferation of human hepatocellular carcinoma cell line SMMC-7721. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1546-1549
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1546.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1546
目前肝癌的治疗方法主要集中在抑制肝癌细胞增生和促进肝癌细胞凋亡两个方面[1-14], 由于抑制细胞增生的方法对正常肝组织也可能造成较大损伤, 因此诱导肝癌细胞凋亡的方法可能更为合理. survivin是新近发现的一种抑制细胞凋亡蛋白(inhibitor of apoptosis proteins, IAP)家族成员, 仅特异性地表达于肿瘤组织, 在正常成人组织几乎不表达, 通过阻断细胞凋亡的发生过程, 在促进肿瘤的发生发展过程中发挥重要的作用[15-25]. 本研究采用针对survivin mRNA设计的ASODN, 通过脂质体介导转染人肝癌细胞SMMC-7721抑制其survivin的表达, 并对其对SMMC-7721细胞的生长抑制作用进行了初步研究.
人肝癌细胞株SMMC-7721为本中心自存, 水浴复苏后调节至1×106/L, 接种于30 mL培养瓶及铺有无菌盖玻片的6孔培养板, 以含100 mL/L小牛血清的RPMI1640培养液, 置于37 ℃, 50 mL/L CO2培养箱中培养, 隔日换液, 常规培养至80%汇片后进行转染. 硫代磷酸型寡核苷酸由上海生工生物工程公司合成, 序列如下: 反义寡核苷酸(antisense oligonucleotide, ASODN)序列5'GGGGCACCCATGCCGCCGCC3'; 正义寡核苷酸(sense oligonucleotide, SODN) 序列: 5'GGCGGCGGCATGGGTGCCCC3'. 两条序列均采用硫代磷酸型, 即在合成时用巯基取代寡核苷酸片段磷上的羟基. 按照DOTAP脂质体转染试剂盒(Roche, USA)说明进行转染.
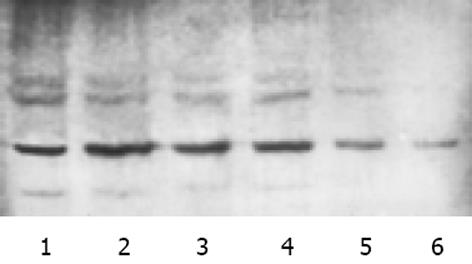
根据转染复合物浓度分为6组, Ⅰ组: 以无血清RPMI1640培养液代替转染复合物作为空白对照组; Ⅱ组: 1 000 g/L SODN转染照; Ⅲ, Ⅳ, Ⅴ, Ⅵ组: 400, 600, 800, 1 000 g/L ASODN转染组; 每组设5组平行分组, 转染进行24 h后结束转染用Western-blot检测survivin蛋白的表达. 收集5×106个细胞, 含1 mmoL/L PMSF(Merk, USA)的细胞裂解液裂解细胞, 提取总蛋白质, 紫外分光光度法蛋白定量.40 g蛋白进行120 g/L十二烷基磺酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳(Bio-Rad, USA), 以蛋白电泳转引仪(Bio-Rad, USA)将产物转至PVDF膜; 将膜4 ℃封闭过夜, TBST洗膜, 加入1: 1000羊抗人survivin(Santa-Cruz, USA), 4 ℃摇床孵育过夜, TBST洗膜, 加入1: 4 000兔抗羊IgG/HRP(Santa-Cruz, USA) 室温孵育90 min, TBST洗膜, Lumiglo化学发光试剂反应1 min, X片暗室曝光, 常规显影定影. 图像以Bio-Rad图像分析系统分析, 以相应蛋白条带的平均光强度值表示p38MAPK表达的相对强度.
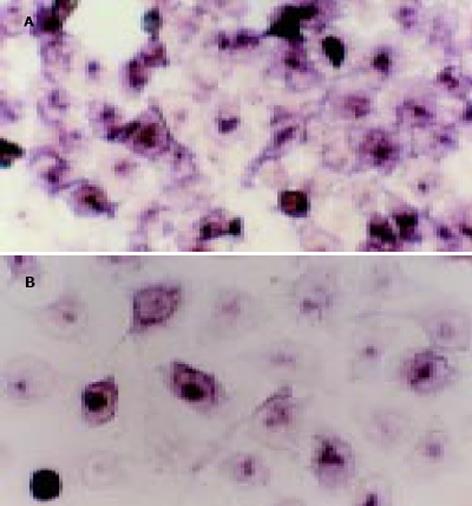
1.2.1 原位杂交检测survivin mRNA的表达: survivin cDNA载体质粒为pcDNA3.1(Invitrogen, USA), 按照质粒抽提纯化试剂盒(上海华舜, 中国)说明书将质粒转化、扩增、抽提、纯化, 以内切酶EcoRI(Gibcol, USA)将质粒线性化, 按Dig-RNA Labeling Kit (Boehring Mannheim, German)说明以地高辛标记探针; 细胞铺片转染结束后, 以地高辛标记探针进行杂交, NBT-BCIP显色液40 L显色, 镜下观察, 适时终止显色.随机选择5个200倍视野, 计数细胞总数及染色阳性细胞数, 计算杂交阳性率=(杂交阳性细胞数/总细胞数)×100%. 杂交前用RNase 100 mg/L, 37 ℃ 1 h预处理细胞片作阴性对照. 用不含survivin反义cRNA探针的杂交缓冲液检测作空白对照.
1.2.2 细胞增生活性测定: 在6孔培养板内进行转染, 转染结束后换新鲜培养液继续培养24 h后终止培养, 倒置显微镜下观察细胞生长情况, 每孔分别随机计数5个20×10倍视野下贴壁细胞数及全部细胞数, 根据公式计算细胞贴壁率(%)=(贴壁细胞数/全部细胞数)×100%. 收集ASODN转染后的各组细胞, 调整至1.5×107/L, 接种于96孔板, 每孔200 L, 每组细胞接种5复孔, 共接种7板, 继续常规培养. 每日取出一板, 弃去培养液, 生理盐水漂洗两遍, 5 g/L结晶紫溶液染色, PBS冲洗, 50 ℃烘干, 加入10 g/L SDS溶液振荡溶解, 酶联免疫仪于540 nm读取A值. 以A值为纵坐标, 以时间(d)为横坐标绘制生长曲线. 计算细胞生长抑制率(%)=[1-(试验组A值/空白对照组A值)]×100%. 收集2×106个细胞, 预冷的700 mL/L乙醇4 ℃固定24 h, PBS洗涤3次, 细胞重悬于PBS 0.4 mL中, 加入5 g/L的RNase A 10 L 37 ℃孵育1 h, 1 g/L PI 4 ℃染色过夜, 流式细胞仪检测凋亡细胞的比率. Multicycle软件进行数据处理.
统计学处理 结果以均数±标准差(mean±SD)表示, 采用SPSS10.0软件进行x2检验、方差分析和q检验分析.
survivin蛋白在人肝癌细胞SMMC-7721中高度表达, western blot检测表明, SODN转染组较正常对照组无明显变化; 600, 800及1 000 g/LASODN组转染后survivin蛋白表达较正常对照及SODN转染组显著降低, 其中1 000 g/L组转染结束后survivin蛋白表达仅为空白对照组的15.4%(图1, 表1). survivin mRNA原位杂交产物呈蓝紫色, 主要分布于细胞质内. 经survivin ASODN作用后survivin mRNA表达呈逐渐降低的趋势. 统计分析表明, 800及1 000 g/L ASODN组survivin mRNA杂交阳性率分别为28.2±3.1%和22.9±2.5%, 较正常对照及SODN转染组显著降低(图2, 表1).
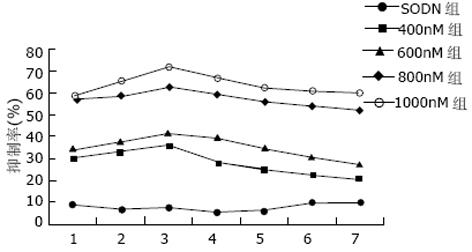
倒置显微镜下观察, 空白对照以及正义对照组细胞生长良好, 接种4 h后大多数细胞已贴壁生长, 形状舒展. survivin ASODN转染后的细胞贴壁较晚, 随时间推移, 贴壁细胞减少, 24 h后多数细胞呈悬浮状态. 经survivin ASODN作用后细胞贴壁率呈逐渐降低的趋势, 正义对照组及400 g/L组细胞贴壁率较空白对照组差异无显著性, 但600, 800及1 000 g/L组细胞贴壁率分别为74.9%±2.1%、51.5%±1.5%及33.2%±2.0%, 较正常对照(90.7%±1.9%)及SODN转染组(90.0%±1.2%)显著降低(P<0.05, 0.01和0.01).细胞增生活性空白对照以及正义对照组较高, survivin ASODN处理后各组细胞增生活性均有不同程度降低, 在转染后3 d细胞生长抑制率最高, 其中1 000 g/L组在转染结束后第3 d对肝癌生长抑制率最高可达71.8%, 其后逐渐缓慢下降, 至7 d仍可保持一定的生长抑制作用(图3). 流式细胞仪定量检测凋亡细胞, 可见转染后2倍体峰(G1期细胞)减少, G1峰左侧出现明显的凋亡峰(亚二倍体峰). 各组细胞凋亡分别为0.7%, 0.8%, 2.4%, 7.8%, 23.1%及31.4%, 实验组细胞凋亡均较对照组有显著增加.
研究发现ASODN可以在转录水平和翻译水平调节相关基因的表达[26]. 随着DNA自动化合成技术的发展, 采用反义技术抑制和封闭特定基因的表达, 已经成为研究基因功能的重要方法以及基因治疗的重要组成部分.我们设计了一种针对survivin mRNA翻译起始位点的ASODN, 采用脂质体介导转染肝癌细胞SMMC-7721, 以封闭survivin基因的表达, 并研究了其对肝癌细胞的生长抑制效应. 由实验结果可见, 我们针对survivin mRNA翻译起始位点设计的ASODN能够确实有效地封闭体外培养的肝癌SMMC-7721细胞survivin基因的表达, 并对抑制其生长活性具有明显的效果, 在转染后3 d抑制活性最高, 其后逐渐缓慢下降, 至转染后7 d仍能保持一定的抑制活性, 表明其药物作用效果具有一定的可持续性. ASODN通过多种机制产生生物活性, 主要与RNaseH介导的靶mRNA水解, 以及由于mRNA-DNA异源双核酸分子所产生的空间位阻导致翻译停止有关[27]. 我们发现, 经过survivin ASODN转染后, 细胞内survivin蛋白和mRNA的表达都降低, 但较小剂量(600 g/L)的ASODN即可引起survivin蛋白表达的显著降低, 而同样剂量的ASODN还不足以引起survivin mRNA表达的显著变化, 当采用较大剂量(800 g/L以上)的ASODN时才会引起survivin mRNA表达的显著降低, 说明survivin ASODN至少在蛋白翻译及mRNA转录两个水平发挥了作用, 其作用的差异可能与ASODN的设计有关. 本实验结果表明, 针对survivin mRNA翻译起始位点设计的ASODN, 能够确实有效地封闭survivin的表达, 在1 000 g/L组, 可将survivin蛋白的表达下调84.6%, 将其mRNA的表达下调69.7%, 可用于特异性地阻断survivin表达以研究其功能并进行反义治疗.
ASODN是目前最有可能应用于临床的基因疗法[28]. 由于survivin仅特异性地表达于肿瘤组织, 在正常成人组织几乎不表达, 使得应用survivin特异性抗体免疫治疗以及反义survivin基因治疗具有良好的靶向性、特异性及安全性, 这是其特有的优点[29-30]. 我们在前期研究中发现, survivin在人肝癌组织中的表达与肝癌细胞的增生凋亡比及分化程度有关, 并可作为预后不良的重要指标[31]. 因此我们进一步研究了封闭survivin的表达对肝癌细胞的生长抑制作用, 结果发现, 采用针对survivin mRNA翻译起始位点设计的20聚ASODN, 在其有效地下调survivin mRNA及蛋白的表达的同时细胞增生活性受到了明显的抑制, 经survivin ASODN作用后细胞贴壁率呈逐渐降低的趋势, 600、800及1 000 g/L ASODN组细胞贴壁率较正常对照及SODN转染组显著降低. 此外, 反义药物作用的持续性对于评价药物作用, 特别是对于给药方案具有重要的参考价值. 实验结果表明survivin ASODN转染后的作用具有一定的持续性, 转染结束后各组细胞增生活性均有不同程度降低, 说明采用ASODN封闭survivin的表达能够确实地抑制肝癌细胞的增生活性.
在调控凋亡的基因中, survivin的抑凋亡作用在肿瘤发生发展中的作用是十分重要的.我们观察到survivin ASODN转染能够抑制肝癌细胞的生长, 由于survivin主要作为抑凋亡基因在细胞中发挥作用, 因此我们进一步研究了survivin ASODN转染对肝癌细胞的生长抑制效应是否与诱导细胞凋亡有关.采用流式细胞仪检测凋亡细胞比率, 结果发现随着survivin ASODN剂量的增加, 转染后凋亡细胞的比率逐渐增加, 较对照组有显著差异, 这也为survivin基因在肝癌细胞中发挥抑凋亡作用提供了新的证据.
编辑: N/A
| 1. | Shi M, Zhang B, Tang ZR, Lei ZY, Wang HF, Feng YY, Fan ZP, Xu DP, Wang FS. Autologous cytokine-induced killer cell therapy in clinical trial phase I is safe in patients with primary hepatocellular carcinoma. World J Gastroenterol. 2004;10:1146-1151. [PubMed] |
| 2. | Ruzzenente A, Manzoni GD, Molfetta M, Pachera S, Genco B, Donataccio M, Guglielmi A. Rapid progression of hepatocellular carcinoma after Radiofrequency Ablation. World J Gastroenterol. 2004;10:1137-1140. [PubMed] |
| 3. | Ouyang GL, Cai QF, Liu M, Chen RC, Huang Z, Jiang RS, Chen F, Hong SG, Bao SD. Growth arrest and apoptosis of human hepatocellular carcinoma cells induced by hexamethylene bisacetamide. World J Gastroenterol. 2004;10:954-958. [PubMed] |
| 4. | Wang TE, Kao CR, Lin SC, Chang WH, Chu CH, Lin J, Hsieh RK. Salvage therapy for hepatocellular carcinoma with thalidomide. World J Gastroenterol. 2004;10:649-653. [PubMed] [DOI] |
| 5. | He C, Lao WF, Hu XT, Xu XM, Xu J, Fang BL. Anti-liver cancer activity of TNF-related apoptosis-inducing ligand gene and its bystander effects. World J Gastroenterol. 2004;10:654-659. [PubMed] [DOI] |
| 6. | Gu S, Liu CJ, Qiao T, Sun XM, Chen LL, Zhang L. Inhibitory effect of antisense vascular endothelial growth factor 165 eukaryotic expression vector on proliferation of hepatocellular carcinoma cells. World J Gastroenterol. 2004;10:535-539. [PubMed] [DOI] |
| 7. | Li ZM, Liu ZC, Guan ZZ, Zhu XF, Zhou JM, Xie BF, Feng GK, Zhu ZY, Jiang WQ. Inhibition of DNA primase and induction of apoptosis by 3,3'-diethyl-9-methylthia-carbocyanine iodide in hepatocellular carcinoma BEL-7402 cells. World J Gastroenterol. 2004;10:514-520. [PubMed] [DOI] |
| 8. | Xiao EH, Li JQ, Huang JF. Effects of p53 on apoptosis and proliferation of hepatocellular carcinoma cells treated with transcatheter arterial chemoembolization. World J Gastroenterol. 2004;10:190-194. [PubMed] |
| 9. | 凌 昌全, 李 琦, 刘 晓华, 陈 庆华, 彭 永海, 罗 若茵, 黄 雪强. 经动脉灌注蜂毒素-聚乳酸/羟乙酸微球治疗大鼠肝肿瘤. 世界华人消化杂志. 2003;11:900-903. [DOI] |
| 11. | Chao JC, Chu CC. Effects of Ginkgo biloba extract on cell proliferation and cytotoxicity in human hepatocellular carcinoma cells. World J Gastroenterol. 2004;10:37-41. [PubMed] |
| 12. | Chen XP, He SQ, Wang HP, Zhao YZ, Zhang WG. Expression of TNF-related apoptosis-inducing Ligand receptors and antitumor tumor effects of TNF-related apoptosis-inducing Ligand in human hepatocellular carcinoma. World J Gastroenterol. 2003;9:2433-2440. [PubMed] |
| 13. | Li Y, Shang P, Qian AR, Wang L, Yang Y, Chen ZN. Inhibitory effects of antisense RNA of HAb18G/CD147 on invasion of hepatocellular carcinoma cells in vitro. World J Gastroenterol. 2003;9:2174-2177. [PubMed] [DOI] |
| 14. | Liu ZS, Tang SL, Ai ZL. Effects of hydroxyapatite nanoparticles on proliferation and apoptosis of human hepatoma BEL-7402 cells. World J Gastroenterol. 2003;9:1968-1971. [PubMed] [DOI] |
| 15. | Altieri DC. Survivin and apoptosis control. Adv Cancer Res. 2003;88:31-52. [PubMed] [DOI] |
| 16. | Gazzaniga P, Gradilone A, Giuliani L, Gandini O, Silvestri I, Nofroni I, Saccani G, Frati L, Aglianò AM. Expression and prognostic significance of LIVIN, SURVIVIN and other apoptosis-related genes in the progression of superficial bladder cancer. Ann Oncol. 2003;14:85-90. [PubMed] [DOI] |
| 17. | Tomizawa M, Saisho H, Tagawa M. Regulatory regions of growth-related genes can activate an exogenous gene of the alpha-fetoprotein promoter to a comparable degree in human hepatocellular carcinoma cells. Anticancer Res. 2003;23:3273-3277. [PubMed] |
| 18. | Schultz IJ, Kiemeney LA, Witjes JA, Schalken JA, Willems JL, Swinkels DW, de Kok JB. Survivin mRNA expression is elevated in malignant urothelial cell carcinomas and predicts time to recurrence. Anticancer Res. 2003;23:3327-3331. [PubMed] |
| 19. | Pennati M, Binda M, Colella G, Zoppe' M, Folini M, Vignati S, Valentini A, Citti L, De Cesare M, Pratesi G. Ribozyme-mediated inhibition of survivin expression increases spontaneous and drug-induced apoptosis and decreases the tumorigenic potential of human prostate cancer cells. Oncogene. 2004;23:386-394. [PubMed] [DOI] |
| 20. | Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene. 2003;22:8581-8589. [PubMed] [DOI] |
| 21. | Altieri DC. Survivin in apoptosis control and cell cycle regulation in cancer. Prog Cell Cycle Res. 2003;5:447-452. [PubMed] |
| 22. | Yang JH, Zhang YC, Qian HQ. Survivin antisense oligodeoxynucleotide inhibits growth of gastric cancer cells. World J Gastroenterol. 2004;10:1121-1124. [PubMed] |
| 23. | Chang Q, Liu ZR, Wang DY, Kumar M, Chen YB, Qin RY. Survivin expression induced by doxorubicin in cholangiocarcinoma. World J Gastroenterol. 2004;10:415-418. [PubMed] |
| 24. | Zhu XD, Lin GJ, Qian LP, Chen ZQ. Expression of survivin in human gastric carcinoma and gastric carcinoma model of rats. World J Gastroenterol. 2003;9:1435-1438. [PubMed] [DOI] |
| 25. | Lin LJ, Zheng CQ, Jin Y, Ma Y, Jiang WG, Ma T. Expression of survivin protein in human colorectal carcinogenesis. World J Gastroenterol. 2003;9:974-977. [PubMed] [DOI] |
| 26. | Holmlund JT. Applying antisense technology: Affinitak and other antisense oligonucleotides in clinical development. Ann N Y Acad Sci. 2003;1002:244-251. [PubMed] |
| 27. | Opalinska JB, Gewirtz AM. Therapeutic potential of antisense nucleic acid molecules. Sci STKE. 2003;2003:pe47. [PubMed] [DOI] |
| 28. | Alama A, Barbieri F, Cagnoli M, Schettini G. Antisense oligonucleotides as therapeutic agents. Pharmacol Res. 1997;36:171-178. [PubMed] [DOI] |
| 29. | Olie RA, Simões-Wüst AP, Baumann B, Leech SH, Fabbro D, Stahel RA, Zangemeister-Wittke U. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy. Cancer Res. 2000;60:2805-2809. [PubMed] |