修回日期: 2004-03-10
接受日期: 2004-03-24
在线出版日期: 2004-07-15
目的: 通过腺病毒增强的转铁蛋白受体介导法(AVET)将针对突变型p53(mtp53)的大酶(Maxizyme)基因转入肝癌细胞后对肝癌细胞凋亡的影响, 探索AVET用于肝癌基因治疗的可行性, 为肝癌的基因治疗探索一条新途径.
方法: 以带有mtp53基因的人肝癌细胞株MHCC97细胞为模型, 用腺病毒增强转铁蛋白受体介导法将针对mtp53的pEGFP-Maxizyme基因和空载体pEGFP分别导入MHCC97细胞, 荧光显微镜观察细胞转染情况, 逆转录聚合酶链反应(RT-PCR)检测mtp53 mRNA表达水平的变化, DNA琼脂糖凝胶电泳和流式细胞仪检测转染后对细胞凋亡的影响.
结果: 转染后48 h荧光显微镜下可见呈细胞形态的绿色荧光. 收集细胞检测, 实验组mtp53 mRNA表达水平与空载体组和空白对照组相比, 基因扩增条带亮度明显减弱, mRNA表达水平下降(P<0.05); DNA琼脂糖凝胶电泳出现典型的凋亡梯带(DNA Ladder); 流式细胞仪分析显示细胞凋亡水平增高, 凋亡指数22.95%, 显著高于对照组的2.37%(P<0.05).
结论: 腺病毒增强转铁蛋白受体介导的基因转移系统可将pEGFP-Maxizyme有效的转染到肝癌细胞株MHCC97中, Maxizyme在细胞内成功的切割了mtp53 mRNA, 促进了肝癌细胞的凋亡, 这为腺病毒增强转铁蛋白受体介导法在肝癌基因治疗中的应用提供了实验依据, 也为肝癌的基因治疗提供了一条新途径.
引文著录: 沈霞, 林菊生, 孔心涓. 腺病毒增强转铁蛋白受体介导的针对突变型p53的大酶转染可促进肝癌细胞凋亡. 世界华人消化杂志 2004; 12(7): 1539-1542
Revised: March 10, 2004
Accepted: March 24, 2004
Published online: July 15, 2004
AIM: To evaluate the influence of introduction of maxizyme against mtp53 by adenovirus enhanced transferrin receptor-mediated gene delivery system on MHCC97 cells.
METHODS: Hepatoma cell line MHCC97 containing mutated p53 gene was served as a model. The maxizyme against mtp53 was transfected to the cells by adenovirus enhanced transferrin receptor-mediated gene delivery system. The level of mtp53-mRNA was detected by means of semi-quantitative reverse transcription polymerase chain reaction (RT-PCR). The apoptosis of the hepatoma cells was measured by DNA ladder assay and FCM.
RESULTS: After 48 hours of transfection by AVET system, RT-PCR results indicated the expression of mtp53 mRNA in pEGFP-Maxizyme group was significantly lower than that in control group. And DNA "ladder" with agarose gel electrophoresis was observed in pEGFP-maxizyme group. The result of flow cytometry exhibited apoptotic index in pEGFP-maxizyme group was 22.95%, which was higher than those in blank control group and pEGFP group.
CONCLUSION: The recombinant ribozyme cDNA eukaryotic expression vector pEGFP-maxizyme can be efficiently transfected into MHCC97 cell by adenovirus enhanced transferrin receptor-mediated gene delivery system and the expression of maxizyme may inhibit the mtp53 gene expression and promote apoptosis of MHCC97 cells. The AVET system may be a useful tool in gene delivery for gene therapy of human HCC.
- Citation: Shen X, Lin JS, Kong XJ. Maxizyme against mtp53 transfected by adenovirus enhanced transferrin receptor-mediated gene delivery systeminduced apoptosis of hepatoma cells. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1539-1542
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1539.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1539
p53基因是人类恶性肿瘤中总突变率最高的基因之一, 其发生率在30%-70%之间[1-3]. 在肝癌中p53突变率约为50%[4-7]. 野生型p53是一种重要的抑癌基因, 被认为是"基因组的保护者". 其功能主要是参与细胞周期调控、DNA损伤修复[8]. 肿瘤的发生是由于细胞增生与细胞凋亡平衡失调的结果, 细胞凋亡在肝细胞癌生长过程中起负调控作用, 具有阻遏肿瘤生长的作用. 近年来, 人们发现, p53基因与细胞凋亡有密切关系, 野生型 p53与突变型p53基因均参与细胞凋亡调节, 但二者作用不同, 野生型p53诱导细胞凋亡发生, 而突变型p53对凋亡有抑制作用[9]. 我们设计合成了一种针对突变型p53的核酶基因, 构建了其真核表达质粒, 并且已在细胞外证明了其可以成功的切割靶RNA分子[10]. 本实验用腺病毒增强的转铁蛋白受体介导法(AVET)将此基因转入人肝癌细胞MHCC97细胞中, 观察其促进肝癌细胞凋亡的作用, 为AVET系统在肝癌基因治疗中的应用提供实验依据, 也为肝癌的基因治疗提供一条新途径.
人肝癌细胞株MHCC97购自复旦大学肝癌研究所, 大肠杆菌DH5本室保存, pEGFP-Maxizyme 质粒本室构建, 具体方法见文献[10]. 腺病毒增强的转铁蛋白受体介导的基因转染试剂盒为Bender公司产品, 质粒小提试剂盒、RT-PCR试剂盒为TakaRa公司产品, 胎牛血清为Hyclone公司产品, DMEM培养基为Gibco公司产品, DNA maker购自晶美公司.
1.2.1 质粒的扩增和提取: 制备感受态细菌DH5, 核酶质粒pEGFP-Maxizyme和对照空载体pEGFP分别转化大肠杆菌DH5, 卡那霉素筛选, 培养细菌, 按质粒小抽试剂盒说明书进行质粒小量抽提.
1.2.2 MHCC97细胞培养及基因转染: 人MHCC97肝癌细胞株培养在含10%胎牛血清的DMEM培养基中, 置37 ℃, 5% CO2培养箱, 待细胞长至对数生长期, 接种至24孔板, 每孔接种2×105细胞, 待细胞贴壁, 长至50%-80%融合时按腺病毒增强转铁蛋白受体介导基因转染试剂盒说明书进行基因转染, 具体方法如下: (1)3 L生物素化的腺病毒加入100 L HBS缓冲液中, 6 L抗生蛋白链菌素-赖氨酸加入100 L HBS缓冲液中, 将二者充分混匀后室温下静置20 min. (2) 6 g DNA质粒加入150 L HBS中, 再加入上述溶液中, 混匀后室温下静置20 min以形成复合物. (3) 6 L转铁蛋白-聚赖氨酸加入150 L HBS中后, 再加入上述溶液中. 在加至细胞前将DNA复合物在室温下孵育30 min. 实验分3组, 1组核酶基因pEGFP-Maxizyme转染组, 1组空载体pEGFP组, 1组空白对照组. 转染后48 h进行各项指标的检测, 每组设3个复孔.
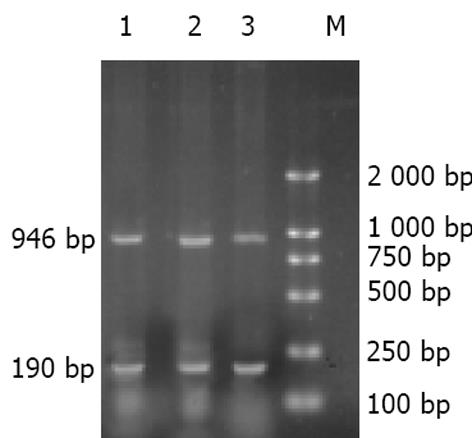
1.2.3 逆转录PCR检测突变型p53基因的表达: 转染后48 h, 分别收集转染核酶pEGFP-Maxizyme和空载体pEGFP的细胞, 按照Trizol试剂说明书步骤提取总RNA. 取1 g总RNA, 设计合成p53的两条特异性引物, 上游引物 5'-GATTCTCTTCCTCTGTGC-3', 下游引物 5'-CTTTCCACGACGGTGACA-3', 2-microglobulin作为内参照, 其引物序列: 上游引物: 5'-TACTCTCTCTTTCTG GCCTG-3', 下游引物: 5'-GACAAGTCTGAATGCTCCAC-3', 扩增片断分别946 bp和190 bp. 10×RT Buffer 2 L, 25 mmoL/L的MgCl2 4 L, 10 mmoL/L dNTP 2 L, 40 U/ L的RNasin 0.5 L, 2.5 pmoL/L 的oLigodT 1 L, 5U/ L的M-MLV RT 1 L, DEPC水补至20 L. 42 ℃逆转录30 min, 99 ℃灭活5 min. 取上述cDNA 20 L, 加入10×Buffer 8 L, 25 mmoL/L的MgCl2 6 L, 引物各1 L, 混匀后94 ℃, 2 min热启动, 加Taq 1 L, 总体积100 L. 扩增条件: 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸1 min, 35个循环, 72 ℃补偿10 min. 取PCR产物10 L, 于10 g/L琼脂糖凝胶上电泳(含0.5 mg/L溴化乙锭), 凝胶图像吸光密度分析系统进行PCR产物条带扫描定量分析.
1.2.4 流式细胞仪分析: 收集上述各组处理后的细胞以PBS清洗, 加入70%乙醇吹打成单细胞悬液4 ℃下置24 h, 然后离心, 洗涤细胞后用PI染色, 4 ℃下置30 min后上机检测. 采用Beckon/DickonsonFacssort型流式细胞仪, 在 488 nm波长处进行检测, 应用相应程序软件进行资料的处理和分析, 细胞凋亡指数(AI) =亚2倍峰细胞数/总细胞数×100%.
1.2.5 DNA凝胶电泳检测细胞凋亡: 分别取转染核酶pEGFP-Maxizyme组、空载体pEGFP组和空白对照组的细胞, 均用10 g/mL的DDP作用48 h后提取细胞总DNA, 2%凝胶电泳, 结果录入计算机.
统计学处理 以上实验均重复3次. 采用SAS软件进行t检验, P<0.05有统计学意义.
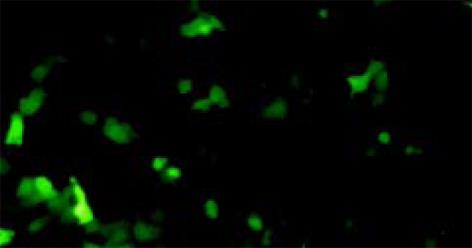
转染后48 h, 用荧光显微镜观察, 可见呈细胞形态的绿色荧光, 表明质粒成功的转染到细胞. 转染效率约为70%. (图1)
未做处理的MHCC97细胞平均mtp53/2-microglobulin为1.46±0.16, pEGFP组细胞为1.48±0.11, pEGFP-Maxizyme组细胞为0.98±0.14. 经pEGFP-Maxizyme作用的细胞mtp53 mRNA表达明显减弱, 与转染空载体pEGFP的细胞及空白对照组细胞比较mtp53的水平有显著性差异(P<0.05), 而转染pEGFP者与空白对照组的mtp53 mRNA表达无明显差异(P>0.05). (见图2).
流式细胞仪分析显示pEGFP-Maxizyme组细胞凋亡率为22.95%, pEGFP组细胞凋亡率为3.35%, 空白对照组细胞凋亡率为2.37%. pEGFP-Maxizyme组较pEGFP组细胞凋亡率明显增高.
pEGFP-Maxizyme转染MHCC97 细胞48 h后, DNA琼脂糖凝胶电泳出现长短不一的"梯状"改变. 而转染空载体的对照组未出现梯状改变(图3).
核酶是一类具有生物催化活性的RNA分子, 他能够定点切割mRNA靶分子, 从而阻断有害基因的表达, 广泛的应用于肿瘤和病毒性疾病的基因治疗[11]. 其中应用最广泛的是锤头状核酶. 锤头状核酶包括由茎-Ⅱ连接的两个保守区段以及与特异性底物结合的侧翼序列, 其适合的切割位点是GUC、GUU、GUA和UUC.由于对切割位点的选择, 在一定范围内限制了锤头状核酶的应用. 1992年, McCall用短核苷酸链替代茎-Ⅱ, 并发现这一变短的核酶仍保持原有的切割活性, 命名为小酶(Minizyme)[12-13]. 两个小酶聚合形成同二聚体或异二聚体结构, 称为大酶(Maxizyme)[14]. 大酶发现后主要用于嵌合基因及突变基因所致疾病的治疗, 也可用于切割没有常规锤头状核酶合适切割位点的靶RNA分子. 在肝癌中, p53基因突变发生率较高. 突变型p53不仅丧失了抑癌基因的功能, 而且成为一种癌基因. P53基因突变的热点是249位密码子[15-16]. 本实验应用的人工合成的抗mtp53mRNA的Maxizyme可在249位密码子处切断mtp53mRNA, 从而阻断其表达[10].
要想将核酶技术应用于肝癌的基因治疗, 关键还在于如何将核酶基因特异性的导入肝癌细胞以发挥作用. 近年受体介导的基因转移系统因其靶向性好、安全、无毒和外源基因容量大而受到广泛的关注[17-23]. 受体介导的基因转移是将目的基因通过多聚赖氨酸等多聚阳离子与配体连接, 通过配体与细胞表面的特异性受体结合, 以受体介导的内吞作用将目的基因转入细胞[24-25]. 人转铁蛋白受体为Ⅱ型膜蛋白, 通过结合和内化将血浆中的转铁蛋白摄取入细胞. 由于快速生长对铁的需求量增加, 肿瘤细胞往往都过度表达转铁蛋白受体. 研究表明在乳腺癌、黑色素瘤、肝癌、白血病等恶性肿瘤细胞中有大量转铁蛋白受体的表达, 转铁蛋白受体可以作为肿瘤基因治疗中的靶[26-28]. 然而, 配体-DNA复合物进入细胞后, 外源DNA极易被溶酶体酶降解而使外源DNA的表达效率相对较低. 为了提高外源DNA的表达效率, 一些研究者将复制缺陷的腺病毒与连接于目的基因-配体复合物连接, 利用腺病毒衣壳蛋白的膜不稳定作用, 可使基因的转染效率提高至近100%[29-30]. 我们利用腺病毒增强的转铁蛋白受体介导的基因转移系统将pEGFP-Maxizyme转入肝癌细胞株中. 转基因后, 在荧光显微镜下观察到细胞发出绿色荧光, 转染效率约为70%, RT-PCR证实Maxizyme在细胞内成功的切割了mtp53.
细胞凋亡又称细胞程序性死亡, 近年来的研究证明, 细胞凋亡的紊乱与肿瘤发生和发展关系十分密切, 如果受损的细胞不能正确启动凋亡机制, 机体内细胞增生与凋亡二者间的平衡遭到破坏, 使细胞过度增生, 就有可能导致肿瘤的发生. 异常的细胞凋亡的抑制不仅在恶性肿瘤的形成中有重要作用, 而且参与恶性肿瘤进展. 诱导肿瘤细胞凋亡已成为目前治疗恶性肿瘤的一项重要生物学策略, 许多抗肿瘤药物及放疗均是通过启动细胞凋亡机制完成的. 在本实验中, 利用腺病毒增强的转铁蛋白受体介导的基因转移系统将pEGFP-Maxizyme转入肝癌细胞后, Maxizyme在细胞内成功的切割了mtp53mRNA, DNA凝胶电泳和流式细胞仪检测均显示转染核酶的细胞出现了明显的凋亡, 而对照组细胞未出现凋亡.
我们的实验结果表明腺病毒增强转铁蛋白受体介导的基因转移系统可以将pEGFP-Maxizyme有效的转染入肝癌细胞株MHCC97中, Maxizyme在细胞内成功的切割了mtp53 mRNA, 促进了肝癌细胞的凋亡, 这为腺病毒增强转铁蛋白受体介导法在肝癌基因治疗中的应用提供了实验依据, 也为肝癌的基因治疗提供了一条新途径.
编辑: N/A
| 1. | Dillon DA, Hipolito E, Zheng K, Rimm DL, Costa JC. p53 mutations as tumor markers in fine needle aspirates of palpable breast masses. Acta Cytol. 2002;46:841-847. [PubMed] [DOI] |
| 2. | Kim SS, Bhang CS, Min KO, Chae HS, Choi SW, Lee CD, Lim KW, Chung IS, Park DH. p53 mutations and microsatellite instabilities in the subtype of intestinal metaplasia of the stomach. J Korean Med Sci. 2002;17:490-496. [PubMed] [DOI] |
| 3. | Sakuragi N, Hirai A, Tada M, Yamada H, Yamamoto R, Fujimoto S, Moriuchi T. Dominant-negative mutation of p53 tumor suppressor gene in endometrial carcinoma. Gynecol Oncol. 2001;83:485-490. [PubMed] [DOI] |
| 4. | Kang G, Fang Z, Volkmann M. [Study on p53 gene mutation in hepatocellular carcinoma patients in China]. Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. 2001;15:163-165. [PubMed] |
| 5. | Cengiz C, Akarca US, Goker E, Yuce G. Detection of mutant p53 in hepatocellular cancer from Turkey and its correlation with clinicopathologic parameters. Dig Dis Sci. 2003;48:865-869. [PubMed] [DOI] |
| 6. | Sheen IS, Jeng KS, Wu JY. Is p53 gene mutation an indicatior of the biological behaviors of recurrence of hepatocellular carcinoma? World J Gastroenterol. 2003;9:1202-1207. [PubMed] [DOI] |
| 7. | Hsia CC, Kleiner DE Jr, Axiotis CA, Di Bisceglie A, Nomura AM, Stemmermann GN, Tabor E. Mutations of p53 gene in hepatocellular carcinoma: roles of hepatitis B virus and aflatoxin contamination in the diet. J Natl Cancer Inst. 1992;84:1638-1641. [PubMed] [DOI] |
| 8. | Levine AJ. p53, the cellular gatekeeper for growth and division. Cell. 1997;88:323-331. [PubMed] [DOI] |
| 9. | Rahko E, Blanco G, Soini Y, Bloigu R, Jukkola A. A mutant TP53 gene status is associated with a poor prognosis and anthracycline-resistance in breast cancer patients. Eur J Cancer. 2003;39:447-453. [PubMed] [DOI] |
| 10. | Kong XJ, Song YH, Lin JS, Huang HJ, Wang NX, Liu NZ, Li B, Jin YX. Maxizyme-mediated specific inhibition on mutant-type p53 in vitro. World J Gastroenterol. 2003;9:1571-1575. [PubMed] [DOI] |
| 11. | Sullenger BA, Gilboa E. Emerging clinical applications of RNA. Nature. 2002;418:252-258. [PubMed] [DOI] |
| 12. | McCall MJ, Hendry P, Lockett TJ. Minimized hammerhead ribozymes. Methods Mol Biol. 1997;74:151-159. [PubMed] [DOI] |
| 13. | Sugiyama H, Hatano K, Saito I, Amontov S, Taira K. Catalytic activities of hammerhead ribozymes with a triterpenoid linker instead of stem/loop II. FEBS Lett. 1996;392:215-219. [PubMed] [DOI] |
| 14. | Nakayama A, Warashina M, Kuwabara T, Taira K. Effects of cetyltrimethylammonium bromide on reactions catalyzed by maxizymes, a novel class of metalloenzymes. J Inorg Biochem. 2000;78:69-77. [PubMed] [DOI] |
| 15. | Jackson PE, Kuang SY, Wang JB, Strickland PT, Muñoz A, Kensler TW, Qian GS, Groopman JD. Prospective detection of codon 249 mutations in plasma of hepatocellular carcinoma patients. Carcinogenesis. 2003;24:1657-1663. [PubMed] [DOI] |
| 16. | Qian GS, Kuang SY, He X, Groopman JD, Jackson PE. Sensitivity of electrospray ionization mass spectrometry detection of codon 249 mutations in the p53 gene compared with RFLP. Cancer Epidemiol Biomarkers Prev. 2002;11:1126-1129. [PubMed] |
| 17. | Guy J, Drabek D, Antoniou M. Delivery of DNA into mammalian cells by receptor-mediated endocytosis and gene therapy. Mol Biotechnol. 1995;3:237-248. [PubMed] [DOI] |
| 18. | Phillips SC. Receptor-mediated DNA delivery approaches to human gene therapy. Biologicals. 1995;23:13-16. [PubMed] [DOI] |
| 19. | Michael SI, Curiel DT. Strategies to achieve targeted gene delivery via the receptor-mediated endocytosis pathway. Gene Ther. 1994;1:223-232. [PubMed] |
| 20. | Takayanagi A, Chen J, Gamou S, Shimizu N. [Targeting delivery of therapeutic genes using monoclonal antibody; immunogene approach]. Nihon Rinsho. 1998;56:731-736. [PubMed] |
| 21. | Kato Y, Sugiyama Y. Targeted delivery of peptides, proteins, and genes by receptor-mediated endocytosis. Crit Rev Ther Drug Carrier Syst. 1997;14:287-331. [PubMed] [DOI] |
| 22. | Ginobbi P, Geiser TA, Ombres D, Citro G. Folic acid-polylysine carrier improves efficacy of c-myc antisense oligodeoxynucleotides on human melanoma (M14) cells. Anticancer Res. 1997;17:29-35. [PubMed] |
| 23. | Junbo H, Li Q, Zaide W, Yunde H. Receptor-mediated interleukin-2 gene transfer into human hepatoma cells. Int J Mol Med. 1999;3:601-608. [PubMed] [DOI] |
| 24. | Lee H, Kim TH, Park TG. A receptor-mediated gene delivery system using streptavidin and biotin-derivatized, pegylated epidermal growth factor. J Control Release. 2002;83:109-119. [PubMed] [DOI] |
| 25. | Takakura Y, Nishikawa M, Yamashita F, Hashida M. Influence of physicochemical properties on pharmacokinetics of non-viral vectors for gene delivery. J Drug Target. 2002;10:99-104. [PubMed] [DOI] |
| 26. | Park KS, Kim H, Kim NG, Cho SY, Choi KH, Seong JK, Paik YK. Proteomic analysis and molecular characterization of tissue ferritin light chain in hepatocellular carcinoma. Hepatology. 2002;35:1459-1466. [PubMed] [DOI] |
| 27. | Pascale RM, De Miglio MR, Muroni MR, Simile MM, Daino L, Seddaiu MA, Pusceddu S, Gaspa L, Calvisi D, Manenti G. Transferrin and transferrin receptor gene expression and iron uptake in hepatocellular carcinoma in the rat. Hepatology. 1998;27:452-461. [PubMed] [DOI] |
| 28. | Yang DC, Jiang XP, Elliott RL, Head JF. Inhibition of growth of human breast carcinoma cells by an antisense oligonucleotide targeted to the transferrin receptor gene. Anticancer Res. 2001;21:1777-1787. [PubMed] |
| 29. | Fisher KJ, Wilson JM. Biochemical and functional analysis of an adenovirus-based ligand complex for gene transfer. Biochem J. 1994;299:49-58. [PubMed] [DOI] |
| 30. | Wollenberg B, Schmidt W, Schmitt B, Lang S, Zeidler R. [Receptor mediated gene transfer in squamous epithelial carcinoma of the head-neck area]. Laryngorhinootologie. 1997;76:411-414. [PubMed] [DOI] |