修回日期: 2004-03-09
接受日期: 2004-03-24
在线出版日期: 2004-06-15
目的: 通过检测结直肠癌患者血清E-钙黏附素(E-Cd)浓度和组织E-Cd的mRNA水平, 探讨E-Cd与结直肠癌浸润和转移的关联性.
方法: 应用酶联免疫黏附方法测定 28例结直肠癌患者血清可溶性E-Cd浓度; 应用点杂交法和计算机灰度扫描分析组织的mRNA灰度均值.
结果: 结直肠癌组血清E-Cd浓度显著高于对照组(P<0.001), Dukes C组或有淋巴结转移组明显高于Dukes A、B组或无淋巴结转移组(P均< 0.05), 切除瘤体后上述各组的血清E-Cd浓度均明显下降(P<0.01-0.05). 各组的组织E-Cd mRNA均值变化与血清E-Cd浓度的一致, 且两指标间具有明显的相关性(P<0.05).
结论: 血清、组织E-Cd可能与人结直肠癌的浸润深度和淋巴结转移密切相关.
引文著录: 蔡诚忠, 许洪卫, 童晓晨. 组织E-钙黏附素变化与结直肠癌根治手术的关系. 世界华人消化杂志 2004; 12(6): 1481-1483
Revised: March 9, 2004
Accepted: March 24, 2004
Published online: June 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1481-1483
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1481.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1481
E-钙黏附素(epithelial cadherin, E-Cd)又称上皮钙黏附素, 属钙黏附素超家族经典亚族成员[1], 他的表达程度与功能活性状态直接影响着肿瘤细胞的脱离和再附着(1)本文通过检测结直肠癌患者血清E-Cd浓度和组织E-Cd的mRNA水平, 旨在探讨结直肠癌侵袭性和根治手术对E-Cd水平的影响.
选择确诊的结直肠癌患者28例, 据病理报告和手术中探查结果, 按 Dukes分期和淋巴结转移情况分组(见表1). 所有患者术前检查未发现心、肝、肺、肾等重要脏器的器质性病变, 由同一组医师施行结直肠癌根治术. 术前和术后1 wk未行放疗、化疗或生物治疗. 另择34名健康献血员作为对照组. 所有被检者年龄在78-31岁之间, 男女比为2:1, 各组间的年龄均数均无显著性差异 (P>0.05). 结直肠癌组取样时间为术前1 wk内、术后5-7 d.
| 项目 | n | 术前 | 术后 | |
| 对照组 | 34 | 3.73±0.75 | ||
| 结直肠癌组 | 28 | 8.91±1.65 | P <0.01 | 5.17±1.81 |
| 临床分期Dukes C | 17 | 9.83±1.37 | P <0.01 | 5.69±0.95 |
| P<0.05 | P>0.05 | |||
| Dukes A、B | 11 | 7.49±1.07 | P <0.05 | 4.37±0.87 |
| 有淋巴结转移组 | 15 | 10.65±1.48 | P <0.01 | 5.38±1.19 |
| P<0.05 | P>0.05 | |||
| 无淋巴结转移组 | 13 | 6.90±1.19 | P <0.05 | 4.93±0.79 |
取被检者的空腹周边静脉血3 mL, 用酶联免疫黏附法(ELISA)复管测定血清E-Cd ,其检测药盒购自Sigma 公司, 具体方法参见Chan et al[2]报道. 取新鲜结直肠癌及距癌边缘5 cm以上的非肿瘤组织标本, 经液氮速冻后置-80 ℃保存; 异硫氰酸胍一步法抽提组织RNA, 以人类E-Cd cDNA(地高辛标记)探针作点杂交(dot blot)分析, 所得结果经计算机灰度扫描并自动测算出每个斑点的平均灰度均值(反映mRNA相对水平). 所有数据以mean±SD表示, 用t检验等进行统计处理.
术前结直肠癌组血清E-Cd浓度显著高于对照组(P < 0.001), Dukes C组或有淋巴结转移组分别明显高于Dukes A、B组或无淋巴结转移组(P均< 0.05); 结直肠癌患者术后各组的血清E-Cd浓度均明显低于术前(P<0.01- 0.05), 但各组间的差异无显著意义(P>0.05), 术后结直肠癌组血清E-Cd浓度与对照组亦无明显统计学差异(P>0.05), 见(表1).
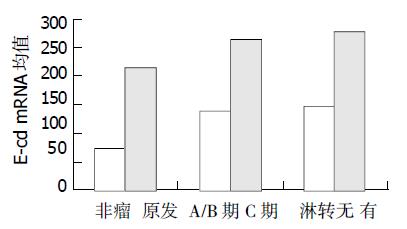
结直肠癌组(原发灶)的E-Cd mRNA灰度均值(215±47)明显高于非肿瘤组织组(71±19, n = 28, P<0.01, 后同), Dukes C组(265±59)或伴有淋巴结转移组(280±65)分别明显高于Dukes A、B组(138±39)或无淋巴结转移组(147±43, P均<0. 05), 见(图1).结直肠癌组织E-Cd mRNA水平与血清E-Cd浓度之间具有明显的正相关性(r = 0.782, P<0.05).
肿瘤浸润、转移等恶性表型系瘤细胞与细胞外基质相互作用的结果, 其关键步骤是瘤细胞脱离原发灶并再附着转移部位. E-Cd等钙黏附素主要介导正常和肿瘤组织中细胞与细胞间的黏附[3]. 目前对E-Cd表达的研究涉及多种人体肿瘤, 包括结直肠癌、肝癌、乳腺癌、前列腺癌等[4]. 尤其是国外一些研究小组据业与购建的E-Cd cDNA文库, 采用先进的分子生物学方法, 对结直肠癌等恶性肿瘤所进行的一系列实验和临床研究表明, E-Cd失活或基因突变与其侵袭性密切相关[4].
血清可溶性E-Cd系细胞内E-Cd的降解物, 是一种分子量为80 kDa的多肽. 他存在于正常人的血循环中, 文献报道其浓度为2.5-5.6 mg/L之间; 但恶性肿瘤患者中的浓度明显升高, 介于4.7-9.3 mg/L之间[2]. 有关结直肠癌患者的血清E-Cd浓度检测, 所见报道不多[5]. 本研究结直肠癌组的E-Cd浓度(8.91±1.65 mg/L)显著高于对照组(3.73±0.75 mg/L), Dukes C组或有淋巴结转移组血清E-Cd浓度明显高于Dukes A、B组或无淋巴结转移组, 切除原发灶后上述两组的指标均明显下降, 提示血清E-Cd浓度可能与人结直肠癌的浸润深度和淋巴结转移密切相关. 与Chan et al[2]对胃癌的研究结果一致, 他们发现胃癌患者血清可溶性E-Cd浓度的对数均值显著高于对照组, 且该指标的升高与胃癌的生长方式和远处转移密切相关.
一般将原发灶E-Cd的表达状况归结为4种类型[4]: (1)全部瘤细胞同质性地显著表达E-Cd; (2)瘤体内局灶性减低表达使E-Cd表达呈异质性分布, 或瘤体内均匀性降低; (3)E-Cd表达完全缺失; (4) 瘤细胞虽然能表达E-Cd却未能相互黏附. 大多数肿瘤属于前两型. 本文采用的点杂交法测定组织E-Cd mRNA的相对水平, 较免疫组化法更能反映E-Cd的生物活性. 所得结果表明, Dukes C型或伴有淋巴结转移的原发灶, 其 E-Cd mRNA表达水平分别明显高于Dukes A、B型或无淋巴结转移者. 提示原发灶E-Cd表达水平也影响着结直肠癌的浸润深度和淋巴结转移. 与文献[6]报道一致, 该文作者们应用免疫组化和原位杂交两种方法, 对30例散发性结直肠癌标本同时检测后发现, 无论是E-Cd的蛋白质表达还是mRNA表达水平, 其原发灶均较非肿瘤组织明显升高. 但有作者认为, 人和鼠结直肠癌组织中经免疫组化检测的E-Cd表达明显降低, 且与Dukes分期无关[7] ; 另一组作者则发现, 不仅原发灶E-Cd表达明显降低, 而且转移性淋巴结和肝转移灶中的E-Cd表达明显增强[8]. 造成上述相反结论的原因尚不明了, 可能与检测方法不同有关.
鉴于血清E-Cd浓度和组织E-Cd表达水平与结直肠癌的侵袭性密切相关, 并且健康对照者的血清E-Cd浓度明显低于结直肠癌患者、以及邻近非肿瘤组织的E-Cd mRNA水平显著低于结直肠癌组织. 作者认为, 全面分析纤维结肠镜活检组织或结直肠癌标本mRNA水平, 同时结合检测血清E-Cd浓度, 可能有助于评估结直肠癌的恶性演进状态, 对该类患者的早期诊断、综合治疗和预后具有重要的指导意义. 但E-Cd是否与结直肠癌特异性相关, 以及E-Cd能否成为特异性肿瘤标记物, 尚需从E-Cd的分子生物学等多方面作深入的探讨[7-8].
| 2. | Chan AO, Lam SK, Chu KM, Lam CM, Kwok E, Leung SY, Yuen ST, Law SY, Hui WM, Lai KC. Soluble E-cadherin is a valid prognostic marker in gastric carcinoma. Gut. 2001;48:808-811. [PubMed] [DOI] |
| 5. | Velikova G, Banks RE, Gearing A, Hemingway I, Forbes MA, Preston SR, Hall NR, Jones M, Wyatt J, Miller K. Serum concentrations of soluble adhesion molecules in patients with colorectal cancer. Br J Cancer. 1998;77:1857-1863. [PubMed] [DOI] |
| 6. | El-Bahrawy MA, Poulsom R, Jeffery R, Talbot I, Alison MR. The expression of E-cadherin and catenins in sporadic colorectal carcinoma. Hum Pathol. 2001;32:1216-1224. [PubMed] [DOI] |
| 7. | Sloncová E, Fric P, Kucerová D, Lojda Z, Tuhácková Z, Sovová V. Changes of E-cadherin and beta-catenin in human and mouse intestinal tumours. Histochem J. 2001;33:13-17. [PubMed] [DOI] |
| 8. | Ikeguchi M, Makino M, Kaibara N. Clinical significance of E-cadherin-catenin complex expression in metastatic foci of colorectal carcinoma. J Surg Oncol. 2001;77:201-207. [PubMed] [DOI] |