修回日期: 2004-05-09
接受日期: 2004-05-16
在线出版日期: 2004-06-15
目的: 探讨原发性肝癌患者外周血树突状细胞(DC)体外经自体肝癌细胞抗原致敏后, 对特异性细胞毒T淋巴细胞(CTL)的诱导作用.
方法: 肝癌患者外周血经梯度密度离心法分离, 获得DC前体细胞, 用重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)和重组人白介素-4(rhIL-4)联合培养, 诱导扩增DC.制备自体肝癌细胞抗原, 体外脉冲DC, 检测DC诱导自体T细胞增生能力及特异性CTL在体外对自体肝癌细胞的杀伤活性.
结果: 经自体肝癌细胞抗原致敏的DC能诱导较强的自体T细胞增生, 且能诱导特异性CTL, 该CTL对自体肝癌细胞具有很强的杀伤活性, 杀伤率明显高于DC、未经肝癌细胞抗原致敏的DC激活的CTL及T淋巴细胞的杀伤率, 而对CT26细胞、BEL-7402细胞无明显的杀伤作用.
结论: 肝癌患者外周血DC体外能诱导高效而特异的抗肝癌免疫, 提示DC可能在肿瘤治疗及预防其复发与转移中发挥重要作用.
引文著录: 谢裕安, 罗小玲, 梁安民, 匡志鹏, 吴继宁. 肝癌细胞抗原致敏树突状细胞体外诱导特异性细胞毒T淋巴细胞. 世界华人消化杂志 2004; 12(6): 1479-1481
Revised: May 9, 2004
Accepted: May 16, 2004
Published online: June 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1479-1481
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1479.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1479
免疫治疗是现代肿瘤综合治疗的一种重要手段. 随着肿瘤免疫理论的突破和分子生物学技术的发展, 提出了肿瘤疫苗的概念, 其基本策略是通过肿瘤抗原特异性细胞毒性T细胞(CTL)的激活而诱导抗肿瘤的免疫反应.现已制备了肿瘤细胞疫苗、肿瘤核酸疫苗、肿瘤基因工程疫苗等, 但这些疫苗的一个共同弱点是不能刺激有效的T细胞介导的免疫反应, 这表明抗肿瘤免疫反应不是由肿瘤细胞直接提呈给未致敏的T细胞, 而是先转移肿瘤抗原给抗原提呈细胞(APC), 再由APC激活免疫系统. 树突状细胞(dendritic, DC)是抗原提呈功能最强的APC, 也是目前发现的惟一能激活初始型T细胞增生并建立初级免疫反应的细胞, 在启动抗肿瘤免疫反应中起关键作用[1-5]. 我们在原发性肝癌患者外周血DC经自体肝癌细胞抗原激活后, 观察其在体外能否刺激自体T细胞增生和诱导的肿瘤特异性CTL细胞毒活性, 为临床应用DC免疫治疗肝癌提供实验依据.
rhGM-CSF、rhIL-4、丝裂霉素C购自Sigma公司; 抗人CD83McAb购自PharMingen公司; 淋巴细胞分离液为上海生化试剂二厂产品; RPMI-1640细胞培养基、T细胞尼龙毛柱购自美国GIBICO公司; 3H-TdR购自北京原子能研究所; 乳酸脱氢酶(LDH) 4h释放法杀伤活性测定试剂盒为美国Promega公司生产. CT26人结肠癌细胞、BEL-7402 人肝癌细胞由本室传代培养. 临床确诊的原发性肝癌患者10例, 男8例, 女2例, 年龄30-65岁, 平均47.5岁, 均未接受过任何抗肿瘤治疗.手术当天术前抽取外周静脉血, 用于分离、纯化外周血单个核细胞(PBMC)和T淋巴细胞.
1.2.1 分离、纯化肝癌患者外周血PBMC和T淋巴细胞: 取肝癌患者抗凝外周全血用常规密度梯度离心法分离PBMC, 部分PBMC用于诱导DC; 部分PBMC采用尼龙棉柱分离法分离T细胞, 用台盼蓝染色后在倒置显微镜下计数活细胞数应>95%, 并用培养液配成3×106 细胞/mL备用.
1.2.2 肝癌细胞的分离: 将手术切取的肝癌组织, 用淋巴细胞分离液, 采用不连续密度梯度离心法分离获得肝癌细胞, 肝癌细胞分2部分, 一部分用于制备肝癌全细胞抗原, 一部分用RPMI-1640常规培养, 用作细胞毒实验的靶细胞.
1.2.3 肝癌全细胞抗原肽的制备: 用RPMI-1640调整肝癌细胞浓度至1×107, 反复冻融(-80 ℃/37 ℃)4次, 作为肝癌抗原.
1.2.4 DC的体外诱导及肿瘤抗原冲击致敏DC: 以含150 mL/L FCS的RPMI-1640(完全培养基)调整PBMC浓度至3×106/mL加入6孔板中(3 mL/孔), 37 ℃, 50 mL/L CO2孵箱培养2 h, 轻轻吸弃非黏附细胞, 而获得贴壁的单核细胞, 每孔再加入含rhGM-CSF 100 ng/mL和rhIL-4 100 ng/ mL的完全培养基, 常规培养, 每3 d换液1次, 换液时加等浓度的rhGM-CSF和rhIL-4. 在培养的第4 d将DC和肝癌全细胞抗原共培养, 第6 d收集DC, 即为肝癌抗原肽冲击致敏的DC, 以抗CD83McAb特异显示诱导培养后的DC.冲击后的细胞用培养基洗2遍, 重悬于RPMI-1640细胞培液中备用.
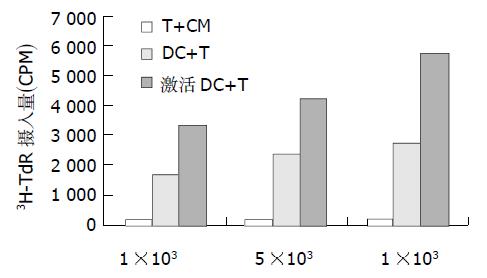
1.2.5 抗原致敏DC刺激自体T细胞增生能力的检测: 收集培养第7 d的抗原致敏及未致敏的DC作为刺激细胞, 分别用完全培养基调整细胞浓度为2×106/ mL, 加入丝裂霉素C 25 mg/ mL, 37 ℃孵育45 min, 生理盐水洗涤3次, 完全培养基悬浮, 分别以1×103/孔, 5×103/孔及1×104/孔加入96孔圆底培养板, 每组设3个复孔.再每孔加入自体T淋巴细胞1×105作为反应细胞, 终体积为200mL. 置37 ℃, 50mL /LCO2孵箱培养96 h, 于培养结束前16 h加3H-TdR, 0.5 mci/孔.收集细胞, 液闪计数仪检测CPM值, 结果用3孔均值表示.
1.2.6 抗原致敏的DC刺激自体T细胞增生分化为CTL: 于多孔反应板中加入自体T淋巴细胞(1×105, 作为反应细胞)、抗原致敏的DC(5×103, 作为诱导细胞), 置37 ℃, 50 mL/L CO2孵箱培养, 于培养的第6 d收集活细胞即为抗原致敏DC激活的CTL.同理诱导未经肝癌细胞抗原致敏DC激活的CTL.
1.2.7 细胞毒实验: 抗原致敏DC激活的CTL作为效应细胞, 自体肝癌细胞、CT26细胞、BEL-7402细胞为靶细胞, 效靶比为50:1.同时设立DC、未经肝癌细胞抗原致敏的DC激活的CTL及T淋巴细胞作为效应细胞的杀伤对照. 采用乳酸脱氢酶(LDH) 4 h释放法检测CTL杀伤活性, 严格按照试剂盒说明书操作. 置酶标仪上测490 nm的A值, 将A值代入公式中计算各效应细胞的杀伤活性.
Math 1
统计学处理 数据用mean±SD来表示, 采用SPASS统计软件进行计量资料的t检验.
肝癌抗原致敏的DC具有较未经致敏的DC更强的激发T细胞增生的能力, 差异有显著意义(P<0.01, 图1).
肝癌抗原致敏DC诱导的CTL表现出很强的杀伤自体肝癌细胞的细胞毒活性, 杀伤率显著高于DC、未经肝癌细胞抗原致敏的DC激活的CTL及T淋巴细胞的杀伤率, 而对CT26细胞、BEL-7402细胞无明显的杀伤作用; 未经抗原致敏DC诱导的CTL对自体肝癌细胞也有较强的杀伤作用; DC本身及未经DC激活的T细胞对自体肝癌细胞无杀伤作用.
DC在免疫应答中起着调控地位: (1)机体的卫士; (2)免疫应答的始动者; (3)T细胞的强刺激者; (4)免疫耐受的诱导者. 应用这种体内功能最强的APC即DC作为肿瘤疫苗的载体或称佐剂, 以肿瘤抗原体外冲击使其致敏, 或者说让DC负载着肿瘤抗原, 这样的疫苗进入体内保证肿瘤抗原被有效摄取、提呈, 且通过DC可提供攻击肿瘤细胞所必须的共刺激信号, 因此, DC疫苗是新一代的肿瘤疫苗, 可提供更有效的特异性主动免疫, 显示了比"常规"疫苗更明显的优越性[6-14]. 本实验结果表明, 联合应用rhGM-CSF和rhIL-4可从原发性肝癌患者外周血诱导扩增出大量DC, 该DC经自体肝癌细胞抗原体外脉冲致敏后, 能诱导自体T细胞增生和特异性CTL, 抗原致敏的DC对自体肝癌细胞具有很强的杀伤力, 而对CT26细胞、BEL-7402细胞无明显的杀伤作用, 说明抗原致敏DC诱导的CTL具有高效而特异的抗肿瘤作用. 未经抗原致敏DC诱导的CTL对自体肝癌细胞也表现出一定的杀伤力.有关DC诱导的CTL抗肿瘤作用的机制目前尚不清楚, 可能与(1)DC表面有大量的树突状突起, 使之有利于大量接触抗原并提呈给CTL细胞; (2)DC高表达MHC Ⅰ、Ⅱ类分子和CD80/CD86等共刺激分子, 为CTL充分活化提供信号刺激; (3)DC分泌IL-12等多种细胞因子, 可维持和增强CTL的活性; (4) DC可通过分泌或外排一种具有抗原提呈能力的exosome小体来诱导免疫反应, 也增强了CTL的抗肿瘤能力; (5) CTL直接杀伤肿瘤细胞或分泌细胞因子诱导肿瘤细胞凋亡及抑制肿瘤细胞增生等机制有关. 最近有报道DC可作为一种效应细胞直接杀伤肿瘤细胞[15-16], 但我们在实验中未发现肝癌患者外周血DC在体外对自体肝癌细胞有直接的杀伤作用, 可能是DC不具备效应细胞功能, 也可能是体内和体外微环境不同造成的. 总之, 本实验结果提示, 肿瘤抗原致敏的DC可作为一种新型抗肿瘤疫苗在肿瘤治疗及预防其复发与转移中发挥重要作用.
| 1. | Austyn JM. Antigen-presenting cells. Experimental and clinical studies of dendritic cells. Am J Respir Crit Care Med. 2000;162:S146-S150. [PubMed] [DOI] |
| 2. | Nair SK, Snyder D, Rouse BT, Gilboa E. Regression of tumors in mice vaccinated with professional antigen-presenting cells pulsed with tumor extracts. Int J Cancer. 1997;70:706-715. [PubMed] [DOI] |
| 3. | Dubois B, Lamy PJ, Chemin K, Lachaux A, Kaiserlian D. Measles virus exploits dendritic cells to suppress CD4+ T-cell proliferation via expression of surface viral glycoproteins independently of T-cell trans-infection. Cell Immunol. 2001;214:173-183. [PubMed] [DOI] |
| 4. | Bédouet L, Bousser MT, Frison N, Boccaccio C, Abastado JP, Marceau P, Mayer R, Monsigny N, Roch AC. Uptake of dimannoside clusters and oligomannosides by human dendritic cells. Biosci Rep. 2001;21:839-855. [PubMed] [DOI] |
| 5. | Tseng SY, Otsuji M, Gorski K, Huang X, Slansky JE, Pai SI, Shalabi A, Shin T, Pardoll DM, Tsuchiya H. B7-DC, a new dendritic cell molecule with potent costimulatory properties for T cells. J Exp Med. 2001;193:839-846. [PubMed] [DOI] |
| 6. | Tang ZH, Qiu WH, Wu GS, Yang XP, Zou SQ, Qiu FZ. The immunotherapeutic effect of dendritic cells vaccine modified with interleukin-18 gene and tumor cell lysate on mice with pancreatic carcinoma. World J Gastroenterol. 2002;8:908-912. [PubMed] [DOI] |
| 7. | Chen Y, Emtage P, Zhu Q, Foley R, Muller W, Hitt M, Gauldie J, Wan Y. Induction of ErbB-2/neu-specific protective and therapeutic antitumor immunity using genetically modified dendritic cells: enhanced efficacy by cotransduction of gene encoding IL-12. Gene Ther. 2001;8:316-323. [PubMed] [DOI] |
| 8. | Insug O, Ku G, Ertl HC, Blaszczyk-Thurin M. A dendritic cell vaccine induces protective immunity to intracranial growth of glioma. Anticancer Res. 2002;22:613-621. [PubMed] |
| 9. | Kalady MF, Onaitis MW, Padilla KM, Emani S, Tyler DS, Pruitt SK. Enhanced dendritic cell antigen presentation in RNA-based immunotherapy. J Surg Res. 2002;105:17-24. [PubMed] [DOI] |
| 10. | Kugler A, Stuhler G, Walden P, Zöller G, Zobywalski A, Brossart P, Trefzer U, Ullrich S, Müller CA, Becker V. Regression of human metastatic renal cell carcinoma after vaccination with tumor cell-dendritic cell hybrids. Nat Med. 2000;6:332-336. [PubMed] [DOI] |
| 11. | Liu Y, Zhang W, Chan T, Saxena A, Xiang J. Engineered fusion hybrid vaccine of IL-4 gene-modified myeloma and relative mature dendritic cells enhances antitumor immunity. Leuk Res. 2002;26:757-763. [PubMed] [DOI] |
| 12. | Kirk CJ, Hartigan-O'Connor D, Nickoloff BJ, Chamberlain JS, Giedlin M, Aukerman L, Mule JJ. T cell-dependent antitumor immunity mediated by secondary lymphoid tissue chemokine: augmentation of dendritic cell-based immunotherapy. Cancer Res. 2001;61:2062-2070. [PubMed] |
| 13. | Mackensen A, Dräger R, Schlesier M, Mertelsmann R, Lindemann A. Presence of IgE antibodies to bovine serum albumin in a patient developing anaphylaxis after vaccination with human peptide-pulsed dendritic cells. Cancer Immunol Immunother. 2000;49:152-156. [PubMed] [DOI] |
| 14. | Jonuleit H, Giesecke-Tuettenberg A, Tüting T, Thurner-Schuler B, Stuge TB, Paragnik L, Kandemir A, Lee PP, Schuler G, Knop J. A comparison of two types of dendritic cell as adjuvants for the induction of melanoma-specific T-cell responses in humans following intranodal injection. Int J Cancer. 2001;93:243-251. [PubMed] [DOI] |
| 15. | Amigorena S. Exosomes derived from dendritic cells. J Soc Biol. 2001;195:25-27. [PubMed] [DOI] |
| 16. | Amigorena S. Cancer immunotherapy using dendritic cell-derived exosomes. Medicina (B Aires). 2000;60 Suppl 2:51-54. [PubMed] |