修回日期: 2004-02-25
接受日期: 2004-03-02
在线出版日期: 2004-06-15
目的: 探讨人核转录因子Sp1在手术创伤后腹膜组织中的活性改变与腹膜粘连形成之间的关系.
方法: 采用凝胶电泳迁移率改变分析法(EMSA)检测手术创伤后不同时间的人腹膜组织核转录因子Sp1表达水平. Masson染色观察腹膜组织中胶原纤维的变化.
结果: 手术创伤后30 min核转录因子Sp1被活化, 随着手术时间延长, Sp1在创伤腹膜组织中的表达水平逐渐升高, 存在差异显著性(P<0.01). 随手术时间的延长腹膜组织中胶原纤维增加.
结论: 核转录因子Sp1的活化对于腹膜粘连形成具有一定的作用.
引文著录: 张安平, 张连阳, 向德兵. 核转录因子Sp1在手术创伤后腹膜组织中的表达和意义. 世界华人消化杂志 2004; 12(6): 1466-1468
Revised: February 25, 2004
Accepted: March 2, 2004
Published online: June 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1466-1468
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1466.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1466
自1853年Virchow报道腹膜粘连以来, 问题非但未得到解决, 相反随择期手术的增多而日益严重. 腹膜粘连形成是腹部外科手术常见的并发症之一. 常可导致严重并发症, 包括肠梗阻、不孕和疼痛等; 并增加术中并发症和再次手术的难度. 其腹膜粘连形成的分子机制尚不清楚. 核转录因子Sp1启动胶原的合成和表达, 在纤维化过程中起重要作用. 我们采用凝胶电泳迁移率改变分析法(electrophoretic mobility shift assay, EMSA)测定手术创伤后不同时间的人腹膜组织中Sp1的表达及水平, 为特异性调控Sp1而抑制腹膜粘连形成找到一定的理论依据.
以我科40例直肠癌手术患者为对象, 根据不同的分组获取腹膜组织. 开腹后立即自切口左侧2.0 cm处锐性切取腹膜组织为正常腹膜组. 手术后分别于30 min、1、2、3、4 h, 自切口右侧2.0 cm处锐性切取腹膜组织为创伤腹膜组. 切除腹膜组织面积大小为1.5 cm×1.5 cm. 获取组织立即液氮保存备用.
1.2.1 腹膜组织核蛋白的提取和Sp1探针的标记: 参照NE-PERTM核蛋白抽提试剂盒(美国PIERCE公司)提供的方法提取各组腹膜组织中的核蛋白, 以Bradford法测定核蛋白浓度后分装于-70 ℃保存备用. 参照Sp1NUSHIFT检测试剂盒(加拿大GENEKA公司)标记Sp1双链寡核苷酸探针, 在T4多核苷酸激酶作用下, 以[g-32P]ATP标记其5'端, 经MicroSpinTMG25分离柱纯化后, 测定探针放射活性.
1.2.2 腹膜组织核转录因子Sp1的DNA结合活性及特异性检测: 参照Sp1NUSHIFT检测试剂盒(加拿大GENEKA公司), 将下列试剂加入0.5 mL的Eppendorf管内: DNA结合缓冲液4 mL; 核蛋白提取物10 mg; 4 ℃孵育20 min, 加入已标记寡核苷酸双链探针1 mL; 4 ℃继续孵育20 min, 加入4 mL加样缓冲液, 混匀, 加样. 并进行Sp1的特异性竞争抑制实验, 设两组特异性对照检测, 一组加入50倍未标记的特异寡核苷酸探针, 另一组加入50倍未标记的变异寡核苷酸探针. 在60 g/L非变性聚丙烯酰胺凝胶中电泳2 h、180 V, 干胶, 放射自显影. 应用Bandscan分析软件对电泳条带进行灰度测定, 计算平均光密度(A), 以各条带的A值表示核转录因子的活性.
1.2.3 腹膜组织的Masson染色: 腹膜组织石蜡切片常规脱蜡入水, 用天青石溶液染细胞核20 min后水洗, Masson红染液10 min后水洗, 10 mL醋酸水溶液1 min, 5 g/L亮绿, 镜下观察至变绿后快速脱水透明封片.
统计学处理 实验数据均以mean±SD表示, SPSS10.0软件t检验.
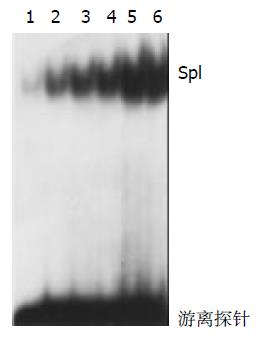
创伤腹膜组的核转录因子Sp1活性均明显高于正常腹膜组(P<0.01). 随手术创伤时间的延长其活性逐渐升高. 提示手术创伤时间越长, Sp1激活越明显(表1, 图1).
| 组别 | n | 0 h | 30 min | 1 h | 2 h | 3 h | 4 h |
| 正常腹膜组 | 40 | 31.2±8.3 | |||||
| 创伤腹膜组 | 40 | 61.2±11.6 | 88.4±15.8 | 104.6±15.3 | 122.4±27.1 | 134.6±18.4 |
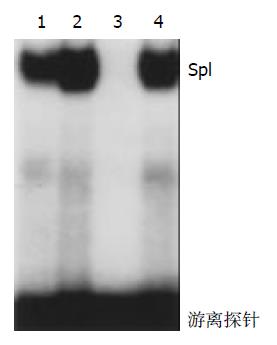
结果见(图2), 第3泳道采用50倍未标记的特异寡核苷酸显示完全被抑制, 条带消失. 第4泳道采用50倍未标记的变异寡核苷酸显示不被抑制. 与第1、2泳道相比, 显示出结合的特异性.
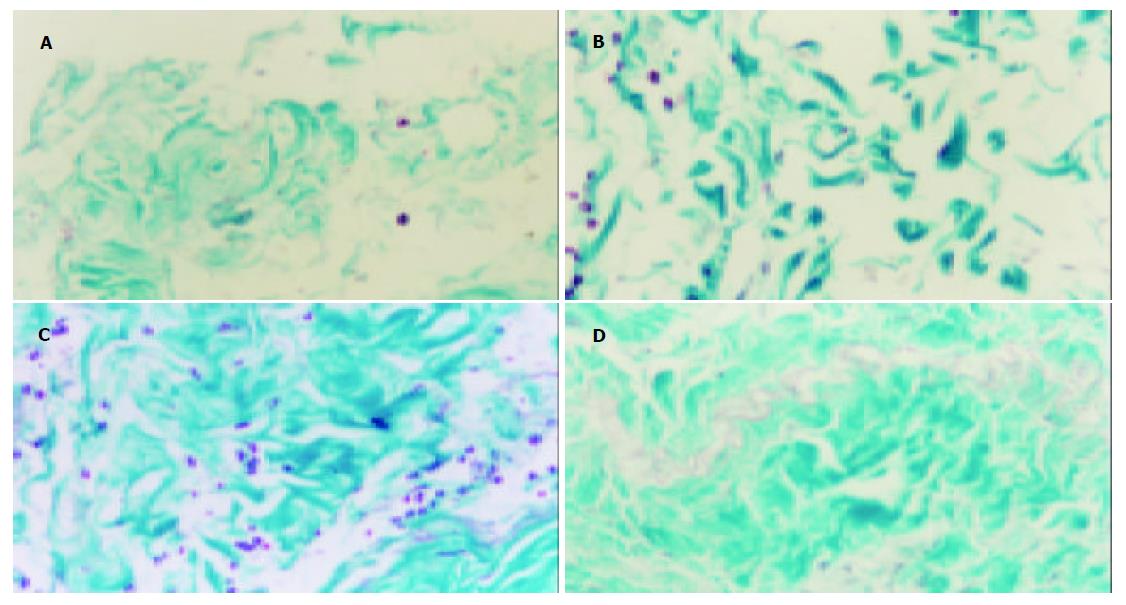
随着手术创伤时间的延长, 转录因子Sp1被活化, 腹膜组织中的胶原层增厚, 胶原纤维增生, 纤维细胞粗大、排列紊乱, 这种表现在手术后30 min则可观察到(图3A-D).
Sp1是Sp/SKLF(specificity protein/Krüppel-like factor, 特异性蛋白/ Kr-üppel样因子)转录因子家族中最早被克隆的因子, 由三个保守的Cys2His2锌指特异结合而形成, 三个锌指形成转录因子的DNA连接区域. 通常认为Sp1是通过GC或GT盒调节而控制所有基因的转录. Ihn et al[1]研究表明在硬皮病的纤维母细胞中Sp1的磷酸化增强与I型胶原的表达增高相关, Sp1通过特异的GC盒与I型a2胶原(COL1A2)启动子特异性结合, Sp1激活COL1A2启动子, 促进胶原的表达. Artlett et al[2]报道Sp1和近端的COL1A2启动子连接可激活COL1A2的活动. 以细胞或信号特异性的方式改变转录因子的相对量或DNA结合活性, 均可控制COL1A2启动子的转录, 说明Sp1在结缔组织生理和病理调节中起重要作用. 在表皮伤口愈合过程中如Sp1的过度活化可出现瘢痕疙瘩并转变成恶性胶原肿瘤, 表现为纤维母细胞过度分化、白细胞浸润、胶原合成明显增强[3]. Haase et al[4]在研究放射诱导的肺纤维化过程中在早期观察到Sp1短期增加, 此后维持稳定直到放射后1 mo. 在放射后2 mo, Sp1 mRNA水平维持稳定. 在II型肺细胞、肺泡巨噬细胞中发现Sp1蛋白, 从而导致在肺纤维化过程中纤维母细胞的增生明显增强. Rippe et al[5]发现在肝纤维化中, Sp1与COL1A2启动子结合增强, 促进了Ito细胞的活化, 使肝纤维化进一步发生. 在肝纤维化实验中可观察到Sp1和NF-I/Sp1开关元件的亲和力增加. 实验显示光神霉素阻碍Sp1与该位点的结合, 可使人纤维母细胞中细胞外基质(ECM)的形成和降解基因激活之间的平衡发生改变, 从而抑制胶原的产生. 以上研究说明Sp1在纤维化过程中起重要作用. 腹膜粘连与皮肤瘢痕形成和某些脏器的慢性纤维化类似, 均以纤维增生为基础, 已发现在角朊细胞的基因中存在功能性Sp1结合位点. 我们的研究发现在手术创伤后, 人体腹膜组织中的Sp1的活性随着时间的延长而逐渐增强, 且腹膜组织在创伤后其胶原纤维增生, 胶原的合成增加而分解降低, 使人在手术创伤后腹膜粘连形成. 因此, Sp1的活化在腹膜粘连形成中具有一定的作用, 但所依赖的信号通路以及在腹膜组织中的结合位点尚有待进一步研究.
Verrecchia et al[6]研究发现阻断Sp1可广泛抑制体内和体外ECM基因的表达, Sp1与ECM基因的基础表达有关, 可能在纤维化过程中起重要作用. 敲除Sp1可有效抑制ECM基因表达, 这为治疗纤维化提供了一个选择治疗的手段. 通过调控Sp1的表达可能阻断纤维化进程, 从而防止腹膜粘连形成.
| 1. | Ihn H, Ihn Y, Trojanowska M. Spl phosphorylation induced by serum stimulates the human alpha2(I) collagen gene expression. J Invest Dermatol. 2001;117:301-308. [PubMed] [DOI] |
| 2. | Artlett CM, Chen SJ, Varga J, Jimenez SA. Modulation of basal expression of the human alpha1(I) procollagen gene (COL1A1) by tandem NF-1/Sp1 promoter elements in normal human dermal fibroblasts. Matrix Biol. 1998;17:425-434. [PubMed] [DOI] |
| 3. | Nirodi CS, Devalaraja R, Nanney LB, Arrindell S, Russell S, Trupin J, Richmond A. Chemokine and chemokine receptor expression in keloid and normal fibroblasts. Wound Repair Regen. 2000;8:371-382. [PubMed] [DOI] |
| 4. | Haase M, Geyer P, Appold S, Schuh D, Kasper M, Müller M. Down-regulation of SP1 DNA binding activity in the process of radiation-induced pulmonary fibrosis. Int J Radiat Biol. 2000;76:487-492. [PubMed] [DOI] |
| 5. | Rippe RA, Almounajed G, Brenner DA. Sp1 binding activity increases in activated Ito cells. Hepatology. 1995;22:241-251. [PubMed] |
| 6. | Verrecchia F, Rossert J, Mauviel A. Blocking sp1 transcription factor broadly inhibits extracellular matrix gene expression in vitro and in vivo: implications for the treatment of tissue fibrosis. J Invest Dermatol. 2001;116:755-763. [PubMed] [DOI] |