修回日期: 2004-03-05
接受日期: 2004-03-12
在线出版日期: 2004-06-15
目的: 研究L-FABP(liver fatty acid binding protein)在大鼠非酒精性脂肪肝形成中的作用.
方法: 建立高脂饮食脂肪肝模型, 用半定量逆转录聚合酶链反应(RT-PCR)与聚丙烯凝胶蛋白电泳(Western Blot)方法测定脂肪肝肝组织中L-FABP表达变化.
结果: 高脂饮食脂肪肝大鼠肝脏中L-FABP于2 wk时其mRNA及蛋白表达增强, 于12 wk时表达最为明显, 与正常组比较相差显著(1.42±0.034 vs 0.90±0.04; 13 372.00±23.86 vs 6857.33±32.9 6637; P<0.05).
结论: 高脂饮食引起L-FABP表达增强, 最初是一种适应性反应, 随着L-FABP表达进一步增强, 导致脂肪酸代谢失衡, 引起脂肪肝的发生.
引文著录: 冯爱娟, 陈东风. 大鼠非酒精性脂肪肝中L-FABP的动态表达. 世界华人消化杂志 2004; 12(6): 1373-1375
Revised: March 5, 2004
Accepted: March 12, 2004
Published online: June 15, 2004
AIM: To study the effect of liver fatty acid binding protein(L-FABP) in a model of rat nonalcoholic fatty liver.
METHODS: Expression of L-FABP gene was examined in fatty liver rats by reverse transcription and polymerase chain reaction amplification and Western blot.
RESULTS: In high-fat diet group, mRNA and protein expression of L-FABP increased at 2 wk, and elevated remarkably at 12 wk (1.42±0.034 vs 0.90±0.04; 13 372.00±23.86 vs 6857.33±32.96 637; P < 0.05).
CONCLUSION: Enhanced expressin of L-FABP at early staage is adapative reaction. With the advanced expression, disturbance of fatty acid metabolism may lead to nonalcoholic fatty liver.
- Citation: Feng AJ, Chen DF. Expression of liver fatty acid binding protein in rat nonalcoholic fatty liver. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1373-1375
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1373.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1373
非酒精性脂肪肝(nonalcoholic fatty liver, NAFL)是一种无过量饮酒史的肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征[1], 其发病机制至今尚未完全明确目前研究显示, 多种因素参与了非酒精性脂肪肝的发病过程, 其中脂质代谢异常被认为是最关键和基础的环节之一[2]. 大量研究证实肝脏脂肪酸结合蛋白(liver fatty acid binding protein L-FABP)参与脂肪酸的摄取与转运, 在脂质代谢中起重要作用. 为探讨L-FABP与非酒精性脂肪肝的关系, 我们观察其在高脂饮食脂肪肝大鼠模型中的表达.
Wistar成年♂大鼠40只, 体重176-188 (平均182 g), 随机分为对照组与高脂饮食组, 各20只, 各组又随机分为2、4、8、12 wk 4个时相组, 每组各5只. 对照组给予基础饲料(实验动物中心提供), 高脂饮食组给予高脂饲料(基础饲料780 g/kg, 猪油200 g/kg, 胆固醇20 g/kg), 分别于2、4、8、12 wk时收集肝脏标本. 以速眠新1 mL/kg麻醉大鼠, 股动脉抽血, 送检血清ALT. 然后阻断肝动脉与肝静脉, 留取肝组织标本, 肝脏甘油三脂(TG)检测采用甘油三脂检测试剂盒, 按照说明书进行操作.每块肝组织0.8cm×0.4 cm, 约100 mg, 加入RIPA裂解液1 mL(裂解液组成: 1.5 moL/NaCl 1 mL + 100 mmoL/ 5 mL Tris-HCl 5 mL(pH7.4) + 100 g/L SDS 100 mL+ 500 mmoL/L DTT 100 mL + NP-40 100 mL+Complete Mini 1片 +三蒸水补足容量至10 mL), 冰上裂解1 h, 移入1.5 mL的EP管中离心, 取上清液, 用Folin酚法测定蛋白浓度.
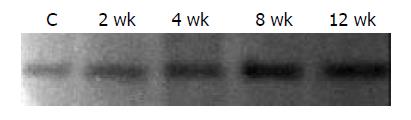
1.2.1 肝组织L-FABP表达采用Western blot法检测: 取各组肝组织总蛋白100 mg上样进行聚丙烯凝胶电泳, 采用80 g/L的分离胶, 50 g/L的积层胶, 上样后60 V恒压电泳约50 min, 待溴酚蓝至积层胶与分离胶交界处, 换恒压80 V电泳2 h, 使溴酚蓝全部电泳出分离胶底部. 电转法将分离胶上的蛋白转移到硝酸纤维素膜上(20 V, 17 h). 膜用50 g/L脱脂奶粉+10 g/L BSA的1×TBS 溶液封闭12 h, 再用一抗(L-FABP 1:200) 4 ℃下孵育12 h, 二抗室温孵育60 min. 用发光试剂检测结合的辣根过氧化物酶标记的二抗, X线片显影.
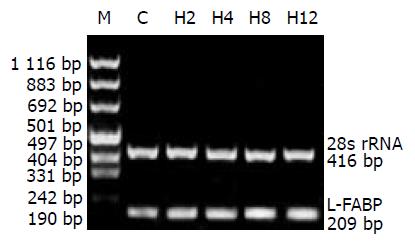
1.2.2 肝组织L-FABP mRNA表达采用RT-PCR检测: 总RNA提取采用宝灵曼公司的Tripure试剂提取组织总RNA, 按试剂盒说明操作, 最后加入灭活RNA酶去离子水10 mL重新溶解RNA待用.引物采用Primer design 软件设计, 由上海生物工程公司合成. L-FABP -upper: gcc, taa, tca, ttc, ata, gct, tcc, cta; L-FABP-lower: tac, caa, ctg, agc, tac, att, ctc, agc; 扩增片段长度209 bp.内参照28 s rRNA- upper: 5'ac, cct, act, gat, gat, gtg, ttg, ttg3'; 28 s rRNA- lower: 5'ggt, tta, gcg, cca, ggt, tcc3'扩增片段长度416 bp. 反转录合成cDNA: 反应体系总体积40 mL. 在0.5 mL薄壁管中加入样品总RNA 4.0 mg, RNasin 1.33 mL (40U), 加DEPC-去离子水至20 mL; 70 ℃变性10 min, 然后冰上放置2 min以上; 加入逆转录5×反应缓冲液8 mL, oligo (dT)18 2 mL(0.2mg), 10 mmoL/L dNTP 4 mL, 加入M-MuLV逆转录酶2 mL (400 U), 25 mmoL/L MgCL2 4 mL; 37 ℃反应60 min; 70 ℃变性10 min终止反应, -20 ℃保存备用. 同时设立阴性对照, 即用DEPC-去离子水代替样品总RNA. L-FABP扩增条件: 95 ℃变性5 min, 95 ℃退火1 min, 72 ℃延伸1 min, 循环32圈; RT-PCR 产物的鉴定和产量分析各组的同一目的mRNA以相同的条件同时进行逆转录及PCR扩增, 扩增产物在同一张琼脂糖凝胶(10 g/L)上进行电泳. 凝胶照相后, 于Gel Doc 2000凝胶图像分析系统进行扫描, 用BandScan软件分析, 测定产物条带的积分吸光度(IA).
统计学处理 实验所得计量资料用采用mean±SD表示, 采用SPSS10.0软件单因素方差分析(One way ANO-VA), P<0.05表示差异具有显著性意义.
与对照组比较无差异(P>0.05), 4 wk后开始增高, 于12 wk时明显增高(P<0.05, 见表1). 高脂组肝组织TG于2 wk时无明显变化, 与对照组比较无差异(P>0.05), 4 wk后开始增高, 于12 wk时明显增高(P<0.05, 见表1).
高脂饲料饮食组L-FABP mRNA 于2 wk 始表达增强, 与对照组比较相差不显著, 于4 wk后与正常饮食组比较具有显著意义(P<0.05, 见图1, 表2).
非酒精性脂肪肝是肝脏最常见的疾病之一, 随着人民生活水平的提高及饮食结构的西方化, 脂肪肝的发病率呈逐年上升趋势.研究结果显示[2-5] , 多种因素参与了非酒精性脂肪肝的发病过程, 主要包括: (1)遗传因素; (2)环境因素、饮食、营养状态、食物污染、食物营养素比例失调; (3)脂质代谢异常; (4)氧应激及脂质过氧化损伤; (5)免疫反应损害. 脂肪肝的发生最终取决于肝脏对脂肪酸的摄取、氧化、合成、酯化和甘油三脂的转运出肝脏是否能保持动态平衡, 大量研究证实FABP可结合许多配体, 参与脂肪酸的摄取与转运, 在脂质代谢中起重要作用[6-9]. L-FABP是FABP超家族中的一员, 存在于肝细胞和小肠黏膜细胞胞质, 对软脂酸盐、油酸和硬脂酸盐等长链脂肪酸具有高度亲和力, 从而参与脂肪酸的摄取与转运[10]. 在肝脏, 长链脂肪酸一般通过位于肝细胞膜上的FABP、脂肪酸转运蛋白(fatty acid transport protein FATP)[11]摄取入胞, 进入细胞内的脂肪酸在L-FABP的辅助下被转入到线粒体、过氧化物酶体、内质网等进行b-氧化、酯化, 从而调控细胞内的脂肪酸代谢, 最终使体内脂肪酸代谢保持相对平衡.目前, 有关L-FABP与脂肪肝形成的关系国内外尚未见报道, 国外文献报道在L-FABP基因敲除的大鼠, 脂肪酸转运明显降低[12];另外大量研究报道其在肥胖、糖尿病的形成过程中具有重要的作用[13]. 本实验结果显示高脂饮食4wk开始出现脂肪变, 随着时间的延长, 肝细胞脂肪变性和炎细胞浸润越为明显, 血清ALT及肝脏内TG明显呈上升趋势, 而肝组织L-FABP mRNA及蛋白表达于2 wk时即开始增高, 与正常对照相差不显著(P>0.05), 12 wk时表达最为明显, 与正常对照组相比相差显著(P<0.05). L-FABP的mRNA及蛋白表达先于肝脏组织学改变, 可能为高脂饮食后机体的适应性反应, 随着高脂饮食摄入的增加, L-FABP表达明显增强, 导致脂肪酸代谢失衡, 引起脂肪肝的发生和发展.
| 2. | Park KS, Lee YS, Park HW, Seo SH, Jang BG, Hwang JY, Cho KB, Hwang JS, Ahn SH, Kang YN. Factors associated or related to with pathological severity of nonalcoholic fatty liver disease. Korean J Intern Med. 2004;19:19-26. [PubMed] [DOI] |
| 3. | Sanyal AJ. Insulin resistance and nonalcoholic steatohepatitis: fat or fiction? Am J Gastroenterol. 2001;96:274-276. [PubMed] [DOI] |
| 5. | McCullough AJ. Update on nonalcoholic fatty liver disease. J Clin Gastroenterol. 2002;34:255-262. [PubMed] [DOI] |
| 6. | Storch J, Thumser AE. The fatty acid transport function of fatty acid-binding proteins. Biochim Biophys Acta. 2000;1486:28-44. [PubMed] [DOI] |
| 7. | Stump DD, Fan X, Berk PD. Oleic acid uptake and binding by rat adipocytes define dual pathways for cellular fatty acid uptake. J Lipid Res. 2001;42:509-520. [PubMed] |
| 8. | Duplus E, Forest C. Is there a single mechanism for fatty acid regulation of gene transcription? Biochem Pharmacol. 2002;64:893-901. [PubMed] |
| 9. | Zimmerman AW, van Moerkerk HT, Veerkamp JH. Ligand specificity and conformational stability of human fatty acid-binding proteins. Int J Biochem Cell Biol. 2001;33:865-876. [PubMed] [DOI] |
| 10. | Her GM, Chiang CC, Chen WY, Wu JL. In vivo studies of liver-type fatty acid binding protein (L-FABP) gene expression in liver of transgenic zebrafish (Danio rerio). FEBS Lett. 2003;538:125-133. [PubMed] |
| 11. | Stahl A, Gimeno RE, Tartaglia LA, Lodish HF. Fatty acid transport proteins: a current view of a growing family. Trends Endocrinol Metab. 2001;12:266-273. [PubMed] [DOI] |
| 12. | Newberry EP, Xie Y, Kennedy S, Han X, Buhman KK, Luo J, Gross RW, Davidson NO. Decreased hepatic triglyceride accumulation and altered fatty acid uptake in mice with deletion of the liver fatty acid-binding protein gene. J Biol Chem. 2003;278:51664-51672. [PubMed] [DOI] |