修回日期: 2004-03-29
接受日期: 2004-04-13
在线出版日期: 2004-06-15
目的: 观察氯沙坦对大鼠肝纤维化基质金属蛋白酶抑制剂-1(TIMP-1)及纤溶酶原激活物抑制剂-1(PAI-1)表达的影响. 从细胞外基质降解的角度探讨氯沙坦的作用机制, 为临床用药提供实验依据.
方法: 制备CCl4大鼠肝纤维化模型, 48只大鼠随机分为模型、预防、治疗及正常对照组. 除正常对照组外, 其余大鼠均皮下注射CCl4;预防及治疗组(第5 wk始)每天予氯沙坦灌胃, 共12 wk, HE、VG染色观察肝纤维化程度, 免疫组化法检测TIMP-1、PAI-1蛋白表达.
结果: 氯沙坦可显著降低预防组和治疗组大鼠肝纤维化程度(P<0.05), TIMP-1和PAI-1平均染色强度IS在预防(1.6 900±0.4 228, 1.8 900±0.5 127)及治疗(1.9 000±0.5 925, 2.0 540±0.4 251)组均明显低于模型组(2.5 111±0.3 919, 2.8 500±0.2 013), 有显著性差异(P<0.05).
结论: 氯沙坦能显著降低CCl4诱导的大鼠肝纤维化的程度, 降低TIMP-1和PAI-1表达水平, 对肝纤维化有良好的防治作用.
引文著录: 孟燕妮, 张桂英, 李乾. 氯沙坦对肝纤维化鼠TIMP-1, PAI-1表达的影响. 世界华人消化杂志 2004; 12(6): 1361-1364
Revised: March 29, 2004
Accepted: April 13, 2004
Published online: June 15, 2004
AIM: To investigate the effect of losartan on the expression of tissue inhibitor of metalloproteinase-1 (TIMP-1) and plasminogen activator inhibition-1 (PAI-1) in the liver of rat with hepatic fibrosis.
METHODS: Forty-eight SD rats were randomly divided into four groups: normal control group, model group, losartan-prevention group, losartan-treatment group. Except rats in control group, all rats were given subcutaneous injection of carbon tetrachloride. Rats in prevention and treatment (from the 5th wk) groups were also given losartan via gastrogavage. At the end of 12 weeks, rats were sacrificed. HE and VG stains were used to evaluate the degree of fibrosis; Immunohistochemistry was used to detect the expression of TIMP-1 and PAI-1 in the liver tissue, respectively.
RESULTS: Losartan could greatly attenuate the degree of liver fibrosis (P < 0.05) . Intensity score (IS) of TIMP-1 and PAI-1 in prevention (1.6 900±0.4 228, 1.8 900±0.5 127) and treatment (1.9 000±0.5 925, 2.0 540±0.4 251) groups was weaker than that in model group (2.5 111±0.3 919, 2.8 500±0.2 013) (P < 0.05).
CONCLUSION: Losartan can suppress expression of TIMP-1 and PAI-1, which may be related to its anti-hepatic fibrosis activity.
- Citation: Meng YN, Zhang GY, Li Q. Effects of losartan on TIMP-1 and PAI-1 expression in rat hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1361-1364
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1361.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1361
肝纤维化是以胶原为主的细胞外基质(extracellular matrix, ECM)合成增多, 降解相对不足, 过多沉积在肝内所致. 抗肝纤维化包括保护肝细胞、抗氧自由基、促进肝细胞再生、抑制肝脏炎症、免疫调整、抑制肝星状细胞(hepatic stellate cell, HSC)活化及增生、促进HSC调亡、调整ECM的合成及降解等方面. 至今尚无高效、低毒而理想治疗肝纤维化的药物. 血管紧张素Ⅱ(ANGⅡ)1型受体拮抗剂是新一类肾素-血管紧张素系统(RAS)抑制剂, 可有效抑制纤维化的发展[1-5]. 我们通过用CCl4诱导大鼠, 对各组大鼠肝组织中基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase-1, TIMP-1)及纤溶酶原激活物抑制剂-1(plasminogen activator inhibition-1, PAI-1)进行检测, 旨在探讨氯沙坦治疗肝纤维化的作用机制, 如下.
SD大鼠, 雌雄不分, 质量18045 g, 购自湘雅实验动物中心; CCl4为天津市博迪化工有限公司产品, 含量>99.5%; 兔抗大鼠PAI-1, TIMP-1多克隆抗体购自武汉博士德生物工程有限公司; 链霉素抗生物素蛋白-过氧化酶免疫染色趋敏试剂盒(Spkit)购自北京中山生物公司; 氯沙坦为默沙东医药公司产品.
采用400 mL/L CCl4(CCl4:石蜡油为2:3)油剂, 3 mL/kg, 2次/wk造模. 48只大鼠随机分为四组, M组(模型组, 13只)按上述方法造模, 4 wk末活杀2只, 切取肝脏, 病理科送检, 对比观察肝纤维化的程度; P组(预防组, 12只)造模的同时给予氯沙坦10 mg/kg灌胃, 1次/d; T组(治疗组, 12只)造模的同时5 wk始给予氯沙坦10 mg/kg灌胃, 1次/d; N组(对照组, 11只)按3 mL/kg石蜡油, 2次/wk, 正常饮食饮水, 4 wk末活杀2只, 病理科送检, 以作对比. 12 wk末处死所有大鼠.
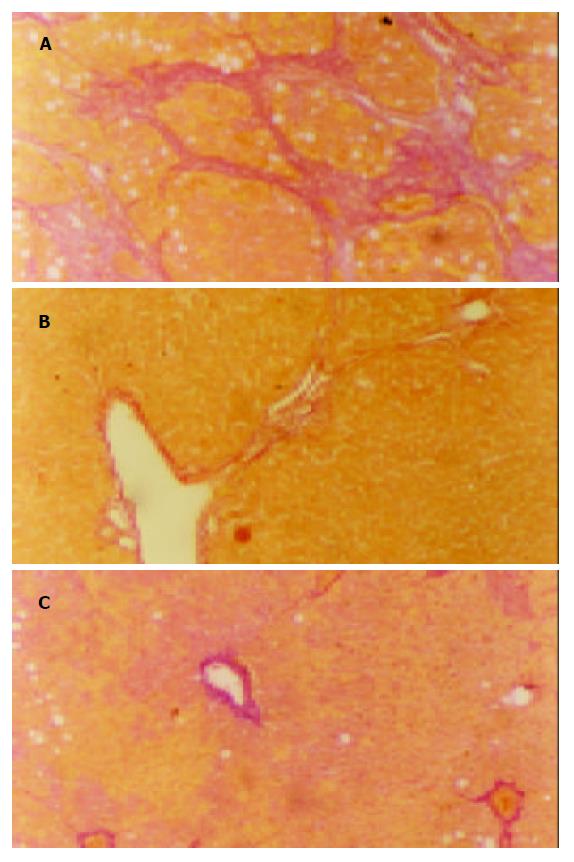
1.2.1 HE, VG染色: 光镜对肝纤维化程度作半定量分析, 根据纤维结缔组织增生程度将其分为0-Ⅳ级. 0级: 未见纤维组织增生; Ⅰ级, 纤维组织增生局限于汇管区或有汇管区扩大, 有向小叶发展的倾向; Ⅱ级纤维结缔组织增生进入肝小叶2/3及有Ⅰ级同样的改变; Ⅲ级, 纤维结缔组织进入肝小叶中央静脉周围; Ⅳ级, 纤维结缔组织在全小叶呈多处弥漫性增生, 有假小叶形成, 并有Ⅲ级同样改变.
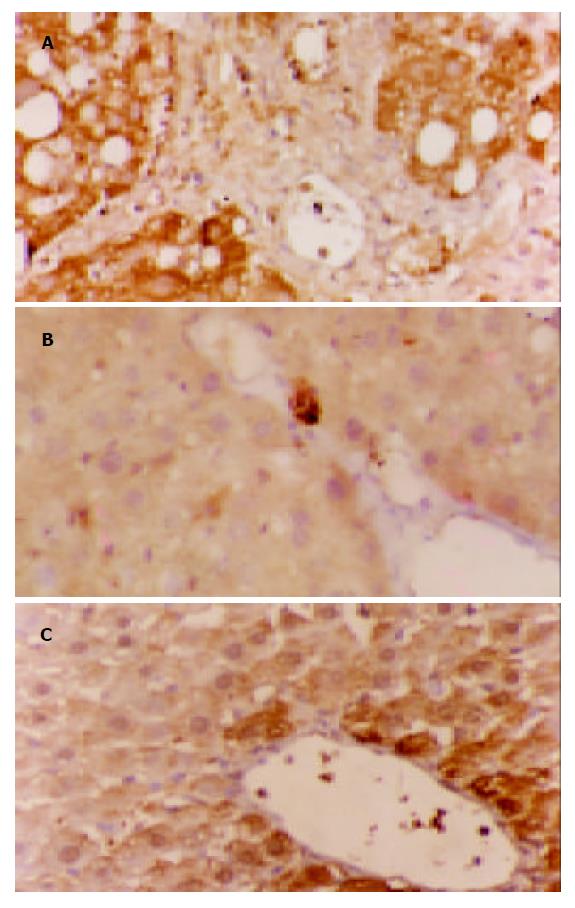
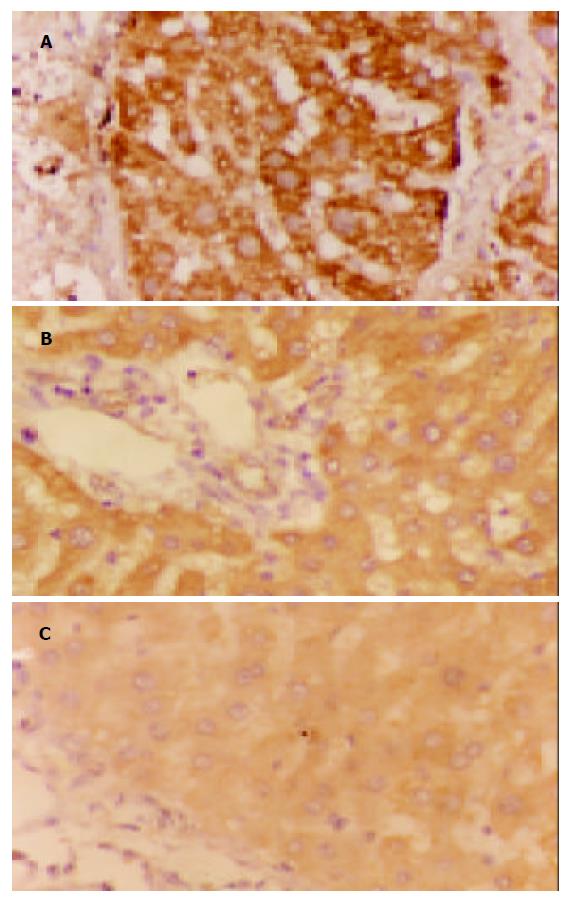
1.2.2 免疫组织化学染色: 肝组织标本用40 g/L甲醛液固定, 石蜡包埋4 mm连续切片, 采用SP法作免疫组化染色. 切片; 常规脱蜡至水; 微波抗原修复; 加100 mL/L正常血清封闭30 min; 加TIMP-1或PAI-1多克隆抗体(一抗, 稀释度均为1:100) 4 ℃过夜; 加生物素二抗37 ℃, 恒温30 min; 加亲和素-过氧化酶溶液37 ℃, 20 min; 加DAB显色, 镜下控制显色时间; 苏木素复染, 乙醇脱水, 二甲苯透明, 树胶封片, 镜检, 并照相记录. 为保证实验结果的可靠性, 特别是免疫组化的特异性采用省略一抗, 用PBS代替一抗. TIMP-1、PAI-1蛋白均以胞质内出现棕黄色颗粒为阳性反应, 切片在10倍物镜视野下观察, 随机计数5个视野中各染色强度细胞数的百分比. 根据细胞染色强度分为四级, 并分别计分: 阴性, 细胞无着色(0分); 弱阳性, 细胞着色为浅黄色(1分); 中度阳性, 细胞着色为棕黄色(2分); 强阳性, 细胞着色为棕褐色(3分), 计算每一强度的视野数, 根据下列公式计算每张切片的平均染色强度: IS(intensity score) = ∑{(0×F0)+(1×F1)+(2×F2)+(3×F3)}, F = %10×视野.
统计学处理 肝纤维化病理等级资料比较采用非参数秩和检验. 免疫组化为计量资料结果用mean±SD表示, 经方差齐性检验后, 对数据进行方差分析. 使用统计软件SPSS10.0, 取检验水准a = 0.05
肝组织HE, VG染色结果显示, 第4 wk末模型组大鼠肝组织与正常组相比可见小灶或片状坏死, 脂肪变性, 炎性细胞浸润明显, 胶原纤维沿汇管区或炎症坏死区分布. 12 wk末肝组织, 正常大鼠肝小叶结构完整, 中央静脉窦周围肝细胞索放射状排列, 未见肝细胞坏死及炎症细胞浸润, 胶原着色仅见于血管壁. 模型组肝组织呈现显著的脂肪变性、肝细胞变性坏死、大量炎性细胞浸润、汇管区扩大、汇管区胶原沉积, 纤维间隔增宽, 部分肝组织有明显的假小叶形成. 用药各组炎症程度及空泡变性较模型组均显著减轻, 纤维间隔细少, 汇管区胶原亦减少, 无假小叶形成(表1, 图1).
| 分组 | n | 肝纤维化分级 | ||||
| 0 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | ||
| M | 9 | 0 | 0 | 1 | 6 | 2 |
| Pa | 10 | 0 | 1 | 6 | 3 | 0 |
| Ta | 10 | 0 | 0 | 6 | 4 | 0 |
| N | 9 | 9 | 0 | 0 | 0 | 0 |
TIMP1, PAI-1蛋白阳性表达信号为棕黄色颗粒, 均集中在细胞质. 在模型组中, 二者的表达多呈弥漫性分布, 预防及治疗组中, 二者多为局限性阳性, 信号较模型组弱, 少数为弥漫性表达. 正常肝组织仅在中央静脉周边及汇管区可见少量弱阳性信号表达. 对照实验省略一抗后阳性信号消失, 检测结果为阴性, 实验证实此免疫组化检测结果是特异性(表2, 图2, 3).
肝纤维化是一切慢性肝病的共同病理学基础, 虽不同肝病致病机制不完全相同, 但各种不同病因肝纤维化发生最终共同途径是由细胞因子介导的细胞-细胞相互作用, 以及基质-细胞相互作用引起的HSC的激活, 转化为肌成纤维细胞(myofibroblastic-like cell, MFBLC), 表达多种细胞因子及受体, 大量增生, 大量合成肝脏细胞外基质(extracellular matrix, ECM), 而ECM的降解降低引起[6-9]. 参与ECM降解过程有基质金属蛋白酶类, 丝氨酸蛋白酶类和半胱氨酸蛋白酶类. 基质金属蛋白酶类(matrix metalloproteinases, MMPs)是一组锌离子依赖酶, 他通过降低胶原螺旋结构的稳定性, 改变底物的二级结构, 为其他蛋白酶作进一步降解创造条件. 而基质金属蛋白酶组织抑制剂(tissue inhibitor of metalloproteinases, TIMPs)是一组具有抑制MMPs功能的活性多肽, 他不但与MMP酶原以1:1形式相结合抑制其活化, 而且能灭活活性酶, 从而使MMPs失去降解功能, 抑制ECM的降解[10-11]. 肝纤维化时TIMP-1大量表达, 使MMPs活性减少, 造成肝损伤后增生的ECM成分尤其是Ⅰ, Ⅲ型胶原降解减少, 沉积增多, 而通过抑制TIMP-1的表达, 可有效抑制Ⅰ, Ⅲ型胶原的增生[12-16], 从而延缓纤维化的发展. 纤溶酶原激活物(plasminogen activator, PA)/纤溶酶系统在丝氨酸蛋白酶类中占据着主导地位. PA可激活纤溶酶原形成纤溶酶, 纤溶酶可直接降解ECM中多种成分(纤维蛋白、纤维连接蛋白、蛋白多糖、板层素等[17-19], 还能激活基质金属蛋白酶(matrix metalloproteinases, MMPs), 使ECM降解[20], PAI-1 (plasminogen activator inhibition-1, PAI-1)是PA快速、专一有效的生理抑制因子, 他通过活性中心与tPA形成1:1复合物, 使PA失活, 从而抑制其后的激活反应. 因此PAI-1在组织内水平的升高和(或)活性的增强能有效的抑制纤维蛋白的水解和ECM的降解, 继之增加组织内纤维蛋白的沉积和ECM的积聚, 从而导致或促进器官的纤维化或硬化[21-24]. 血管紧张素Ⅱ(AngⅡ)可引起HSC收缩, 促进其增生, 是HSC的分裂原之一[25]. AngⅡ是通过其Ⅰ型受体(ATR1)作用于HSC. 同时AngⅡ还能刺激转化生长因子-b1(TGFb1)的合成和分泌, 间接通过TGF-b1刺激HSC分泌细胞外基质[26]. 氯沙坦作为ATR1阻断剂通过阻断上述途径从而延缓纤维化的发展, 其在心肌及肾脏方面都有很好的抗纤维化作用. 我们发现, 预防组、治疗组与模型组比较, TIMP-1, PAI-1蛋白表达水平明显降低(P<0.05), 同时发现用药各组大鼠肝组织坏死程度及空泡变性较模型组均有改善, 纤维间隔增生受抑(P<0.05). 与国外的研究AngⅡ通过上调组织中TIMP-1, PAI-1mRNA促使纤维化形成这一观点相符. 而预防用药与治疗组相比, 无显著差异(P>0.05), 可能与样本量小有关. 本研究结果提示, 氯沙坦通过抑制肝纤维化肝组织中TIMP-1, PAI-1蛋白的表达, 促进ECM降解, 从而延缓纤维化的形成和发展. 研究结果为氯沙坦防治肝纤维化提供了一定的实验依据, 其更深层的作用机制有待进一步研究.
| 1. | Otsuka M, Takahashi H, Shiratori M, Chiba H, Abe S. Reduction of bleomycin induced lung fibrosis by candesartan cilexetil, an angiotensin II type 1 receptor antagonist. Thorax. 2004;59:31-38. [PubMed] [DOI] |
| 2. | Tuncer I, Ozbek H, Ugras S, Bayram I. Anti-fibrogenic effects of captopril and candesartan cilexetil on the hepatic fibrosis development in rat. The effect of AT1-R blocker on the hepatic fibrosis. Exp Toxicol Pathol. 2003;55:159-166. [PubMed] |
| 3. | Leung PS, Suen PM, Ip SP, Yip CK, Chen G, Lai PB. Expression and localization of AT1 receptors in hepatic Kupffer cells: its potential role in regulating a fibrogenic response. Regul Pept. 2003;116:61-69. [PubMed] [DOI] |
| 5. | Boffa JJ, Lu Y, Placier S, Stefanski A, Dussaule JC, Chatziantoniou C. Regression of renal vascular and glomerular fibrosis: role of angiotensin II receptor antagonism and matrix metalloproteinases. J Am Soc Nephrol. 2003;14:1132-1144. [PubMed] [DOI] |
| 6. | Zhang X, Yu WP, Gao L, Wei KB, Ju JL, Xu JZ. Effects of lipopolysaccharides stimulated Kupffer cells on activation of rat hepatic stellate cells. World J Gastroenterol. 2004;10:610-613. [PubMed] [DOI] |
| 7. | Yang C, Zeisberg M, Mosterman B, Sudhakar A, Yerramalla U, Holthaus K, Xu L, Eng F, Afdhal N, Kalluri R. Liver fibrosis: insights into migration of hepatic stellate cells in response to extracellular matrix and growth factors. Gastroenterology. 2003;124:147-159. [PubMed] [DOI] |
| 8. | Chen PS, Zhai WR, Zhou XM, Zhang JS, Zhang YE, Ling YQ, Gu YH. Effects of hypoxia, hyperoxia on the regulation of expression and activity of matrix metalloproteinase-2 in hepatic stellate cells. World J Gastroenterol. 2001;7:647-651. [PubMed] |
| 9. | Gaça MD, Zhou X, Issa R, Kiriella K, Iredale JP, Benyon RC. Basement membrane-like matrix inhibits proliferation and collagen synthesis by activated rat hepatic stellate cells: evidence for matrix-dependent deactivation of stellate cells. Matrix Biol. 2003;22:229-239. [PubMed] [DOI] |
| 10. | Leroy V, Monier F, Bottari S, Trocme C, Sturm N, Hilleret MN, Morel F, Zarski JP. Circulating matrix metalloproteinases 1, 2, 9 and their inhibitors TIMP-1 and TIMP-2 as serum markers of liver fibrosis in patients with chronic hepatitis C: comparison with PIIINP and hyaluronic acid. Am J Gastroenterol. 2004;99:271-279. [PubMed] [DOI] |
| 11. | Johnson TS, Haylor JL, Thomas GL, Fisher M, El Nahas AM. Matrix metalloproteinases and their inhibitions in experimental renal scarring. Exp Nephrol. 2002;10:182-195. [PubMed] [DOI] |
| 12. | Nie QH, Duan GR, Luo XD, Xie YM, Luo H, Zhou YX, Pan BR. Expression of TIMP-1 and TIMP-2 in rats with hepatic fibrosis. World J Gastroenterol. 2004;10:86-90. [PubMed] |
| 13. | Zhang BB, Cai WM, Weng HL, Hu ZR, Lu J, Zheng M, Liu RH. Diagnostic value of platelet derived growth factor-BB, transforming growth factor-beta1, matrix metalloproteinase-1, and tissue inhibitor of matrix metalloproteinase-1 in serum and peripheral blood mononuclear cells for hepatic fibrosis. World J Gastroenterol. 2003;9:2490-2496. [PubMed] |
| 14. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Yanase K, Namisaki T, Imazu H. Tissue inhibitor of metalloproteinases-1 attenuates spontaneous liver fibrosis resolution in the transgenic mouse. Hepatology. 2002;36:850-860. [PubMed] [DOI] |
| 15. | Luo YJ, Yu JP, Shi ZH, Wang L. Ginkgo biloba extract reverses CCl4-induced liver fibrosis in rats. World J Gastroenterol. 2004;10:1037-1042. [PubMed] |
| 16. | Liu WB, Yang CQ, Jiang W, Wang YQ, Guo JS, He BM, Wang JY. Inhibition on the production of collagen type I, III of activated hepatic stellate cells by antisense TIMP-1 recombinant plasmid. World J Gastroenterol. 2003;9:316-319. [PubMed] [DOI] |
| 17. | Huang Y, Haraguchi M, Lawrence DA, Border WA, Yu L, Noble NA. A mutant, noninhibitory plasminogen activator inhibitor type 1 decreases matrix accumulation in experimental glomerulonephritis. J Clin Invest. 2003;112:379-388. [PubMed] [DOI] |
| 18. | Nezi L, Greco D, Nitsch L, Garbi C. The role of proteases in fibronectin matrix remodeling in thyroid epithelial cell monolayer cultures. Biol Chem. 2002;383:167-176. [PubMed] [DOI] |
| 19. | Haraguchi M, Border WA, Huang Y, Noble NA. t-PA promotes glomerular plasmin generation and matrix degradation in experimental glomerulonephritis. Kidney Int. 2001;59:2146-2155. [PubMed] [DOI] |
| 20. | Monea S, Lehti K, Keski-Oja J, Mignatti P. Plasmin activates pro-matrix metalloproteinase-2 with a membrane-type 1 matrix metalloproteinase-dependent mechanism. J Cell Physiol. 2002;192:160-170. [PubMed] [DOI] |
| 21. | Wu XR, Wang Q, Shi SS, Lu MH, Guo WD. The plasma levels of urokinase plasminogen activator and urokinase plasminogen activator receptor and plasminogen activator inhibitor-1 in patients with different stages of liver cirrhosis following chronic hepatitis B. Zhonghua Ganzangbing Zazhi. 2004;12:82-84. [PubMed] |
| 22. | Hattori N, Mizuno S, Yoshida Y, Chin K, Mishima M, Sisson TH, Simon RH, Nakamura T, Miyake M. The plasminogen activation system reduces fibrosis in the lung by a hepatocyte growth factor-dependent mechanism. Am J Pathol. 2004;164:1091-1098. [PubMed] [DOI] |
| 23. | Takeshita K, Hayashi M, Iino S, Kondo T, Inden Y, Iwase M, Kojima T, Hirai M, Ito M, Loskutoff DJ. Increased expression of plasminogen activator inhibitor-1 in cardiomyocytes contributes to cardiac fibrosis after myocardial infarction. Am J Pathol. 2004;164:449-456. [PubMed] [DOI] |
| 24. | Fogo AB. Renal fibrosis: not just PAI-1 in the sky. J Clin Invest. 2003;112:326-328. [PubMed] [DOI] |
| 25. | Zhang YJ, Yang XS, Wu PS, Li X, Zhang XF, Chen XQ, Yu ZX. Effects of angiotensin II and losartan on the growth and proliferation of hepatic stellate cells. Diyi Junyi Daxue Xuebao. 2003;23:219-221, 227. [PubMed] |
| 26. | Tokuda K, Kai H, Kuwahara F, Yasukawa H, Tahara N, Kudo H, Takemiya K, Koga M, Yamamoto T, Imaizumi T. Pressure-independent effects of angiotensin II on hypertensive myocardial fibrosis. Hypertension. 2004;43:499-503. [PubMed] [DOI] |