修回日期: 2004-02-09
接受日期: 2004-02-13
在线出版日期: 2004-06-15
目的: 研究丹参含药血清对肝星状细胞(HSC)的增生抑制作用, 并探讨中药抗肝纤维化筛选平台的建立.
方法: 测定HSC-T6细胞的细胞生长曲线和克隆形成率, 观察其细胞增生状况. 取原始血清体积分数的80%, 40%, 20%, 10%, 5%的丹参含药血清作用于HSC-T6细胞, 观察其增生抑制效应及量效关系.
结果: HSC-T6细胞的细胞群体倍增时间为10.57 h, 克隆形成率为82.4%, 说明该转化细胞系的活力较好, 增生能力较强. 在5-80%浓度范围之内, 丹参含药血清抑制HSC细胞增生作用呈剂量依赖性(经直线回归分析, 相关系数r = 0.9487).
结论: 丹参含药血清能明显抑制HSC-T6细胞增生, 呈剂量依赖性.
引文著录: 谈博, 张奉学, 刘妮, 郭兴伯. 丹参含药血清对肝星状细胞增生的抑制作用. 世界华人消化杂志 2004; 12(6): 1357-1360
Revised: February 9, 2004
Accepted: February 13, 2004
Published online: June 15, 2004
AIM: To investigate the inhibitory effect of Danshen-containing serum on the proliferation of HSC-T6 cells and to construct anti-hepatic-fibrosis in vitro system for screening potential herbal drugs.
METHODS: The proliferation status of HSC-T6 cells was evaluated by calculating its growth curve and cloning efficiency. HSC-T6 cells were exposed to different volume fractions of Danshen-containing serum, including 80%, 40%, 20%, 10%, and 5% of original serum, and its inhibitory effect and dose-effect relationship were investigated.
RESULTS: The population doubling time of HSC-T6 was 10.57 hours and its cloning efficiency was 82.4%, which showed that this cell line had good capacity of activity and proliferation for tests. Ranging from 5% to 80% of original concentration, Danshen-containing serum had the dose-dependent inhibitory effect on HSC-T6 cell (analysis by linear regression, coefficient of correlation = 0.9487).
CONCLUSION: The Danshen-containing serum has significantly inhibitory effect on proliferation of HSC-T6 cells in a dose-dependent manner.
- Citation: Tan B, Zhang FX, Liu N, Guo XB. Inhibitory effect of Danshen-containing serum on proliferation of HSC-T6 cells. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1357-1360
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1357.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1357
肝星状细胞的增生是肝纤维化病理发生发展过程中非常重要的关键环节. 有体外实验表明[1-2], 活血化瘀中药复方对于肝星状细胞增生有抑制作用, 这部分说明了其体内抗肝纤维化的作用机制. 但是, 由于中药复方组分繁多, 不易分清到底是哪些药物起主导作用. 因此, 我们从丹参的单药入手[3-4], 借助现代血清药理实验方法, 探讨其对肝星状细胞增生的影响.
DMEM培养基(高糖型)、新生小牛血清、胰蛋白酶及HEPES皆购自美国Gibco公司; L-谷氨酰胺及EDTA, Amresco进口分装, 上海生工生物工程公司; MTT, 美国sigma公司. 含药血清制备, 取SD大鼠, ♂, 质量275±15 g, 合格证号: 医实动第26-2001A003号, 由广州中医药大学实验动物中心提供. 丹参1 000 g, 购自广州中医药大学第一附属医院, 水煎浓缩成100%浓度(即1 kg/L). 参照临床常用药量, 以10 g/kg剂量给大鼠灌药[5-6], 连续3 d, 2次/d; 于第3 d给药后1 h用100 mL/L水合氯醛麻醉动物(剂量为3.5 mL/kg); 用750 mL/L酒精消毒后仰卧位固定, 无菌条件下分离一侧颈总动脉, 注入肝素50 U/kg, 用7号头皮针头插入颈总动脉进行采血, 离心分离血清(3 000 r/min×20, 4 ℃), 经56 ℃, 30 min灭活后, 再以0.45 mm 及 0.2 mm 双层微孔滤膜过滤除菌后-20 ℃保存备用.
肝星状细胞HSC-T6细胞株由上海中医药大学肝病研究所徐列明教授惠赠, 以DMEM(高糖)培养液(含100 mL/L胎牛血清)培养2-3 d可以传代, 中间换液1次. 传代时吸出旧培养液, 用DMEM(高糖)培养液清洗细胞一遍, 加入2.5 g/L胰蛋白酶消化至细胞收缩, 立即加入含100 mL/L胎牛血清的DMEM培养液5 mL, 终止消化, 吹打贴壁细胞, 使成细胞悬液, 然后按1:2比例接种于培养瓶内, 每瓶再加含100 mL/L胎牛血清的DMEM培养液10 mL, 置培养瓶于37 ℃, 50 mL/L CO2培养, 8 h即可贴壁生长; 2-3 d后细胞60-70%铺满瓶底即可再次传代, 传至3-4代, 细胞生长活跃, 增生明显即可用于实验. 取待测生长状态良好细胞, 增长至接近汇合时, 向培养瓶内加1 mL 2.5 g/L胰蛋白酶, 温箱37 ℃消化, 至细胞接近脱离瓶壁前吸出消化液, 加入新的培养液, 轻轻吹打制备成细胞悬液, 并计数; 取24孔培养板, 接种等量细胞悬液21孔, 分7组, 每组3孔; 从实验第2 d起, 依次计数检测各组的细胞总数, 并计算各组的均值, 直至第7组结束; 根据记录绘制细胞生长曲线, 并按下列公式计算细胞群体倍增时间(DT) = t/log2÷(logNt-logN0). t代表培养时间, N0及Nt分别代表接种后及培养t小时后的细胞数.
取80-90%汇合的细胞, 用2.5 g/L胰蛋白酶, 温箱37 ℃消化, 制备成单细胞悬液, 并计数; 根据细胞计数稀释成2个细胞/cm2(24孔板的底面积为2 cm2)的极低浓度, 接种到24孔塑料培养板, 置于培养箱培养(37 ℃, 50 mL/L CO2); 细胞贴壁后, 记录每孔内实际接种的细胞数; 隔24 h观察细胞克隆是否形成; 待细胞克隆形成, 终止培养, 镜下计算克隆数. 计算克隆形成率: 细胞克隆形成率 = 形成克隆数÷接种细胞数×100%.
实验分为正常血清对照组, 80%给药血清组, 40%给药血清组, 20%给药血清组, 10%给药血清组和5%给药血清组. 将细胞以DMEM培养液(含100 mL/L小牛血清)调成5×109/L的细胞悬液, 接种于96孔培养板100 mL/孔. 在37 ℃, 50 mL/L CO2条件下培养48 h, 更换无血清的DMEM培养液, 孵育12 h后, 加入100 mL含药血清, 每组设6个平行孔, 每孔的总体积为200 mL. 置37 ℃, 50 mL/L CO2, 饱湿条件下培养24 h, 每孔加入400 mg/L的MTT溶液100 mL, 继续培养4 h进行显色反应, 可见紫色甲臜颗粒. 弃去MTT液, 加1kg/L DMSO100 mL, 37 ℃静置10min, 待孔内甲臜颗粒完全溶解后置酶标仪上测570nm波长处吸光度(A值). 并根据A值计算药物对细胞增生的抑制率(IE) = 1-Ai/A0. 其中, IE(inhibitory effect)表示药物对细胞增生抑制率, Ai表示某浓度下的吸光度值, A0表示对照组细胞的吸光度值.
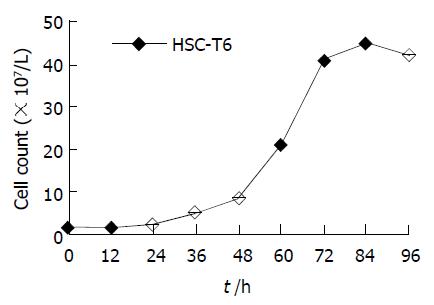
HSC-T6细胞经台盼蓝染色计数, 95%以上的细胞不着色, 说明培养中的HSC-T6细胞成活率较高.细胞生长曲线有明显的增生迟滞期(0-48 h); 在指数增生期(48-72 h)计算细胞群体倍增时间为10.57 h; 而且在72 h之后出现平台期, 而且由于细胞的老化, 甚至细胞数略有减少(84-96 h). (图1).
通过综合并计算4个复孔的接种细胞数和形成克隆的细胞数, 得到HSC-T6细胞的克隆形成率为14/17 = 82.4%.说明该转化细胞系的活力较好, 增生能力较强.
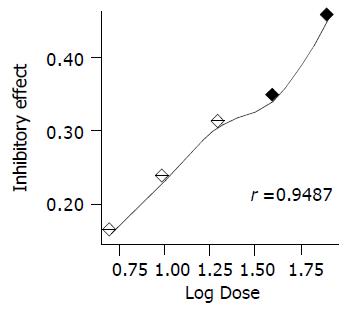
在5-80%浓度范围之内, 经直线回归分析得相关系数r = 0.9 487, 说明两个变量之间呈显著性正相关关系. 丹参含药血清抑制HSC细胞增生作用呈剂量依赖性. 经SSPS 10.0软件进行ANOVA分析, 各剂量组的A570值与对照组相比, 均具有显著性差异(P<0.05, 表1). 在5-80%这个浓度范围之内随着, 丹参含药血清浓度的提高, 细胞数有降低的趋势, 即丹参含药血清抑制细胞增生的作用逐渐加强. 若以抑制率(IE)作为纵座标, 以含药血清的对数浓度作为横座标, 作出量效曲线, 可以更加清楚地看到其中的规律: 丹参含药血清抑制HSC细胞增生活性呈明显剂量依赖性(图2).
| 培养液中丹参含药血清的体积分数 | 对照组 | |||||
| 80% | 40% | 20% | 10% | 5% | ||
| A570 | 0.76±0.01 | 0.88±0.07 | 0.93±0.09 | 1.03±0.02 | 1.13±0.03 | 1.34±0.05 |
| 抑制率 | 45.5% | 34.3% | 30.6% | 23.1% | 15.7% | - |
胶原代谢的异常和细胞外基质(ECM)构成变化是肝纤维化形成的主要特征, 而有充足证据证明肝星状细胞是主要的ECM生成细胞, 其激活和分泌活动增加是肝纤维化病理发生机制的重要环节[10-11]. 肝星状细胞的激活表现为复杂多样的表型, 包括组织中显著的功能与病理改变, 如细胞增生、纤维形成、细胞因子分泌紊乱及ECM降解等. 尽管该领域的研究手段与方法已深入到分子生物学层次, 但是抗肝纤维化药物对肝星状细胞增生的作用仍然是重点考察靶点之一[12-13]. 基于中医辨证论治的精神, 发挥中医药的传统优势, 当前中医药抗肝纤维化的实验研究多采用临床验证有效的复方药物作为考察对象. 其中多数复方具有活血化瘀功效: 如中药复方丹参的长期治疗能使部分患者降低PⅢP和LN的水平至正常范围[14]; 扶正化瘀方能抑制胶原合成, 促进胶原降解, 恢复肝脏结构及功能, 且抑制大鼠贮脂细胞和肝细胞增生和胶原生成率[1,2,15]; 血府逐瘀汤能抑制Ⅰ、Ⅲ型胶原[16], 抗纤方还可抑制HSC-LI90细胞TIMP-1的基因表达, 从而促进胶原降解[17-18]. 另外, 也有部分复方从清热利湿[19]和疏肝软坚[20-21]等多治则结合研究抗肝纤维化中药, 如中药抗纤软肝颗粒可抑制PDGF诱导的HSC增生, 并可能通过干扰Ras-MEK-MAPK信号通路发挥作用[22-23]. 但是, 复方成分比较复杂, 不易分清其针对某一特定模型的有效成分. 因此, 从中药单味药入手研究仍然有其积极意义. 在中药的体外研究引入血清药理学的研究方法, 这使得能一定程度上克服了传统的中药体外研究方法中的某些弊病[24-25].传统体外研究方法中, 将药物提取物直接加入细胞培养液中, 并不能反映药物在体内代谢中药物有效成分发生的变化; 另外, 在体外细胞药理实验中, 往往需要使用比色法检测有关药效和毒理学指标, 而许多中药制剂中所含色素或多或少地干扰了实验结果, 影响了实验的可靠性. 由于中药的有效成分可能是中药本身的化学成分, 也可能是他在炮制或提取过程中产生的中间产物, 还可能是进入体内后的代谢产物, 甚至可能是内源性物质的激活物, 通过采集药物代谢后的含药血清, 血清药理学方法就能够模拟药物成分经代谢转化后再作用于靶细胞的作用模式. 同时, 药物血清保持了一般血清的物理性状, 适宜细胞培养的环境, 能较好地满足比色分析法的实验要求[26]. 本研究中的丹参具有一系列重要药理作用, 如其有效成分丹酚酸B在体外有抗炎、抗氧化和抑制HSC增生与胶原合成的作用[27-28], 从丹参提取的单体IH764-3可诱导HSC凋亡[29-30]. 我们以丹参含药血清作为施加因素, 以HSC-T6细胞株为受试对象, 并以HSC细胞增生作为效应指标. 实验表明丹参含药血清能明显抑制HSC的细胞增生; 而且这种效应呈剂量依赖性, 即随着浓度的增加, 其抑制增生的效应也越大. 我们认为, 以HSC-T6细胞增生作为效应指标和以中药含药血清作为样品所构建的中药抗肝纤维化体外细胞模型(药物筛选平台)具有所需样品量少, 实验周期短, 并且药物作用靶点(HSC-T6细胞增生)明确等特点.
| 6. | 余 黎, 王 坚, 朱 荃. 中药血清药理学研究中血清处理方法的探讨. 南京中医药大学学报(自然科学版). 2002;18:222-223. |
| 7. | Vogel S, Piantedosi R, Frank J, Lalazar A, Rockey DC, Friedman SL, Blaner WS. An immortalized rat liver stellate cell line (HSC-T6): a new cell model for the study of retinoid metabolism in vitro. J Lipid Res. 2000;41:882-893. [PubMed] |
| 10. | Eng FJ, Friedman SL. Fibrogenesis I. New insights into hepatic stellate cell activation: the simple becomes complex. Am J Physiol Gastrointest Liver Physiol. 2000;279:G7-G11. [PubMed] |
| 11. | Senoo H. Structure and function of hepatic stellate cells. Med Electron Microsc. 2004;37:3-15. [PubMed] [DOI] |
| 12. | Albanis E, Friedman SL. Hepatic fibrosis. Pathogenesis and principles of therapy. Clin Liver Dis. 2001;5:315-334, v-vi. [PubMed] [DOI] |
| 13. | Pinzani M, Rombouts K. Liver fibrosis: from the bench to clinical targets. Dig Liver Dis. 2004;36:231-242. [PubMed] [DOI] |
| 17. | Zhao G, Wang LT, Chen JJ. Effect of anti-fibrosis compound contained serum on procollagen Type I and IV, matrix metalloproteinase and its tissue inhibitor-1 gene expression in HSC-LI90 cell line. Zhongguo Zhongxiyi Jiehe Zazhi. 2004;24:47-50. [PubMed] |
| 18. | Wang LT, Zhang B, Chen JJ. Effect of anti-fibrosis compound on collagen expression of hepatic cells in experimental liver fibrosis of rats. World J Gastroenterol. 2000;6:877-880. [PubMed] [DOI] |
| 19. | 于 世瀛, 贲 长恩, 杨 美娟, 赵 丽云, 白 锦雯. 清热利湿方药抗肝纤维化的形态学和免疫组织化学定量研究. 北京中医药大学 学报. 1997;20:28-30. |
| 21. | Zhang G, Zhang FC, Wang TC, Liang KH. The effects of Chinese national medicine of Huoxueruanjian compound on SMAD signal in hepatic stellate cell and its significance. Zhonghua Ganzangbing Zazhi. 2004;12:213-215. [PubMed] |
| 27. | Liu P, Liu CH, Wang HN, Hu YY, Liu C. Effect of salvianolic acid B on collagen production and mitogen-activated protein kinase activity in rat hepatic stellate cells. Acta Pharmacol Sin. 2002;23:733-738. [PubMed] |
| 28. | Liu CH, Liu P, Hu YY, Xu LM, Tan YZ, Wang ZN, Liu C. Effects of salvianolic acid-A on rat hepatic stellate cell proliferation and collagen production in culture. Acta Pharmacol Sin. 2000;21:721-726. [PubMed] |
| 29. | Zhang XL, Liu L, Jiang HQ. Salvia miltiorrhiza monomer IH764-3 induces hepatic stellate cell apoptosis via caspase-3 activation. World J Gastroenterol. 2002;8:515-519. [PubMed] [DOI] |
| 30. | Yao XX, Tang YW, Yao DM, Xiu HM. Effects of Yigan Decoction on proliferation and apoptosis of hepatic stellate cells. World J Gastroenterol. 2002;8:511-514. [PubMed] [DOI] |