修回日期: 2004-02-09
接受日期: 2004-03-18
在线出版日期: 2004-06-15
目的: 探讨树舌多糖抗肿瘤作用的机制.
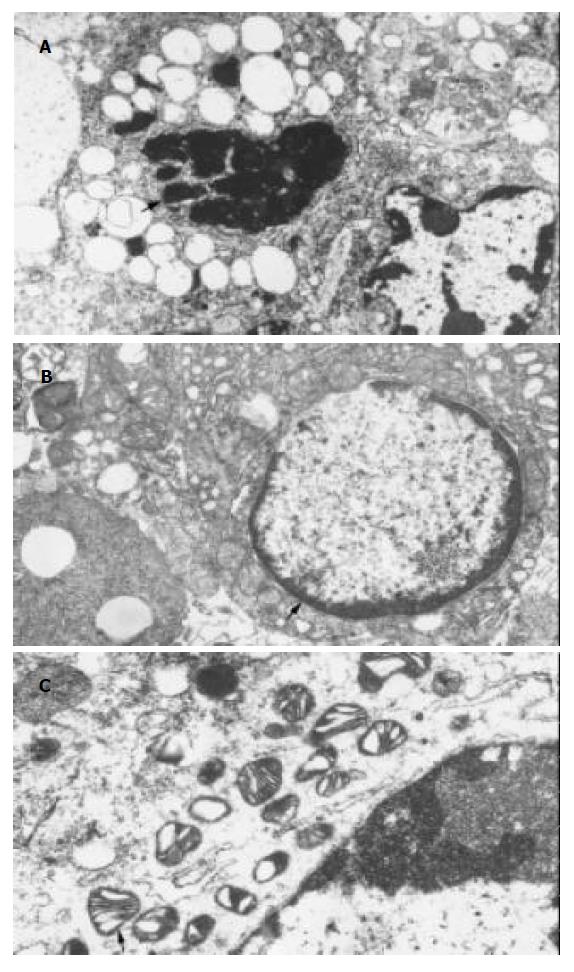
方法: 通过免疫组化、ELISA法分别测定瘤体和血清中抑癌基因P16, P27, Rb表达蛋白的量; 通过透射电镜观察凋亡小体是否存在.
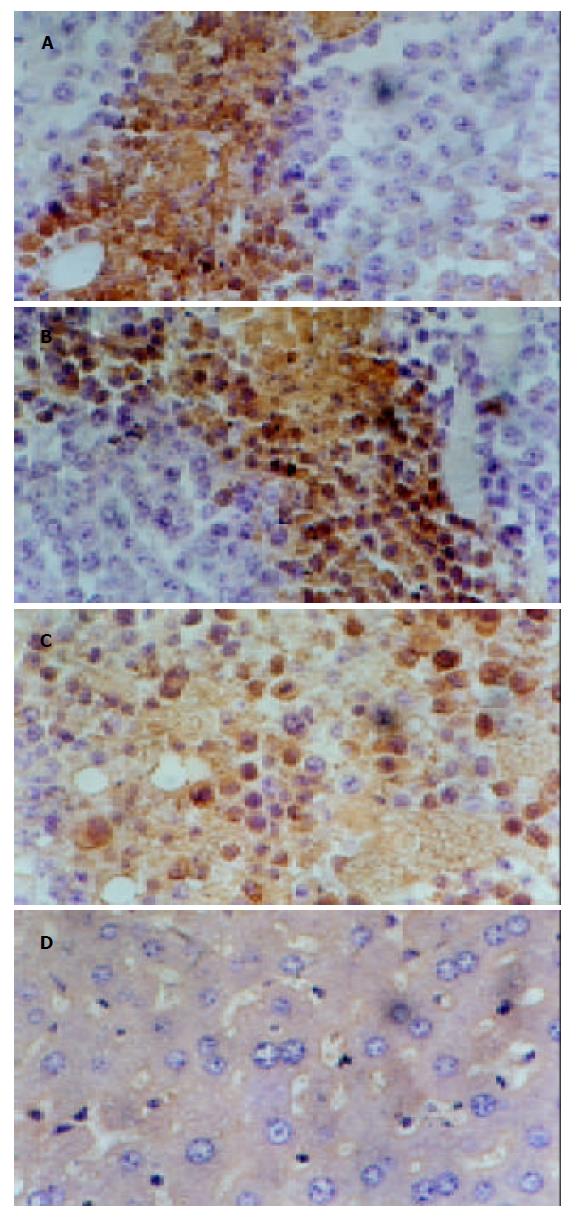
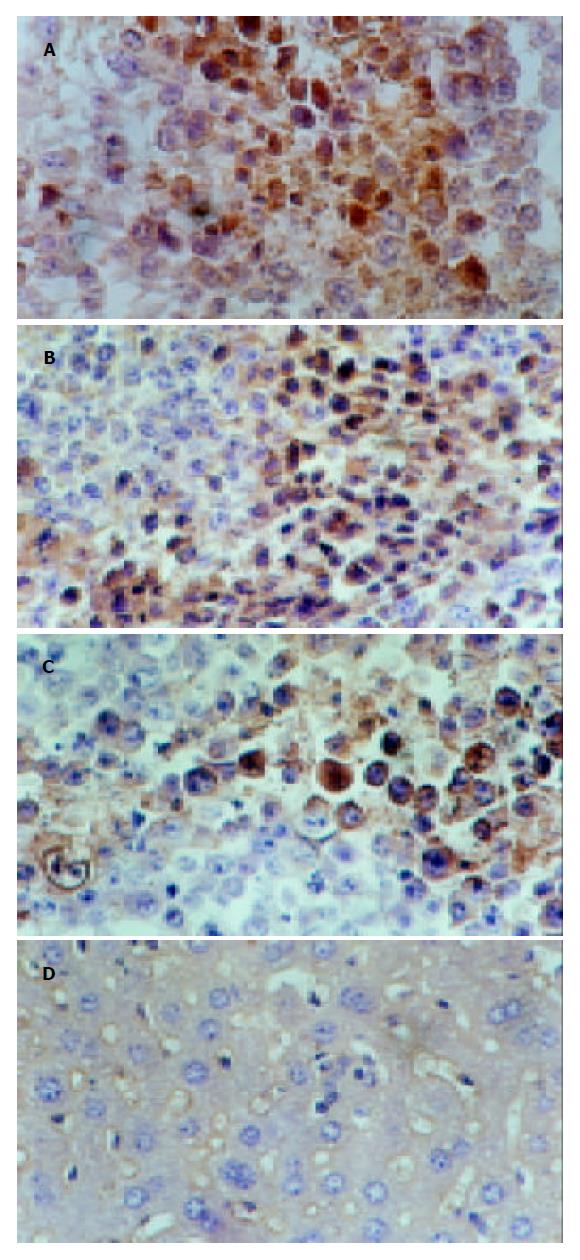
结果: 树舌多糖作用后P16, P27, Rb基因表达蛋白的量与盐水组有差异具有统计学意义, 免疫组化结果: bP<0.01, vs (1)(2); aP<0.05, vs (2)(3); dP<0.01, vs (3). ELISA结果: aP<0.05, vs (3); bP<0.01, cP<0.05, vs (4); dP<0.01, vs(3)(4); fP<0.01, vs (4); gP<0.05 , hP<0.01, vs (3). 且P16, P27表达的量与Rb呈负相关mr = -0.094 (1), nr = -0.446(1), 再有观察到凋亡小体的存在.
结论: 树舌多糖通过激活抑癌基因, 抑制肿瘤的生长促进肿瘤细胞凋亡.
引文著录: 王玉, 于英君, 徐广有, 王璐, 周丽. 树舌多糖对小鼠HepA P16 P27 Rb基因表达的影响. 世界华人消化杂志 2004; 12(6): 1353-1356
Revised: February 9, 2004
Accepted: March 18, 2004
Published online: June 15, 2004
AIM: To probe into the underlying mechanism of Ganoderm applanatum polysaccharide against cancer.
METHODS: By immunohistochemistry and ELISA, we detected the expression of tumor suppressor gene P16, P27 and Rb in tumor tissues and blood serum respectively; By electron microscopy, we observed whether the apoptotic body existed or not in the tumor tissues.
RESULTS: After the treatment of Ganoderm applanatum polysaccharide, there was obvious difference in the quantities of P16, P27 and Rb genes expression between the experimental and control groups (P < 0.01), and there was a negative correlation of P16 and P27 expression with that of Rb (mr = -0.094, nr = -0.446). We observed the existence of apoptotic body in the tumor cells in the experimental group under electron microscope.
CONCLUSION: By activating tumor suppressor gene, Ganoderm applanatum polysaccharide can control the growth of tumor and accelerate the tumor cell apoptosis.
- Citation: Wang Y, Yu YJ, Xu GY, Wang L, Zhou L. Influence Of Ganoderm applanatum polysaccharide on tumor suppressor genes P16, P27 and Rb in mice. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1353-1356
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1353.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1353
肿瘤细胞增生涉及细胞周期, 抑癌基因的主要机制之一就是使细胞分裂阻滞于细胞周期的某一时相G1期, 从而抑制细胞的异常增生. 树舌多糖抑瘤效果显著[1], 对小鼠瘤细胞rDNA[2]的表达和骨髓细胞SCE[3]都有影响而且差异显著, 并且树舌多糖不仅对小鼠HepA瘤细胞的蛋白质表达, 而且对血清蛋白表达也有影响[4]. 说明树舌多糖抗肿瘤作用是从基因水平发挥作用的. 另外, 树舌多糖的抑瘤作用从免疫角度也进行了研究, 促进HepA瘤细胞TNF的表达, 提高机体的免疫力[5]. 因此, 我们将要探讨树舌多糖作用后抑癌基因的表达及其作用途径.
可移型小鼠腹水型肝癌(HepA), 由黑龙江省肿瘤研究所引进, 于无菌条件下取父带瘤小鼠的肿瘤细胞2×107/L, 以0.2 mL接种于小鼠右前肢腋窝外皮下, 阳性率100%. 实验选用昆明种小白鼠雄性, 质量20±2 g. 将新接种的小白鼠随机分3组. 接种瘤株6 h后用药, 第1组 肌肉注射树舌多糖; 第2组 肌肉注射蕏苓多糖; 第3组 肌肉注射盐水, 肌肉注射每天1次, 第4组 为正常空白对照组. 连续给药7 d, 晚禁食12 h后取材. P16, P27, Rb 等ELISA试剂盒购于ABCAM公司. 包被液: 0.015 moL/L pH9.6碳酸盐缓冲液, 含0.2 g/L NaN3, 20 mL/L的牛血清白蛋白, 4 ℃保存不超过2 wk. 洗涤缓冲液: 0.01 moL/L pH7.4磷酸盐缓冲液, 含0.5 g/L Tween20, 0.2 g/L NaN3, 4 ℃保存不超过2 wk. 底物溶液: 0.1 moL/L pH5磷酸盐-柠檬酸缓冲液, 含邻苯二胺 (OPD Sigma公司) 0.4 g/L, 4 ℃保存不超过2 wk. 临用前加300 mL/L H2O2 1.5 mL/ L. 终止液: 2 moL/L硫酸. 酶标仪: 荷兰产MultiSkan Ascent.自动洗扳机: 荷兰产Wellwash 4MK2. P16, P27, Rb 等免疫组化试剂盒购于福州迈新试剂公司
ELISA法[6]采集眼血, 静置20 min后离心收集血清. 紫外96孔酶标板 距紫外灯高度10 cm, 时间20 min, 酶标板处理后, 在室温下冷却并使臭氧散去. 一块板同时作3个指标的检测, 向每个孔中分别加抗P16, 抗P27, 抗Rb (1:100) 50 mL混匀, 加盖封板纸, 4 ℃过夜, 第2 d取出, 洗扳机自动洗板5 min×3次. 加入血清(1: 4) 50 mL混匀加盖封板纸, 37 ℃培养箱2 h取出, 洗扳机自动洗板5 min×3次. 加入二抗(1: 600) 50 mL混匀, 加盖封板纸, 37 ℃培养箱2 h, 洗扳机自动洗板5 min×3次. 加入底物溶液50 mL混匀加盖封板纸, 室温、暗处放置20 min后, 加硫酸终止液50 mL终止酶促反应. 酶标板放在酶标仪下492 nm波长测定. 另断髓法处死小鼠, 取瘤体一部分做树脂包埋快, 另一部分做石蜡包埋快. 免疫组化采用石蜡切片, 按说明书操作, DAB显色, 透明封片. 然后利用多媒体图像分析系统进行统计分析. 树脂包埋块, 超薄切片, 铀铅双染色后, 在投射电镜下观察凋亡细胞、凋亡小体.
统计学处理 采用SPSS统计学软件分析
树舌多糖组与蕏苓多糖组无差异, 与盐水组差异显著, 与空白组无差异; 蕏苓多糖组与盐水组有差异, 与空白组无差异; 盐水组与空白组差异显著(表1).
免疫组化显示树舌多糖组与盐水组差异显著, 与蕏苓多糖组有差异; 蕏苓多糖组与盐水组有差异. 空白组由于这些蛋白的半衰期短没有检测到. 总之树舌多糖组P16高表达, P27高表达, Rb低表达; 盐水组P16低表达, P27低表达, Rb高表达(表2, 图1, 2). 投射电镜下观察显示膜相结构完整, 可见凋亡小体图1. 内膜系统结构清楚, 核固缩, 染色质周边凝集现象为凋亡细胞图2. 盐水组线粒体肿胀图3.
本实验采用ELISA法 、免疫组化法不同的方法测定树舌多糖作用后瘤细胞及血清中抑癌基因P16, P27, Rb表达蛋白的量. 发现树舌多糖的抗肿瘤作用是通过基因水平发挥作用的, 他激活抑癌基因P16, P27, Rb, 并且P16, P27表达的量与Rb呈负相关, 这与其他肿瘤的一些报道的相一致[7]. Rb在细胞核中以失活的磷酸化或活化的磷酸化形式存在, 活化的Rb蛋白对于细胞从G0-G1期, 进入S期有抑制作用. Rb基因使肿瘤细胞逆转以及抑制细胞增生的作用机制尚不十分清楚, 但目前认为Rb在细胞凋亡中的调节作用可能是其中之一[8,15]. P27作为一种细胞周期抑制因子, 其功能已广为接受, Surendra et al认为P27蛋白定位于细胞核是其抑制肿瘤进展的前提条件, 而出现在细胞质P27蛋白表达与患者生存期缩短有关. P27蛋白水平主要在转录后的蛋白质翻译和降解阶段进行调节. 正常情况下, 当细胞处于G0/ G1期时, P27蛋白表达增高, 进入S期则下降. P27的主要功能是抑制细胞的生长, 当P27表达下降或缺失时, 可导致基因组的不稳定, 甚至肿瘤的发生[11]. 本实验观察到树舌多糖作用后, 通过PAGE电泳不仅在瘤细胞中检测到这些蛋白而且也同时在血清中检测到P16, P27, Rb基因表达的蛋白, 通过免疫组化, ELISA法判断P16, P27基因表达蛋白水平增加, 而Rb基因表达蛋白水平减少. 由于免疫组化不能客观地反映结果, 他只能从定性角度说明, 而ELISA却能从ng水平进行定量说明, 能真实的反映结果, 所以我们认为树舌多糖的抗肿瘤作用是从基因水平发挥作用的. 他刺激抑癌基因P16, P27表达增加, P16是肿瘤抑制基因, 与细胞周期密切相关, 在他与Rb, Cyclin D1/CDK4共同组成的细胞增生调控中, P16作为Cyclin D1/CDK4复合物的特异性抑制而发挥作用. Rb作为CDK4的重要底物之一, 是参与细胞周期调控的的又一重要因子, 在正常细胞中存在一个负反馈网络, 即磷酸化的Rb增加时, 可引起P16蛋白表达增强, 增加的P16与Cyclin D1竟争结合CDK4, 而抑制CDK4的活性, 防止Rb过度磷酸化, 从而阻断Cyclin D1与Rb介导的转录因子E2F活化使细胞免于增生周期调节失控, 起到抑制瘤细胞生长的作用. 由于P16蛋白作用的靶目标过于单调, 不可能完全控制肿瘤细胞的增生, 而P27的独特功能在于其几乎可以抑制所有的Cyclin-CDK复合物的激酶活性, 其中包括Cyclin E2-CDK, 而Cyclin E2可能是G1期的限速因子[9]. P27可以阻止Rb的磷酸化, 使Rb以磷酸化和非磷酸化的形式积累, 从而影响周期的进程, 同时P27和Rb起协同作用, 通过整和调节信号, 而抑制肿瘤的发生[10]. Hoshino et al在研究中发现P27表达上调对于肿瘤细胞外信号调节激酶通路性的特异性阻制是必需的, 而该阻制又会导致肿瘤细胞完全生长抑制[12], 所以说树舌多糖的抗肿瘤作用是从基因水平发挥作用的, 激活抑癌基因而达到抗肿瘤作用的. 另外树舌多糖的抗肿瘤作用是通过促进肿瘤细胞凋亡来实现的. P16, P27, Rb野生型蛋白量低、半衰期短, 用一般的免疫组化法不能检出, 应用ELISA法可以检测到. 在复杂的人体"基因网络"中, P16基因很可能是与其他基因相互作用, 共同参与细胞凋亡调控等其他生命现象. 单基因、单作用是不符合大多数生命现象调控本质的, 尤其是真核高等生命[13]. P16诱导肿瘤细胞凋亡的原因可能是P16基因通过调控细胞周期, 协同其他凋亡因子共同作用的结果, P16基因G1期阻断而发挥作用的, P16基因通过降低Rb的表达, 使肿瘤细胞增加了对凋亡的敏感性, 如再行P53诱导肿瘤细胞可发生凋亡. Masahiro首次在人类肿瘤中证实P27表达与凋亡之间有显著的相关性, 他在研究非早期胃癌中肿瘤细胞的P27的表达与细胞凋亡关系时发现P27表达下降, 凋亡率也下降, 这与本研究相一致, P27表达增加, 凋亡细胞增加. P27促进凋亡的功能可能与控制肿瘤的进展相关[14]. 总之, 本实验只是探讨了树舌多糖作用后抑癌基因P16, P27, Rb表达蛋白的量发生了变化, 但是通过什么途径引起的这些变化, 基因结构本身有无变化, 再有促进肿瘤细胞凋亡的过程中还有哪些基因参与有待进一步研究. 所以本课题的下一个研究内容是抑癌基因P16, P27, Rb与MAPK及MAP的关系以及对细胞骨架的影响, 再有抑癌基因的调节作用主要是通过转录水平进行的, 所以对P16, P27, Rb的启动子等序列的检测也是下一个工作重点.
| 7. | Howard CM, Claudio PP, De Luca A, Stiegler P, Jori FP, Safdar NM, Caputi M, Khalili K, Giordano A. Inducible pRb2/p130 expression and growth-suppressive mechanisms: evidence of a pRb2/p130, p27Kip1, and cyclin E negative feedback regulatory loop. Cancer Res. 2000;60:2737-2744. [PubMed] |
| 9. | Claudio PP, Stiegler P, Howard CM, Bellan C, Minimo C, Tosi GM, Rak J, Kovatich A, De Fazio P, Micheli P. RB2/p130 gene-enhanced expression down-regulates vascular endothelial growth factor expression and inhibits angiogenesis in vivo. Cancer Res. 2001;61:462-468. [PubMed] |
| 10. | Park MS, Rosai J, Nguyen HT, Capodieci P, Cordon-Cardo C, Koff A. p27 and Rb are on overlapping pathways suppressing tumorigenesis in mice. Proc Natl Acad Sci USA. 1999;96:6382-6387. [PubMed] [DOI] |
| 12. | Hoshino R, Tanimura S, Watanabe K, Kataoka T, Kohno M. Blockade of the extracellular signal-regulated kinase pathway induces marked G1 cell cycle arrest and apoptosis in tumor cells in which the pathway is constitutively activated: up-regulation of p27(Kip1). J Biol Chem. 2001;276:2686-2692. [PubMed] [DOI] |
| 13. | Van Erk MJ, Teuling E, Staal YC, Huybers S, Van Bladeren PJ, Aarts JM, Van Ommen B. Time- and dose-dependent effects of curcumin on gene expression in human colon cancer cells. J Carcinog. 2004;3:8. [PubMed] [DOI] |
| 14. | Ohtani M, Isozaki H, Fujii K, Nomura E, Niki M, Mabuchi H, Nishiguchi K, Toyoda M, Ishibashi T, Tanigawa N. Impact of the expression of cyclin-dependent kinase inhibitor p27Kip1 and apoptosis in tumor cells on the overall survival of patients with non-early stage gastric carcinoma. Cancer. 1999;85:1711-1718. [PubMed] [DOI] |