修回日期: 2004-03-14
接受日期: 2004-03-18
在线出版日期: 2004-06-15
目的: 克隆和在真核细胞中表达鼠CD40配体(mCD40L)基因, 为进一步研究打下基础.
方法: 用RT-PCR法扩增mCD40L基因片段, 定向插入真核表达载体pcDNA3.1+中, 重组质粒用脂质体转染H22细胞, G418筛选抗性细胞, 用RT-PCR检测目的基因的插入, 间接免疫荧光检测目的基因的表达.
结果: 含mCD40L基因重组表达质粒用酶切分析和序列测定进行鉴定后, 转染H22细胞经G418筛选获得抗性细胞, 经RT-PCR鉴定有含目的基因, 间接免疫荧光鉴定有mCD40L的表达.
结论: 成功克隆mCD40 L基因并在真核细胞得到有效表达.
引文著录: 蒋永芳, 苏先狮, 龚国忠, 何艳, 许允. 鼠CD40配体基因的克隆及表达. 世界华人消化杂志 2004; 12(6): 1349-1352
Revised: March 14, 2004
Accepted: March 18, 2004
Published online: June 15, 2004
AIM: To study sub-cloning and expression of murine CD40 ligand (mCD40L) gene in eukaryotic cells as a basis for further study.
METHODS: The mCD40L gene fragment was amplified by using RT-PCR and sub-cloned into eukaryotic expression plasmid pcDNA3.1+, then transfected into H22 cell with Lipofectamine. After 2-3 weeks selection with G418, DNA was extracted from infected cells and tested by RT-PCR, indirect immunofulorescence were used to detect the expression of mCD40 L.
RESULTS: The insertion mCD40L gene fragment in the eukaryotic expression plasmid was confirmed by enzyme digestion with EcoR I and Nhe I and sequence analysis. The result RT-PCR showed that mCD40L gene had been integrated into the genome of infected H22 cells. Indirect immunofulorescence analysis showed that mCD40L had been expressed in these cells.
CONCLUSION: The mCD40L gene is integrated into eukaryotic cells with eukaryotic expression plasmid and target gene is expressed efficiently.
- Citation: Jiang YF, Su XS, Gong GZ, He Y, Xu Y. Cloning and expression of murine CD40 ligand gene. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1349-1352
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1349.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1349
CD40配体(CD40L)是分子质量为39 kd的糖蛋白, 在淋巴细胞和非淋巴细胞表面均有表达, 属肿瘤坏死因子家族中的一员, 可与抗原提呈细胞(APC)上的CD40结合. CD40-CD40L相互作用在激活APC及激发细胞免疫和体液免疫方面起重要作用[1]. 通过转导CD40L基因有可能成为治疗恶性肿瘤的一种有效的方法. 我们构建鼠CD40配体(mCD40L)基因真核表达载体及其表达, 为进一步研究打下基础.
真核表达载体pcDNA3.1+, 带有强有力的巨细胞病毒CMV增强启动子, 能高效表达插入的目的基因, 含SV40启动子, 控制G418抗性基因的表达, 购于美国Promega公司; 大肠杆菌JM109, 购于美国Promega公司; Balb/C小鼠肝癌细胞株H22细胞购自武汉大学典型物保存中心; 修饰酶、连接酶和质粒回收试剂盒购自Promega公司; 限制性内切酶NheI和EcoRI分别购自大连宝生物有限公司和华美生物工程公司; DNA分子量标准(1 031 bp), MBI产品; PCR纯化试剂盒, 美国QIAGEN公司产品; RPMI1640培养基和G418购自美国Gibico公司; 脂质体转染剂 Lipofectamine PlusTM Reagent购自美国Invitrogen公司; SABC-FITC试剂盒购自武汉博士德生物工程有限公司. 根据mCD40L基因序列及载体要求, 我们设计扩增的引物序列分别为: 5'-GAC GCT AGC ATG ATA GAA ACA TAC AGC CAA CCT-3'和5'-GCC GAA TTC TCA GAG TTT GAG TAA GCC AAA AGA-3', 在引物的两端分别含有NheI和EcoRI酶切位点, 由上海生工合成.
1.2.1 RT-PCR扩增mCD40L cDNA: 从Balb/c 小鼠的脾细胞提取细胞总的RNA后, 以Oligod(T)18合成第一链cDNA, 作为PCR模板, 用PCR法扩增鼠CD40L基因, 反应条件为: 94 ℃ 5 min, 94 ℃ 60 s、60 ℃ 50 s、72 ℃ 90 s 共35个循环, 72 ℃ 10 min. 10 g/L琼脂糖凝胶电泳检查PCR扩增带, 并用PCR纯化试剂盒回收特异PCR扩增片段.
1.2.2 表达重组体的构建及鉴定: 先用T-A克隆将PCR产物和pUCm-T载体连接, 构建中间重组体(pUCm-T-mCD40L), 经酶切鉴定和序列分析后. 将pUCm-T-mCD40L和真核表达载体pcDNA3.1+均分别用NheI和EcoRI酶进行消化, 回收目的片段. 将含NheI和EcoRI两粘端的PCR产物定向亚克隆于含与之相匹配两粘端的pcDNA3.1+, 构建成真核表达重组体(pcDNA3.1+-mCD40L cDNA ). 通过NheI和EcoRI双酶切和序列分析进行鉴定.
1.2.3 质粒转染小鼠肝癌细胞株H22及筛选: 常规复苏H22细胞, 适时传代, 细胞增生至足量后按2.5×105个细胞/孔的浓度接种六孔板中, 按脂质体转染Lipofectamine PlusTM Reagent试剂盒说明书进行, 简述如下, 4 mL脂质体和4 mg重组质粒混合, 放置15 min后加到有H22细胞的六孔培养板中, 37 ℃ 50 mL/L CO2的培养箱中孵育3 h后, 改用200 mL/L胎牛血清的RPMI1640培养基继续培养, 转染后4 d后, 细胞1:20传代, 改用含G418的选择培养基进行筛选(G418浓度前2 d为250 mg/L, 3-4 d为500 mg/L, 以后为800 mg/L), 隔日换液, 一共选择培养18 d, 至阴性对照孔细胞全部死亡后恢复普通培养.
1.2.4 mCD40L在真核细胞中的表达: 将抗性H22细胞扩增培养后, 提取细胞RNA, 按前面的反应体系和反应条件, 用RT-PCR方法检测目的基因. H22细胞涂片后, 用间接免疫荧光法检测mCD40L的表达(按SABC-FITC试剂盒操作指南).
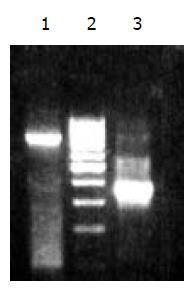
以总RNA作为模板, 18聚T寡核苷酸作引物合成cDNA第一链, 然后用特异引物进行PCR扩增, 能顺利扩增出大小约783 bp的条带(图1).
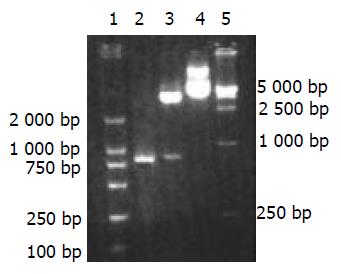
中间重组体(pUCm-T-mCD40L) 经酶切鉴定和序列分析证明正确后, 用NheI和EcoRI酶切将PCR产物定向亚克隆于表达质粒pcDNA3.1+中, 构建表达重组体(pcDNA3.1+-mCD40L), 将pcDNA3.1+-mCD40LcDNA用NheI和EcoRI双酶切, 可获得两个片段, 小片段与PCR产物一致(图2). 重组质粒经测序证实有包括起使密码子和终止密码子在内的完整的mCD40L基因片段插入pcDNA3.1+载体中(图3).
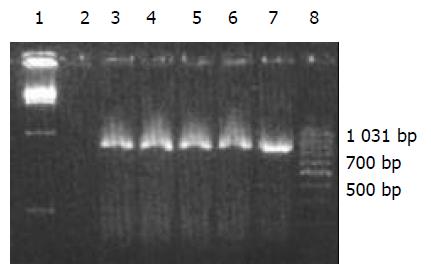
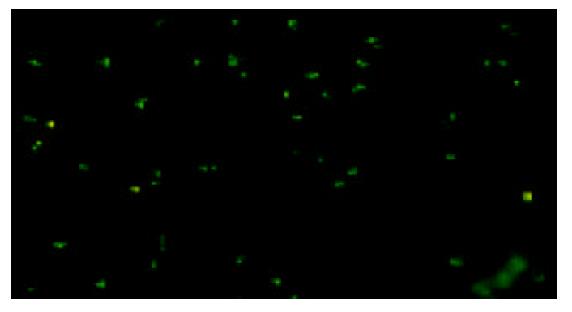
逆转录PCR检测到mCD40L在H22细胞中表达(图4); 用间接免疫荧光法检测到用pcDNA3.1+-mCD40L转染后的H22细胞中荧光染色阳性, 证明有mCD40L的表达(图5).
肝细胞癌是我国最常见的恶性肿瘤之一[2-3], 由于肝细胞癌对于各种治疗方法的疗效均很差, 且易转移, 使之成为治疗上最困难的肿瘤之一[4]. 所以急需寻找新的治疗方法, 近年来随着分子生物学的飞速发展, 免疫基因治疗被认为是一种很有前途的治疗方法[5]. 在免疫基因治疗研究方面, 选择有效的目的基因至关重要. CD40配体(CD40L), 又称作CD154, 属于肿瘤坏死因子基因超家族中的一员, 在激活的T细胞等多种细胞表面均有CD40L的表达, 同样包括B细胞和多种肿瘤细胞在内细胞表面有CD40分子的表达, CD40L和CD40相互作用, 能激活B细胞和前凝血质, 促进黏附因子、细胞因子、化学因子和MMP的释放[1]. 其实质是诱发体液免疫和细胞介导的免疫反应. 正由于CD40L/CD40相互作用所具有的多种生物学活性, 将外源目的基因CD40L基因导入机体内, 可能产生强烈的抗肿瘤免疫反应, 而将CD40L基因联合其他免疫治疗基因(如IL-12, CD80等)或肿瘤相关抗原(如AFP)疗效可能更好[6]. 利用鼠CD40L基因已开展了许多抗肿瘤免疫方面的研究, 治疗策略包括有: 用CD40L基因或者联合IL-12基因转染白血病细胞, 再把这些细胞注入机体内治疗急性白血病[7]和慢性B淋巴细胞性白血病[8]等, 能诱导明显的抗白血病免疫反应; 利用一定的载体将鼠CD40L基因导入荷瘤动物体内治疗肺癌[9-10]、结肠癌[11]、膀胱癌[12-15]肝癌[16-17]、胸膜间皮瘤[18]、胃癌[19]和黑色素瘤[20]等, 结果表明鼠CD40L基因均能激活T细胞、上调IL-12等细胞因子水平和增加NK细胞活力等保护性免疫反应和增加癌细胞凋亡, 从而使荷瘤鼠的瘤结节退化, 能持久抑制再次注入的癌细胞的生长, 动物存活期延长; 由于CD40L转染DC细胞后能促进DC细胞成熟和分泌IL-12[21-22], 所以通过转染CD40L基因制备DC瘤苗同样可以治疗肿瘤; 自体T细胞经巨噬细胞集落刺激因子和IL-4刺激后, CD40L分泌增多, 这样联合DC细胞和激活后的自体T细胞成为癌症免疫基因治疗的一种新的方法[23]. CD40L基因的治疗策略为癌症的基因治疗开辟一条新的途径. 我们以鼠脾细胞总RNA为模板, 用RT-PCR方法, 成功扩增出了特异的mCD40L基因, DNA序列测定表明, 所扩增的片段的确是mCD40L基因片段, 与国外报道的基因序列完全一致. 在此基础上, 成功构建了真核表达重组体pcDNA3.1+-mCD40L, 重组质粒转染真核细胞后, 检测到有mCD40L的表达, mCD40L真核表达载体的构建和有效表达, 为下一步研究其生物学活性和免疫基因治疗肝癌打下了良好的基础.
| 1. | Schönbeck U, Mach F, Libby P. CD154 (CD40 ligand). Int J Biochem Cell Biol. 2000;32:687-693. [PubMed] [DOI] |
| 2. | Tang ZY. Hepatocellular carcinoma--cause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [PubMed] [DOI] |
| 3. | Zhang G, Long M, Wu ZZ, Yu WQ. Mechanical properties of hepatocellular carcinoma cells. World J Gastroenterol. 2002;8:243-246. [PubMed] |
| 4. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 5. | Rosenberg SA. A new era for cancer immunotherapy based on the genes that encode cancer antigens. Immunity. 1999;10:281-287. [PubMed] [DOI] |
| 6. | Afford SC, Young LS. Gene therapy for hepatocellular carcinoma-teaching old dogs new tricks. Hepatology. 2001;34:207-209. [PubMed] [DOI] |
| 7. | Saudemont A, Buffenoir G, Denys A, Desreumaux P, Jouy N, Hetuin D, Bauters F, Fenaux P, Quesnel B. Gene transfer of CD154 and IL12 cDNA induces an anti-leukemic immunity in a murine model of acute leukemia. Leukemia. 2002;16:1637-1644. [PubMed] [DOI] |
| 8. | Wendtner CM, Kofler DM, Theiss HD, Kurzeder C, Buhmann R, Schweighofer C, Perabo L, Danhauser-Riedl S, Baumert J, Hiddemann W. Efficient gene transfer of CD40 ligand into primary B-CLL cells using recombinant adeno-associated virus (rAAV) vectors. Blood. 2002;100:1655-1661. [PubMed] |
| 9. | Noguchi M, Imaizumi K, Kawabe T, Wakayama H, Horio Y, Sekido Y, Hara T, Hashimoto N, Takahashi M, Shimokata K. Induction of antitumor immunity by transduction of CD40 ligand gene and interferon-gamma gene into lung cancer. Cancer Gene Ther. 2001;8:421-429. [PubMed] [DOI] |
| 10. | Tada Y, O-Wang J, Yu L, Shimozato O, Wang YQ, Takiguchi Y, Tatsumi K, Kuriyama T, Takenaga K, Sakiyama S. T-cell-dependent antitumor effects produced by CD40 ligand expressed on mouse lung carcinoma cells are linked with the maturation of dendritic cells and secretion of a variety of cytokines. Cancer Gene Ther. 2003;10:451-456. [PubMed] [DOI] |
| 11. | Sun Y, Peng D, Lecanda J, Schmitz V, Barajas M, Qian C, Prieto J. In vivo gene transfer of CD40 ligand into colon cancer cells induces local production of cytokines and chemokines, tumor eradication and protective antitumor immunity. Gene Ther. 2000;7:1467-1476. [PubMed] [DOI] |
| 12. | Loskog A, Tötterman TH, Böhle A, Brandau S. In vitro activation of cancer patient-derived dendritic cells by tumor cells genetically modified to express CD154. Cancer Gene Ther. 2002;9:846-853. [PubMed] [DOI] |
| 13. | Loskog A, Björkland A, Brown MP, Korsgren O, Malmström PU, Tötterman TH. Potent antitumor effects of CD154 transduced tumor cells in experimental bladder cancer. J Urol. 2001;166:1093-1097. [PubMed] [DOI] |
| 14. | Hussain SA, Ganesan R, Hiller L, Murray PG, el-Magraby MM, Young L, James ND. Proapoptotic genes BAX and CD40L are predictors of survival in transitional cell carcinoma of the bladder. Br J Cancer. 2003;88:586-592. [PubMed] [DOI] |
| 15. | Kimura T, Ohashi T, Kikuchi T, Kiyota H, Eto Y, Ohishi Y. Antitumor immunity against bladder cancer induced by ex vivo expression of CD40 ligand gene using retrovirus vector. Cancer Gene Ther. 2003;10:833-839. [PubMed] [DOI] |
| 16. | Schmitz V, Barajas M, Wang L, Peng D, Duarte M, Prieto J, Qian C. Adenovirus-mediated CD40 ligand gene therapy in a rat model of orthotopic hepatocellular carcinoma. Hepatology. 2001;34:72-81. [PubMed] [DOI] |
| 17. | Yanagi K, Nagayama Y, Nakao K, Saeki A, Matsumoto K, Ichikawa T, Ishikawa H, Hamasaki K, Ishii N, Eguchi K. Immuno-gene therapy with adenoviruses expressing fms-like tyrosine kinase 3 ligand and CD40 ligand for mouse hepatoma cells in vivo. Int J Oncol. 2003;22:345-351. [PubMed] [DOI] |
| 18. | Friedlander PL, Delaune CL, Abadie JM, Toups M, LaCour J, Marrero L, Zhong Q, Kolls JK. Efficacy of CD40 ligand gene therapy in malignant mesothelioma. Am J Respir Cell Mol Biol. 2003;29:321-330. [PubMed] [DOI] |
| 19. | Yamaguchi H, Tanaka F, Sadanaga N, Ohta M, Inoue H, Mori M. Stimulation of CD40 inhibits Fas- or chemotherapy-mediated apoptosis and increases cell motility in human gastric carcinoma cells. Int J Oncol. 2003;23:1697-1702. [PubMed] [DOI] |
| 20. | Peter I, Nawrath M, Kamarashev J, Odermatt B, Mezzacasa A, Hemmi S. Immunotherapy for murine K1735 melanoma: combinatorial use of recombinant adenovirus expressing CD40L and other immunomodulators. Cancer Gene Ther. 2002;9:597-605. [PubMed] [DOI] |
| 21. | Mackey MF, Wang Z, Eichelberg K, Germain RN. Distinct contributions of different CD40 TRAF binding sites to CD154-induced dendritic cell maturation and IL-12 secretion. Eur J Immunol. 2003;33:779-789. [PubMed] [DOI] |
| 22. | Onaitis MW, Kalady MF, Emani S, Abdel-Wahab Z, Tyler DS, Pruitt SK. CD40 ligand is essential for generation of specific cytotoxic T cell responses in RNA-pulsed dendritic cell immunotherapy. Surgery. 2003;134:300-305. [PubMed] [DOI] |
| 23. | Sato T, Terai M, Yasuda R, Watanabe R, Berd D, Mastrangelo MJ, Hasumi K. Combination of monocyte-derived dendritic cells and activated T cells which express CD40 ligand: a new approach to cancer immunotherapy. Cancer Immunol Immunother. 2004;53:53-61. [PubMed] [DOI] |