修回日期: 2004-03-09
接受日期: 2004-03-16
在线出版日期: 2004-06-15
目的: 探讨急性肝坏死动物血脑屏障通透性异常改变.
方法: 将280只♂Balb/c小鼠分为4组, 应用内毒素(LPS, 10 mg/kg)和D-氨基半乳糖(GalN, 800 mg/kg)联合ip, 建立急性肝坏死小鼠模型. 并检测血清ALT, 观察肝脏组织病理学变化, 利用伊文思蓝研究小鼠血脑屏障通透性的改变情况.
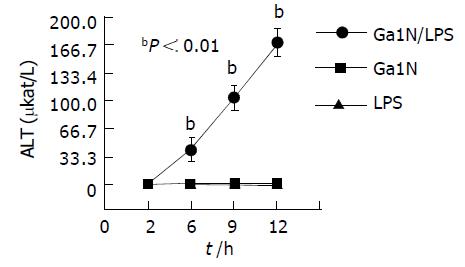
结果: 单独应用LPS或GalN仅使血清ALT轻度升高, 动物无死亡. 而联合应用后ALT则从6 h开始明显升高(41.89±14.57 mkat/L), 到12h达高峰(170.30±16.13 mkat/L), 较其他各组均有显著性差异(P<0.01). 动物从6 h开始死亡, 9 h达高峰, 总死亡率达66.6%.肝脏HE染色可见大块或亚大块出血性坏死, 而其他组仅见单个或灶状肝细胞坏死, 部分细胞脂肪变性. 并且脑组织EB含量在各时间点均较其他组明显升高.
结论: 在急性肝坏死动物中存在血脑屏障通透性异常增加的改变, 可能是引起脑水肿发生的重要机制.
引文著录: 吕飒, 宋红丽, 王静艳, 刘沛. 急性肝坏死小鼠血脑屏障通透性的改变. 世界华人消化杂志 2004; 12(6): 1346-1348
Revised: March 9, 2004
Accepted: March 16, 2004
Published online: June 15, 2004
AIM: To study the permeability of the blood brain barrier (BBB) in a mouse model of acute liver necrosis.
METHODS: Male Balb/c mice were divided into 4 groups. In one group, mice were intraperitoneal of lipopolysaccharide (LPS, 10mg/kg) with D-galactosamine (GalN, 800 mg/kg) to induce acute liver necrosis. Other groups were controls. Serum levels of alanine transaminase (ALT) were determined and the liver tissues were fixed for histopathological analysis. The permeability of BBB in mice was investigated with Evans blue (EB).
RESULTS: The serum levels of ALT were increased mildly in mice, which were administration of LPS or GalN alone. And no animals died. But the levels of ALT began to increase at 6 hours (41.89±14.57 mat/L), and reached a maximal level at 12 hours (170.30±16.13 mat/L) after injection with both LPS and GalN. Mice began to die at 6 hours, and at 9 hours after injection, the rate of lethality reached an extremely high level of 66.6%. The liver became massive or submassive necrosis. The concentration of EB in brain was significantly increased in ALF models compared with other groups.
CONCLUSION: The permeability of BBB is increased in acute liver necrosis model. It may be the mechanism of the brain edema.
- Citation: Lu S, Song HL, Wang JY, Liu P. Blood brain barrier permeability in acute liver necrosis of mice. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1346-1348
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1346
急性肝衰竭(acute liver failure, ALF)的死亡率很高, 其中50-80%的患者死于脑水肿引起的颅高压[1]. 脑水肿包括细胞毒性和血管源性脑水肿, 后者以血脑屏障(blood-brain barrier, BBB)通透性的改变为主要原因. 我们应用伊文思蓝(Evens blue, EB)体内注射后检测急性肝坏死动物脑组织中含量, 观察其血脑屏障通透性改变.
♂Balb/c小鼠280只, 6-8周龄, 体质量18-22 g, 由中国医科大学动物中心提供. D-氨基半乳糖(D- galactosamine, GalN)由北京药物研究所提供, LPS (E.coli O127:B8)购自Sigma公司, 伊文思蓝(EB)购自Fluka公司, 甲酰胺为分析纯. 小鼠随机分为4组. 1组(生理盐水对照组)50只, 2组(LPS对照组)50只, 3组(GalN对照组)50只, 4组(肝坏死组: GalN+LPS)130只. 各组分5个时间点(2, 6, 9, 12, 24 h), 每个时间点10只小鼠. GalN 800 mg/kg, LPS 10 mg/kg, 均为ip, 生理盐水为相同体积ip, 20 g/L EB (2 mg/kg)于处死动物前2 h尾静脉注射.每时间点动物中5只检测EB含量, 另5只留血及肝脏组织标本待检.
血脑屏障通透性的检测首先建立标准曲线. 取EB10 mg溶于100 mL生理盐水中, 取0.1 mL加入1.9 mL甲酰胺中, 混匀作为第1管, 从中取0.1 mL加入1.9 mL甲酰胺中混匀作为第2管, 再从中取1 mL加入1 mL甲酰胺中混匀作为第3管, 以此类推共做6管, 其浓度分别为5 mg/L, 0.25 mg/L, 0.125 mg/L, 0.0 625 mg/L, 0.0 313 mg/L, 0.0 156 mg/L, 37 ℃水浴48 h, 于紫外分光光度仪上(波长632 nm)进行比色, 蒸馏水作空白对照, 制作出标准曲线.动物注射EB 2 h后, 迅速断头. 为清除血液中染料, 向左心室灌注生理盐水, 直至右心室流出透明液体为止. 取脑称重, 加入3 mL甲酰胺, 37 ℃水浴48 h, 1 500 r/min离心, 取上清于波长632 nm进行比色, 根据标准曲线计算出EB含量, 结果以ng/g表示. 每组各时间点另5只小鼠, 摘眼球取血, 分离血清, 立即行血清谷丙转氨酶(ALT)测定. 将处死的小鼠肝脏迅速置于40 g/L甲醛中固定, 石蜡包埋, HE染色, 观察肝脏病理形态变化.
统计学处理 ALT, EB含量均以mean±SD表示, 使用SPSS10.0进行方差分析比较.
第4组小鼠联合注射后, 逐渐出现懒动, 摄水和觅食动作减少, 皮毛松散, 最后行动减慢, 甚至抽搐, 并于注射后6 h开始死亡(18/120), 到9 h达高峰(72/120), 12 h以后存活下来的小鼠没有再死亡者, 总死亡率可达66.6%(80/120). 而其他3组无动物死亡.因此各实验指标的测定均截止至12 h为止.
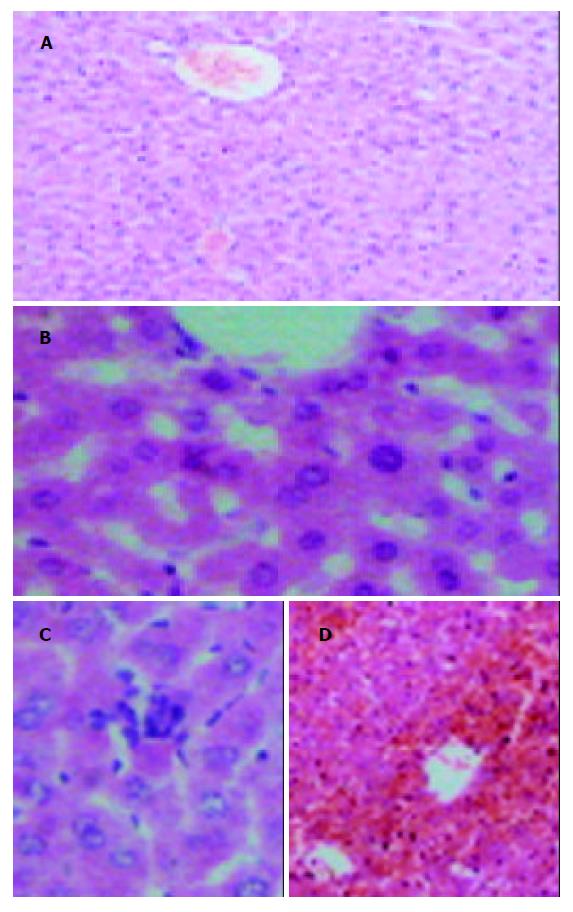
第1组小鼠肝组织呈现清楚的肝小叶结构, 肝小叶以中央静脉为轴, 肝索呈放射状排列, 肝细胞完整, 肝血窦清晰(图1A). 第2组肝脏仅有轻度肝细胞水肿, 或脂肪变性, 无明显肝细胞坏死(图1B). 第3组于9 h可见有单个肝细胞坏死(图1C). 第4组2 h时也无明显变化, 但随时间的延长, 逐渐出现点状坏死或灶状坏死, 6 h时有桥接坏死. 到9 h时病变最重, 表现为肉眼可见肝脏体积明显增大, 呈酱紫颜色, HE染色呈肝细胞大块或亚大块坏死, 肝小叶结构紊乱, 肝索消失, 肝血窦或间质内出血较重(图1D).
第2组小鼠ALT在各个时间点无明显变化, 第3组ALT仅于9 h有轻度升高(1.84±0.04 mkat/L). 第4组小鼠ALT于6 h开始明显升高(41.89±14.57 mkat/L), 9 h达(103.94±15.21 mkat/L), 于12 h达高峰(170.30±16.13 mkat/L). 各时间点较其他各组均有显著性差异(P<0.01, 图2).
第4组小鼠于注射2 h后, EB含量开始明显增高, 各时间点较其他对照组均有显著性差异, 组内各时间点之间无显著性差异(P>0.05, 表1).
脑水肿是ALF的严重并发症和致死原因之一[1-3], 许多研究证实细胞毒性和血管源性脑水肿机制都参与了ALF时脑水肿的形成[4-5]. BBB是中枢神经系统中重要的解剖结构, 他可限制血液循环中某些物质进入, 从而维持中枢神经系统内环境的稳定[6-7]. 我们应用LPS和GalN联合注射建立急性肝坏死动物模型[8-10], 研究BBB异常改变. 通过生化检测谷丙转氨酶(ALT), 发现6 h ALT出现明显升高, 于12 h可达170.30±16.13 mkat/L, 较对照组有显著性差异(P<0.01). 组织学检查: 6 h出现桥接样坏死, 9 h出现出血性大片肝坏死, 其病理改变类似重型肝炎. 而单独使用LPS或GalN仅引起ALT轻度升高, HE染色仅见轻度的肝细胞损伤. 这是由于肝细胞在遭受损伤因子的刺激时可产生保护性蛋白, GalN可特异性消耗尿嘧啶核苷, 影响肝细胞核酸代谢, 从而抑制保护性蛋白的合成, 增加肝细胞对LPS的敏感性, 二者联合应用造成了已致敏的肝细胞发生大片坏死. 我们利用伊文思蓝(EB)与血清白蛋白有高度亲和力, 只有BBB破坏后, 才能通过受损的BBB进入脑组织的特点, 测定急性肝坏死的小鼠脑组织中EB的含量, 以反映BBB开放的程度[11-12]. 结果在急性肝坏死组的小鼠脑组织EB含量从2 h开始明显升高, 较对照组有显著性差异, 表明在实验性急性肝坏死动物模型中确实存在BBB通透性增高. 但是, 在出现脑组织EB含量明显增加的2 h, 急性肝坏死组的小鼠肝脏内未发现大片肝细胞坏死, 说明在实验动物发生大片肝细胞坏死前已存在BBB通透性增高, 提示引起肝坏死发生的某些因子可能参与BBB通透性增高. BBB通透性的改变主要是通过内皮细胞的损伤, 紧密连接的开放, 小泡转运的增强, 星形胶质细胞的肿胀来实现的[13-18]. ALF时机体发生BBB损伤是由多种因素共同作用的结果.目前ALF时BBB改变的机制仍不清楚, 其中内毒素和细胞因子与BBB通透性的关系是现在的研究热点. 由于肝脏重度损伤, 造成 (1)肠道内毒素产生和吸收增多; (2)门体循环短路, 使血中内毒素逃避肝Kupffer细胞的吞噬与清除, 使内毒素血症加重; (3)肝细胞大量坏死, 肝Kupffer细胞也严重受损, 使其吞噬能力受抑制, 导致对内毒素的清除能力下降, 因此ALF时常伴有内毒素血症[19]. 内毒素诱发肝硬化大鼠发生肝性脑病时BBB超微结构有明显改变[20]. 我们LPS单独注射组动物未发现BBB通透性增高现象, 提示在我们建立的肝坏死动物模型中存在着LPS诱生的第二因子参与BBB通透性增高的形成. 有研究报告LPS可以刺激TNF-α生成[21-22], 而TNF-α可以使BBB通透性增加. 临床研究也证实重症肝炎患者血中TNF-α明显增高. 因此, TNF-α可能是急性肝坏死发生BBB通透性异常增高的重要因子.
ALF时机体各系统的变化是复杂的, 进一步引起BBB的破坏甚至是脑水肿的机制更是复杂的, 其中血氨水平的变化, 缺氧以及各种免疫递质的作用, 还有待今后更进一步深入研究.
| 1. | Mukherjee KK, Chhabra R, Khosla VK. Raised intracranial pressure in hepatic encephalopathy. Indian J Gastroenterol. 2003;22 Suppl 2:S62-S65. [PubMed] |
| 2. | Faybik P, Hetz H, Krenn CG, Baker A, Germann P, Berlakovich G, Steininger R, Steltzer H. Liver support in fulminant liver failure after hemorrhagic shock. Wien Klin Wochenschr. 2003;115:595-598. [PubMed] [DOI] |
| 3. | Gill RQ, Sterling RK. Acute liver failure. J Clin Gastroenterol. 2001;33:191-198. [PubMed] [DOI] |
| 4. | Inamasu J, Nakamura Y, Yamamoto S, Sakamoto N, Saito R, Horiguchi T, Ichikizaki K. Prolonged unilateral vasodilatation and brain edema in fulminant hepatic failure, associated with symptomatic seizure. Clin Neurol Neurosurg. 2002;104:157-160. [PubMed] [DOI] |
| 5. | Blei AT. Pathophysiology of brain edema in fulminant hepatic failure, revisited. Metab Brain Dis. 2001;16:85-94. [PubMed] [DOI] |
| 6. | Zheng W, Aschner M, Ghersi-Egea JF. Brain barrier systems: a new frontier in metal neurotoxicological research. Toxicol Appl Pharmacol. 2003;192:1-11. [PubMed] [DOI] |
| 7. | Chaudhuri JD. Blood brain barrier and infection. Med Sci Monit. 2000;6:1213-1222. [PubMed] |
| 8. | Nakama T, Hirono S, Moriuchi A, Hasuike S, Nagata K, Hori T, Ido A, Hayashi K, Tsubouchi H. Etoposide prevents apoptosis in mouse liver with D-galactosamine/lipopolysaccharide-induced fulminant hepatic failure resulting in reduction of lethality. Hepatology. 2001;33:1441-1450. [PubMed] [DOI] |
| 9. | Inoue T, Horiai H, Aoki C, Kawamura I, Ota M, Mizuhara H, Tomoi M, Mutoh S. Insulin-like growth factor-I prevents lethal acute liver failure induced by D-galactosamine and lipopolysaccharide in rats. In Vivo. 2003;17:293-299. [PubMed] |
| 10. | Santos FA, Silva RM, Tomé AR, Rao VS, Pompeu MM, Teixeira MJ, De Freitas LA, De Souza VL. 1,8-cineole protects against liver failure in an in-vivo murine model of endotoxemic shock. J Pharm Pharmacol. 2001;53:505-511. [PubMed] [DOI] |
| 11. | Ovadia H, Abramsky O, Feldman S, Weidenfeld J. Evaluation of the effect of stress on the blood--brain barrier: critical role of the brain perfusion time. Brain Res. 2001;905:21-25. [PubMed] [DOI] |
| 12. | Kaya M, Kalayci R, Küçük M, Arican N, Elmas I, Kudat H, Korkut F. Effect of losartan on the blood-brain barrier permeability in diabetic hypertensive rats. Life Sci. 2003;73:3235-3244. [PubMed] [DOI] |
| 13. | Fischer S, Wobben M, Marti HH, Renz D, Schaper W. Hypoxia-induced hyperpermeability in brain microvessel endothelial cells involves VEGF-mediated changes in the expression of zonula occludens-1. Microvasc Res. 2002;63:70-80. [PubMed] [DOI] |
| 14. | Krizbai IA, Deli MA. Signalling pathways regulating the tight junction permeability in the blood-brain barrier. Cell Mol Biol (Noisy-le-grand). 2003;49:23-31. [PubMed] |
| 15. | Abbott NJ. Astrocyte-endothelial interactions and blood-brain barrier permeability. J Anat. 2002;200:629-638. [PubMed] [DOI] |
| 16. | Fischer S, Wobben M, Kleinstück J, Renz D, Schaper W. Effect of astroglial cells on hypoxia-induced permeability in PBMEC cells. Am J Physiol Cell Physiol. 2000;279:C935-C944. [PubMed] |
| 17. | Li YQ, Chen P, Haimovitz-Friedman A, Reilly RM, Wong CS. Endothelial apoptosis initiates acute blood-brain barrier disruption after ionizing radiation. Cancer Res. 2003;63:5950-5956. [PubMed] |
| 18. | Stewart PA. Endothelial vesicles in the blood-brain barrier: are they related to permeability? Cell Mol Neurobiol. 2000;20:149-163. [PubMed] [DOI] |
| 19. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 21. | Yarovinsky TO, Powers LS, Butler NS, Bradford MA, Monick MM, Hunninghake GW. Adenoviral infection decreases mortality from lipopolysaccharide-induced liver failure via induction of TNF-αlpha tolerance. J Immunol. 2003;171:2453-2460. [PubMed] [DOI] |
| 22. | Domínguez Fernández E, Flohé S, Siemers F, Nau M, Schade FU. Endotoxin tolerance in rats: influence on LPS-induced changes in excretory liver function. Inflamm Res. 2002;51:500-505. [PubMed] [DOI] |