修回日期: 2003-07-09
接受日期: 2003-08-25
在线出版日期: 2004-06-15
目的: 幽门螺杆菌(H. pylori)可产生H. pylori源杀菌肽样抗菌肽, 这种多肽与昆虫杀菌肽cecropins的结构和功能类似. 我们研究H. pylori源杀菌肽样抗菌肽Hp (2-20)对消化道常见致病菌的杀伤作用, 探讨H. pylori感染者的生存竞争优势.
方法: 采用琼脂扩散法检测Hp (2-20)对消化道常见致病菌的抗菌活性及致死浓度, 平板菌落计数法检测Hp (2-20)的抑菌率. 采用染料排斥试验测定Hp (2-20)对胃黏膜上皮细胞生长的影响.
结果: Hp (2-20)对消化道常见致病菌福氏志贺菌、伤寒、副伤寒沙门菌和致病性大肠杆菌具有杀伤作用, 致死浓度为65-197mmoL/L, 并可在12 min内完全抑制细菌生长. 但小肠结肠炎耶氏杆菌及金黄色葡萄球菌对Hp (2-20)不敏感, 致死浓度>1 014mmoL/L. Hp (2-20)的杀菌作用明显低于Cecropin B, 对胃黏膜上皮细胞无裂解.
结论: H. pylori源杀菌肽样抗菌肽Hp (2-20)可抑制胃肠道内快速繁殖的致病菌的生长, 对胃黏膜上皮细胞无影响. 感染Hp 的宿主可能拥有生存竞争优势.
引文著录: 张卫民, 赖卓胜, 周殿元. 幽门螺杆菌感染者的生存竞争优势. 世界华人消化杂志 2004; 12(6): 1321-1324
Revised: July 9, 2003
Accepted: August 25, 2003
Published online: June 15, 2004
AIM: To study the in vitro killing effects of cecropin-like antibacterial peptide from H. pylori Hp (2-20) on the gastrointestinal bacterial pathogens and to explore the survival advantage to the host of infection with H. pylori.
METHODS: The inhibition zone assay was used to determine anti-bacterial activity and lethal concentrations of H. pylori antibacterial peptide Hp (2-20) on the gastrointestinal bacterial pathogens. The rate of killing of E.coli K12D31 (standard strain) by Hp (2-20) was estimated by counting viable bacteria based on counting of colonies grown in Luria-Bertani plate. The cytotoxicity of the Hp (2-20) peptides on human gastric epithelial cell line was measured by trypan blue exclusion test.
RESULTS: In vitro studies, the Hp (2-20) destroyed the gastrointestinal bacterial pathogens such as Shigella flexneri, Salmonella typhi, Salmonella paratyphi and enteropathogenic E.coli. The lethal concentrations (LC) were 65-197 mmoL/L. The viable bacterial count dropped to zero after 12 min incubation with Hp (2-20) concentration closed to the LC value. The Hp (2-20) was inactive against the strains of Yersinia enterocolitica and Staphylococcus aureus and had much higher LC (over 1014mmol/L). The killing effects of Cecropin B were more pronounced than Helicobacter peptide Hp (2-20). The synthetic peptideHp(2-20) showed no lytic or toxic activity against the human gastric epithelial cell line GES-1.
CONCLUSION: The cecropin-like antibacterial peptide from H. pylori Hp (2-20) is active against faster-growing gastrointestinal bacterial pathogens. There is no effect on the human gastric epithelial cells. H. pylori may actually have beneficial effects on infected carriers who are heavily exposed to other gastrointestinal pathogens.
- Citation: Zhang WM, Lai ZS, Zhou DY. Survival advantage in hosts with H. pylori infection. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1321-1324
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1321.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1321
幽门螺杆菌(Helicobacter pylori, H. pylori)感染在世界范围普遍存在, 估计约有半数以上的人口胃内有H. pylori定居. H. pylori感染是慢性胃炎和消化性溃疡的重要病因, 与胃癌和胃黏膜相关淋巴组织淋巴瘤的发生也密切相关[1-4]. 但仍有感染的正常人存在, H. pylori的致病机制也不清楚. 1999年, Putsep et al发现[1] : H. pylori可产生杀菌肽样抗菌多肽(cecropin-like antibacterial peptide). 这种来源于H. pylori核糖体蛋白L1 (ribosomal protein L1, rpL1)的N-端肽, 在结构与功能的许多方面与杀菌肽(cecropins)相似. 如H. pylori源抗菌肽具有较强的抗菌作用, 但抗菌活性明显低于cecropin A及猪小肠抗菌肽cecropin P1. H. pylori源抗菌肽Hp (2-20)对包括白色念珠菌(Candida albicans)在内的多种真菌具有强烈的杀伤作用. H. pylori源抗菌肽的作用机制与杀菌肽相似, 可能是通过破坏细胞的膜性结构发挥作用. H. pylori源杀菌肽样抗菌肽与杀菌肽类似, 不裂解真核细胞. 此外, H. pylori自身可耐受H. pylori源抗菌肽及天然抗菌肽cecropins而不被杀灭. 我们研究H. pylori源杀菌肽样抗菌肽Hp (2-20)对消化道常见致病菌的杀伤作用, 探讨H. pylori产生抗菌肽的临床及流行病学意义及H. pylori感染者的生存竞争优势.
H. pylori源杀菌肽样抗菌肽Hp (2-20)为来源于H. pylori RpL1N-端第2-20位多肽, 由美联(西安)生物科技有限公司合成并提供质谱图, 纯度为95%. RpL1及Hp (2-20)的一级结构参考(FEBS Lett 1999; 451:249-52)及GenBank, Swiss-Prot. 胃黏膜上皮细胞株GES-1 由北京市肿瘤防治研究所细胞遗传室提供. 实验所用致病菌标准株来自第一军医大学热卫系. 抗菌肽活性测定标准菌E.coli K12D31由华南农业大学蚕桑系黄自然教授惠赠. 杀菌肽B(cecropin B)、胰化蛋白胨、酵母提取物购自Sigma公司. 其他试剂为国产分析纯试剂. 胎牛血清购自杭州四季清生物工程材料有限公司(批号: 20011212). Petri平皿为康宁(Coning)公司产品.
实验菌株均培养于LB(Luria-Bertani)液体或琼脂培养基. 细菌计数采用平板菌落计数法. 小肠结肠炎耶氏杆菌于28 ℃, 其余菌株于37 ℃振摇3-5 h至对数生长期, 使活菌数达1011/L. 抗菌肽活性及致死浓度测定采用琼脂扩散法(EMBO J 1983; 2:571-576. Eur J Biochem 1982; 127:207-217). 抗菌肽活性测定标准菌E.coli K12D31培养于LB(Luria-Bertani)液体培养基, 于37 ℃振摇3-5 h至对数生长期, 使活菌数达1011/L备用. 在直径8.65 cm (内径) Petri平皿中, 将标准菌株E.coli K12D31均匀混入10 mL 45-50 ℃ LB琼脂培养基, 使活菌数最终达109/L, 凝固后打出2.7 mm直径孔穴. 将待测抗菌肽倍比稀释成不同剂量后(n), 按6 mL/孔加入孔穴, 培养12 h后测定抑菌圈直径. 阳性对照采用杀菌肽B (cecropin B). 根据文献(EMBO J 1983;2:571-576)抑菌圈直径的平方(d2, 单位为cm)与孔穴中的样品量的对数(log n, n的单位为nmoL)呈线性关系. 采用SPSS 10.0统计软件, 根据d2与log n的线性关系, 取得线性回归方程及斜率(K)和截率(L). 根据文献(Eur J Biochem 1982;127:207-17)将a(琼脂培养基的厚度, 单位为cm)、截率L和斜率K代入下列方程: CL = 2.93/(ak 10L/K), CL为致死浓度(lethal concentration, 单位为mmol/L).
抗菌肽活性测定标准菌E.coli K12D31于LB液体培养基中培养至对数生长期. 调整细菌数至约108/L, 加入Hp (2-20)使终浓度为60 mmoL/L, 间隔2 min吸取菌液20 mL, 混入约10 mL 45-50 ℃ LB琼脂培养基. 阳性对照中加入cecropin B终浓度为0.35mmoL/L, 阴性对照中未加入任何多肽. 存活细菌数采用平板菌落计数法计数. 胃黏膜上皮细胞株GES-1细胞 37 ℃ 50 mL/L CO2饱和湿度培养于 RPMI 1640培养基(内含灭活胎牛血清及抗菌素), 取对数生长期细胞备用. 按每孔0.9 mL含细胞数1.5×105, 将GES-1细胞接种于 96孔细胞培养板, 每孔加 0.1 mL含Hp (2-20)及杀菌肽cecropin B的培养液, 使终浓度分别为 200 mL和20mmoL/L. 对照组(Control), 加0.1 mL RPMI 1640培养基. 培养2及24 h后, 4 g/L麝酚蓝染色、计数活细胞(染料排斥试验).
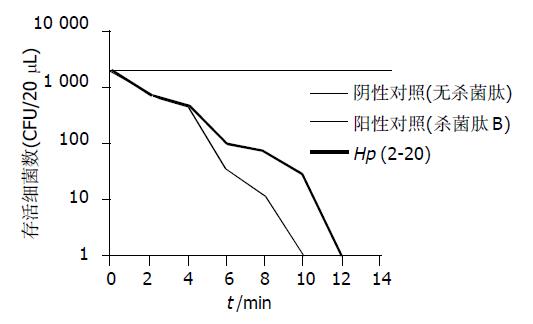
以cecropin B对大肠杆菌E.coli K12D31的作用为例, 介绍致死浓度(LC)的计算过程. cecropin B的Mr为3 835.7. 经回归分析(regression)得直线方程如下: Y = 1.447+0.88X. 其中Y: d2, X: Log n, 斜率k = 0.88, 截率l = 1.447, a = 0.17 cm, 代入方程CL=2.93/(a k 10L/K)得: cecropin B对大肠杆菌E.coli K12D31的LC为0.437mmoL/L. 同理推算对其他致病菌的LC(表1). H. pylori源杀菌肽样抗菌肽Hp (2-20)的杀菌作用明显低于杀菌肽B. 但Hp (2-20)对消化道常见致病菌如福氏志贺菌(即痢疾杆菌)、伤寒、副伤寒沙门菌和致病性大肠杆菌均有杀伤作用, LC为65-197 mmoL/L. 而小肠结肠炎耶氏杆菌及金黄色葡萄球菌对Hp (2-20)不敏感, LC>1 014 mmoL/L, Hp(2-20)浓度增加仍未见杀伤作用. 在大肠杆菌E.coliK12D31(标准菌)培养物中, 加入Hp (2-20)及杀菌肽B使终浓度接近致死浓度(分别为60和0.35 mmoL/L), 分别在10 min和8 min内大肠杆菌E.coli K12D31的活菌数降至0 (图1).
| 实验菌株 | Hp (2-20) | Cecropin B |
| E.coli K12D31 | 65 | 0.4 |
| 肠致病性E.coli | 137 | 0.2 |
| 福氏志贺菌 | 122 | 0.2 |
| 伤寒沙门菌"O" | 128 | 0.3 |
| 伤寒沙门菌"H" | 99 | 0.8 |
| 甲型副伤寒沙门菌 | 197 | 0.4 |
| 乙型副伤寒沙门菌 | 184 | 2.1 |
| 小肠结肠炎耶氏杆菌 | >1 014 | > 9.6 |
| 金黄色葡萄球菌 | >1 014 | > 9.6 |
| 金黄色葡萄球菌 | >1 014 | > 9.6 |
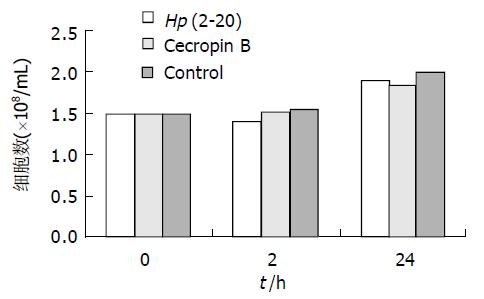
Hp (2-20)终浓度为 200 mmoL/L、cecropin B的终浓度20 mmol/L. 细胞培养24 h, Hp (2-20)和cecropin B组细胞的生长与未加任何多肽的对照组生长基本一致, 无细胞生长抑制(图2).
幽门螺杆菌(H. pylori)感染在世界范围普遍存在, 估计约有半数以上的人口胃内有H. pylori定居[5-6]. H. pylori感染是慢性胃炎和消化性溃疡的重要病因, 与胃癌和胃黏膜相关性淋巴组织淋巴瘤的发生也密切相关[7]. 但H. pylori感染的临床和流行病学意义复杂, 其结局取决于H. pylori菌株的变异、环境共同致病因素和感染者的个体差异[8-11]. 作为一种共生菌, H. pylori与其人类宿主可能是互惠的, 或者至少人类可耐受H. pylori的定殖[12]. 研究表明, 无H. pylori感染的个体患胃食管反流疾病、Barrett食管和食管腺癌的危险性较大; H. pylori感染对婴儿腹泻也有保护作用; 但对大多数个体, H. pylori感染对发病率和死亡率无影响[13-14]. H. pylori产生抗菌肽(antibacterial peptides)是对H. pylori感染者有益的证据之一. 抗菌肽是天然免疫的主要效应分子[15-16], 是有生物活性的小分子活性多肽, 具有强碱性、热稳定性以及广谱抗微生物作用等特点. 分子质量2-7 ku, 具有抗细菌、病毒、真菌等几乎所有种类微生物的作用, 还具有抗寄生虫、杀伤肿瘤细胞等功能, 又称为"antimicrobial peptides"、"peptide antibiotics". 但抗菌肽已在国内被广泛采用, 并且习惯上不包括那些在代谢过程中通过酶促反应合成的多肽性质的抗生素, 如杆菌肽、多粘菌素E、短杆菌肽S等, 而特指由基因编码在核糖体上合成的具有生物活性的多肽.
基因编码的抗菌肽不仅在动物、植物中存在, 同样在细菌中也被发现. H. pylori 可产生杀菌肽样抗菌多肽(cecropin-like antibacterial peptide). 这种基因编码的来源于H. pylori核糖体蛋白L1(ribosomal protein L1, rpL1)的N-端肽, 在结构与功能的许多方面与杀菌肽(Cecropins)相似. 天然杀菌肽可杀灭大多数致病菌, 同时对正常细胞无裂解. H. pylori抗菌肽与其相似. cecropin B对肿瘤细胞的IC50(半效抑制浓度)多在8-18 mmoL/L间[9], 本研究显示Hp(2-20)浓度为200 mmoL/L仍未见胃黏膜上皮细胞GES-1细胞裂解, 肠道内G-杆菌致病菌如痢疾杆菌、伤寒杆菌较G+菌如葡萄球菌、小肠结肠炎耶氏杆菌对H. pylori抗菌肽敏感. 而文献报道H. pylori抗菌肽对H. pylori本身也无裂解[1]. 可能的原因是, cecropins 是通过与细菌细胞壁LPS(脂多糖)的二磷酰基脂质A结合发挥杀伤作用, 而H. pylori及G+菌的细胞壁脂质A磷酸盐含量低, 因此可抵抗杀菌肽的作用[1]. H. pylori抗菌肽对痢疾杆菌、伤寒杆菌等胃肠道常见致病菌较葡萄球菌这类非常见的胃肠道致病菌敏感, 对H. pylori同时对H. pylori宿主本身均有意义. 大多数细菌约20 min即可繁殖一代, 而H. pylori源抗菌肽可在细菌的倍增时间内杀灭该菌. 表明H. pylori释放的杀菌肽样抗菌肽可抑制胃肠道内快速繁殖的有害微生物. 已有研究证实, H. pylori在体内存在"自我裂解(autolysis)"现象[17]. H. pylori采取"利他性裂解", 即一些胃腔内的H. pylori的裂解释放抗菌肽, 有利于胃腔内其他H. pylori的生存. 同时对胃肠道内其他病原菌的严重感染发挥有益作用. 因此, 感染H. pylori的宿主可能拥有生存竞争优势. 目前, 已有在进行H. pylori根除治疗时发生难辩梭菌感染导致伪膜肠炎的报道. H. pylori的抗生素根除疗法导致的一些病变可能直接或间接与胃肠道内的正常微生物区系(包括H. pylori)被改变有关[18]. 但H. pylori感染可降低胃的泌酸能力, 这将削弱抵御其他病原菌感染的天然屏障而增加感染的机会. 深入研究H. pylori与宿主及其与其他致病菌的相互关系[19], 有助于解释这些相互矛盾的结果.
| 4. | Xue FB, Xu YY, Wan Y, Pan BR, Ren J, Fan DM. Association of H. pylori infection with gastric carcinoma: a Meta analysis. World J Gastroenterol. 2001;7:801-804. [PubMed] [DOI] |
| 7. | Wang RT, Wang T, Chen K, Wang JY, Zhang JP, Lin SR, Zhu YM, Zhang WM, Cao YX, Zhu CW. Helicobacter pylori infection and gastric cancer: evidence from a retrospective cohort study and nested case-control study in China. World J Gastroenterol. 2002;8:1103-1107. [PubMed] [DOI] |
| 8. | Pena A. Genetic factors determining the host response to Helicobacter pylori. World J Gastroenterol. 2000;6:624-625. [PubMed] [DOI] |
| 9. | Wang KX, Li CP, Cui YB, Tian Y, Yang QG. L-forms of H. pylori. World J Gastroenterol. 2003;9:525-528. [PubMed] [DOI] |
| 10. | Serin E, Yilmaz U, Künefeci G, Ozer B, Gümürdülü Y, Güçlü M, Kayaselçuk F, Boyacioğlu S. Serum positive cagA in patients with non-ulcer dyspepsia and peptic ulcer disease from two centers in different regions of Turkey. World J Gastroenterol. 2003;9:833-835. [PubMed] [DOI] |
| 11. | Guo XL, Wang LE, Du SY, Fan CL, Li L, Wang P, Yuan Y. Association of cyclooxygenase-2 expression with Hp-cagA infection in gastric cancer. World J Gastroenterol. 2003;9:246-249. [PubMed] [DOI] |
| 12. | Hou P, Tu ZX, Xu GM, Gong YF, Ji XH, Li ZS. Helicobacter pylori vacA genotypes and cagA status and their relationship to associated diseases. World J Gastroenterol. 2000;6:605-607. [PubMed] |
| 13. | Blaser MJ, Berg DE. Helicobacter pylori genetic diversity and risk of human disease. J Clin Invest. 2001;107:767-773. [PubMed] [DOI] |
| 14. | Rothenbacher D, Blaser MJ, Bode G, Brenner H. Inverse relationship between gastric colonization of Helicobacter pylori and diarrheal illnesses in children: results of a population-based cross-sectional study. J Infect Dis. 2000;182:1446-1449. [PubMed] [DOI] |
| 15. | Boman HG. Innate immunity and the normal microflora. Immunol Rev. 2000;173:5-16. [PubMed] [DOI] |
| 16. | Hancock RE. Cationic peptides: effectors in innate immunity and novel antimicrobials. Lancet Infect Dis. 2001;1:156-164. [PubMed] [DOI] |
| 17. | Couper RT, Huynh H, Butler RN. Gene encoded antibacterial activity in Helicobacter pylori. J Pediatr Gastroenterol Nutr. 2000;31:327-328. [PubMed] |
| 18. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [PubMed] [DOI] |