修回日期: 2004-01-09
接受日期: 2004-02-01
在线出版日期: 2004-05-15
目的: 建立一种可同时测定胃黏膜组织微量g-氨基丁酸(GABA)和谷氨酸(Glu)含量的高效液相色谱法.
方法: 用异硫氰酸苯酯(PITC)作衍生剂, 色谱柱为Pico/Tagâ氨基酸专用柱, 梯度洗脱, 紫外检测波长 254 nm..
结果: GABA在0.125-6.25 nmoL/mL 范围, Glu在 0.025-2.5 mmol/mL范围, 线性关系良好; GABA和Glu加样回收率分别为90.4-104%, 88.1-105.5%; 批内误差分别为3.56%, 和1.12%; 批间误差分别7.47%和5.98%.
结论: 本法稳定、灵敏, 可用于胃黏膜组织GABA和Glu含量的检测.
引文著录: 朱人敏, 秦苏堤, 何小平, 汪芳裕, 李宁, 刘福坤. 高效液相色谱法测定人胃黏膜中g-氨基丁酸和谷氨酸含量. 世界华人消化杂志 2004; 12(5): 1210-1213
Revised: January 9, 2004
Accepted: February 1, 2004
Published online: May 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1210-1213
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1210.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1210
g-氨基丁酸(g-aminobutyric acid, GABA)主要来源于三羧酸循环中的谷氨酸(Glu), 是一种重要的抑制性神经递质, 广泛存在于脊椎动物脑内, 外周组织中含量很低[1-3]. 近年来研究表明: GABA除了作为胃肠神经递质, 还有可能作为一种胃肠激素[4], 协同Glu, 参与胃肠黏膜细胞分裂、分化、成熟的调节[5], 抑制胃癌的发生[4]. 随着GABA、Glu与胃癌关系研究的不断深入, 要求建立一种快速、精确定量胃黏膜组织GABA、Glu含量的方法.
国外已有文献报道, 应用荧光分光光度法测定人胃黏膜组织GABA含量, 但灵敏度较低, 干扰因素较多[5]. 本文首次采用异硫氰酸苯酯(PITC) 柱前衍生, 高效液相色谱(HPLC)-紫外检测法测定胃黏膜组织GABA 、Glu 含量. 国内外未见此类报道. 该法的优点是PITC与氨基酸反应生成能在254 nm下检测的PITC-氨基酸[6-11], 分析速度快, 灵敏度高, 结果令人满意.
Waters高效液相色谱仪系统(美国Waters公司), 其中包括510泵两台, 486紫外检测器, 自动梯度控制器, 控温仪及柱温箱; Pico/TagTM工作台; 7 725 i进样阀(美国Rheodyne 公司); 色谱工作站(杭州英谱公司).g-氨基丁酸和谷氨酸: 美国Sigma公司; 衍生剂异硫氰酸苯酯(PITC): 美国Pierce公司; 乙腈、甲醇均为色谱纯: 德国Merck公司; 乙酸钠为分析纯: 英国普尔BDH化学公司; 其余试剂均为市售分析纯试剂, 水为重蒸馏水.
1.2.1 色谱条件: 色谱条件 色谱柱: Pico/Tagâ氨基酸专用柱3.9 mm ×300 mm; 流动相: 流动相A为乙腈:70 mmoL/L-1醋酸缓冲液(pH 6.5) = 25:975, 含0.25 mL/L-1的10 mmoL/L-1 EDTA; 流动相B为乙腈:水:甲醇 = 450:400:150.梯度洗脱条件如表1. 紫外检测波长254 nm; 柱温 45 ℃; 进样量 20 mL.
| 时间(min) | 流动相(mL/min-1) | A% | B% | 曲线 |
| 起始 | 1.00 | 100 | 0 | - |
| 13.50 | 1.00 | 97 | 3 | 11 |
| 20.00 | 1.00 | 96 | 4 | 8 |
| 20.50 | 1.00 | 20 | 80 | 5 |
| 22.50 | 1.00 | 0 | 100 | 6 |
| 23.00 | 1.00 | 100 | 0 | 6 |
| 30.00 | 1.00 | 100 | 0 | 6 |
1.2.2 溶液配制: 样品稀释液: 5 mmoL/L-1的Na2HPO4缓冲溶液, pH 7.4. 样品干燥液: 甲醇:1.0 moL/L-1醋酸钠:三乙胺 = 2/2/1(v/v/v). 衍生化试剂: 异硫氰酸苯酯(PITC):甲醇:乙醇:三乙胺:水 = 1/6/1/1/1 (v/v/v/v/v); 需新鲜配制.
1.2.3 标本收集及样品前处理: 于手术当天取胃癌组织标本(约100 mg), 同时取距癌组织边缘5 cm以上的胃黏膜组织作为对照, 并经病理证实为癌组织和正常组织, 迅速放入液氮中冷冻, 再转移至-70 ℃冰箱保存至测定. 测定时, 称取100 mg 左右的胃黏膜组织置小研钵中, 倒入液氮, 待组织冷却坚硬后进行研磨, 粉碎后再加入液氮研磨, 如此反复3次, 使组织完全粉碎.加入400 mL的样品稀释液将粉碎的组织完全转移到离心管中, 1 000 r/min, 4 ℃离心5 min, 上清液转移到超滤管中, 1 000 r/min, 4 ℃离心30 min.
1.2.4样品衍生化: 取超滤液20 mL注入0.5 cm×5 cm的玻璃试管中, 冷冻干燥, 然后加入干燥液 10 mL, 再一次冻干, 再加入20mL衍生化试剂, 室温衍生20 min后经冻干置冰箱4 ℃保存. 50 mL样品稀释液复溶, 10 mL或20 mL进样.
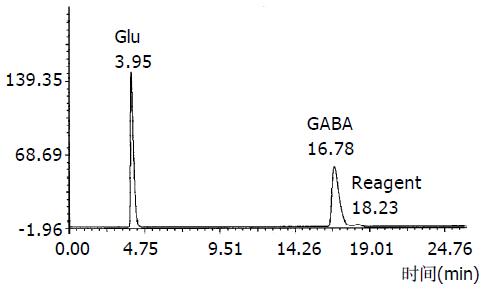
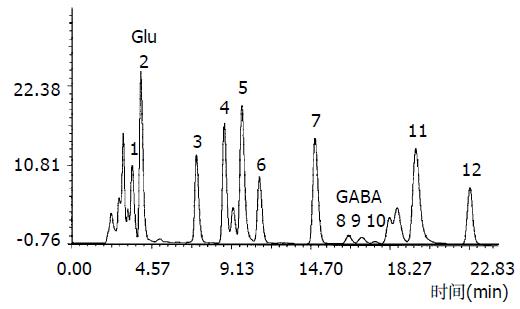
图1为Glu与GABA标准色谱图, 各自的保留时间分别为Glu = 3.98 min, GABA = 16.7 min. 图2为样品色谱图, 从色谱图可知, 该方法能很好的分离Glu与GABA.
分别精密配制Glu和GABA标准溶液, 使其含量为Glu: 0.025, 0.05, 0.1, 0.25, 0.5, 1, 2.5 mmoL/mL-1; GABA: 0.125, 0.25, 0.625, 1.25, 2.5, 6.25 nmol/mL-1. 按照样品衍生步骤衍生并HPLC测定, 以峰面积对质量浓度作线性回归, 其线性方程为: Glu Y = 1.58106 C+18027, 相关系数0.9 998; 最小检测浓度2.5 nmoL/mL-1. GABA Y = 3 723.3C-547.8, 相关系数0.9 988; 最小检测浓度0.01 nmol/mL-1.
在混合样品超滤液中加入Glu和GABA标准溶液, 用加样回收方法考察方法的准确度. g-氨基丁酸和谷氨酸加样回收率分别为95.4%, 93.5%(表2).
| 样品测定值 | 加入量 | 测定值 | 回收率(%) | |
| GABA | 0.318±0.013 | 0.5 | 0.852±0.014 | 106.8±3.0 |
| (nmol/mL-1) | 0.75 | 1.057±0.082 | 95.3±5.3 | |
| Glu | 0.310±0.005 | 0.5 | 0.837±0.049 | 105.5±13.1 |
| (mmol/mL-1) | 1 | 1.234±0.036 | 92.5±4.4 |
同时取某一样品超滤液三份, 按衍生化法处理测定, GABA和Glu的批内误差分别为3.56%, 1.12%.不同日取样三次, 如上处理求得GABA和Glu的批间误差分别7.47%, 5.98%.
GABA、Glu在胃黏膜组织含量极低, 不具有紫外吸收, 也不发射荧光, 因此需将他们转变为能被检测的高灵敏度衍生化产物[6-11]. 本文用PITC作衍生剂与胃黏膜组织中的氨基酸反应, 衍生物经HPLC分离后紫外检测, 建立了一种更简便、更灵敏的方法, 适于检测胃黏膜组织的微量GABA、Glu.
本法的优点: (1)组织样品处理时, 采用液氮冷冻碾磨法碾碎胃黏膜组织, 该法比电动匀浆或超声匀浆法使组织粉碎更加完全, 而且简单易行; 易于推广. (2)组织衍生前, 采用超滤法去除蛋白, 不但去除完全, 回收率高, 样品也没有被稀释, 对于含量极低的氨基酸分析是一个非常有效的手段, 但美中不足的是成本较高, 需要超速冷冻离心机. (3)组织衍生时, 采用PITC作为氨基酸衍生剂, 具有稳定, 不会产生水解反应, 也不会形成多级衍生物的优点[6-11], 但有时过量试剂会产生干扰.本法除了采用在衍生化后真空干燥除去过量试剂外, 还通过调节流动相梯度, 使试剂峰与样品峰分离完全.(4)色谱分析时, 采用Pico/Tagâ氨基酸专用柱, 他是Waters 公司的专利产品, 可非常好的分离PTC-氨基酸, 可同时分析18种常用氨基酸, 但有报道柱寿命短, 最多能分析150个PITC样品. 在我们实际工作中采用前处理干燥完全, 乙腈冲洗再生方法, 实际分析样品可达到约500个. (5)实际操作时, 采用40.0±0.5 ℃柱温, 提高柱温能缩短保留时间, 降低柱压, 但过高的柱温会减少分离度, 使g-氨基丁酸与在其后出现的瓜氨酸以及衍生剂峰重合, 因此使柱温保持在40.0±0.5 ℃为最佳.
生物样品中微量氨基酸的测定在医学领域中占重要地位, 经典的氨基酸分离方法是离子交换色谱法, 此法需特殊装置, 且分析时间较长, 而荧光分光光度法和氨基酸自动分析仪检测, 灵敏度较低, 干扰因素较多 .测定GABA和Glu的高效液相色谱方法, 多为用邻苯二甲醛在催化剂作用下与氨基酸发生衍生化反应, 衍生物经HPLC分离, 电化学检测或荧光检测器检测, 并且分析对象为含量较高的脑组织和血清[12-15]. 本文采用PITC为柱前衍生剂, 配合紫外检测仪, 建立了一种高效、稳定、简便、快捷的HPLC梯度洗脱方法.该法条件简便、灵敏度高, 分离周期短, 适于检测胃黏膜组织中微量的GABA、Glu, 应用前景广泛.
| 1. | Hinoi E, Takarada T, Ueshima T, Tsuchihashi Y, Yoneda Y. Glutamate signaling in peripheral tissues. Eur J Biochem. 2004;271:1-13. [PubMed] [DOI] |
| 2. | Watanabe M, Maemura K, Kanbara K, Tamayama T, Hayasaki H. GABA and GABA receptors in the central nervous system and other organs. Int Rev Cytol. 2002;213:1-47. [PubMed] [DOI] |
| 3. | Kuroda E, Watanabe M, Tamayama T, Shimada M. Autoradiographic distribution of radioactivity from (14)C-GABA in the mouse. Microsc Res Tech. 2000;48:116-126. [PubMed] [DOI] |
| 4. | Tatsuta M, Iishi H, Baba M, Nakaizumi A, Ichii M, Taniguchi H. Inhibition by gamma-amino-n-butyric acid and baclofen of gastric carcinogenesis induced by N-methyl-N'-nitro-N-nitrosoguanidine in Wistar rats. Cancer Res. 1990;50:4931-4934. [PubMed] |
| 5. | Matuszek M, Jesipowicz M, Kleinrok Z. GABA content and GAD activity in gastric cancer. Med Sci Monit. 2001;7:377-381. [PubMed] |
| 6. | Rubio LA. Determination of diaminopimelic acid in rat feces by high-performance liquid chromatography using the Pico Tag method. J Chromatogr B Analyt Technol Biomed Life Sci. 2003;784:125-129. [PubMed] [DOI] |
| 7. | Komarova NV, Kamentsev JS, Solomonova AP, Anufrieva RM. Determination of amino acids in fodders and raw materials using capillary zone electrophoresis. J Chromatogr B Analyt Technol Biomed Life Sci. 2004;800:135-143. [PubMed] [DOI] |
| 8. | Dale Y, Mackey V, Mushi R, Nyanda A, Maleque M, Ike J. Simultaneous measurement of phenylalanine and tyrosine in phenylketonuric plasma and dried blood by high-performance liquid chromatography. J Chromatogr B Analyt Technol Biomed Life Sci. 2003;788:1-8. [PubMed] [DOI] |
| 9. | Yang J, Sun LG, Bai XZ, Zhou HT. [Simultaneous determination of 18 amino acids by reversed-phase high performance liquid chromatography with precolumn phenylisothiocyanate derivatization]. Se Pu. 2002;20:369-371. [PubMed] |
| 10. | Woo KL, Hwang QC, Kim HS. Determination of amino acids in the foods by reversed-phase high-performance liquid chromatography with a new precolumn derivative, butylthiocarbamyl amino acid, compared to the conventional phenylthiocarbamyl derivatives and ion-exchange chromatography. J Chromatogr A. 1996;740:31-40. [PubMed] [DOI] |
| 11. | Brennan JM, O'Dwyer PJ, Ozols RF, LaCreta FP. High-performance liquid chromatographic determination of the S- and R-diastereoisomers of L-buthionine (SR)-sulfoximine in human plasma and urine. J Chromatogr. 1993;620:121-128. [PubMed] [DOI] |
| 12. | Rowley HL, Martin KF, Marsden CA. Determination of in vivo amino acid neurotransmitters by high-performance liquid chromatography with o-phthalaldehyde-sulphite derivatisation. J Neurosci Methods. 1995;57:93-99. [PubMed] [DOI] |
| 13. | Smith S, Sharp T. Measurement of GABA in rat brain microdialysates using o-phthaldialdehyde-sulphite derivatization and high-performance liquid chromatography with electrochemical detection. J Chromatogr. 1994;652:228-233. [PubMed] [DOI] |
| 14. | Naini AB, Vontzalidou E, Côté LJ. Isocratic HPLC assay with electrochemical detection of free gamma-aminobutyric acid in cerebrospinal fluid. Clin Chem. 1993;39:247-250. [PubMed] |
| 15. | Bourdelais A, Kalivas PW. High sensitivity HPLC assay for GABA in brain dialysis studies. J Neurosci Methods. 1991;39:115-121. [PubMed] [DOI] |