修回日期: 2004-01-09
接受日期: 2004-02-01
在线出版日期: 2004-05-15
目的: 评估终末期肝病模型(model for end stage liver disease, MELD)对肝硬化患者短期和中期生存预测的价值.
方法: 对199例肝硬化患者的生存率进行回顾性评估, 随访1年. 计算每例患者入院当天的MELD评分与Child-Pugh评分, 以受试者特征曲线(ROC)下的面积衡量各评分系统预测患者预后的能力, 依据ROC曲线截断值绘制Kaplan-Meier生存曲线, 分析MELD评分与Child-Pugh评分的相关性.
结果: 随访3 mo内有37例患者死亡, 死亡组MELD 与Child-Pugh 评分(23.4±9.90, 10.8±2.29)与生存组 (14.3±4.66, 8.68±2.21)比较有显著差异(P<0.001); 随访第1a内有59例患者死亡, 死亡组MELD与Child-Pugh 评分(20.3±9.31, 10.3±2.32)与生存组(14.0±5.11, 8.43±2.23)比较有显著差异(P<0.001); MELD评分与Child-Pugh评分对3 mo预后评估的ROC曲线面积分别为0.826, 0.745(P<0.05), 对1年预后评估的ROC曲线下的面积分别为0.758, 0.724(P>0.05); 生存分析表明两评分系统在截断值均可有效地分辨3mo或1a内可能生存及死亡的患者(P<0.001); MELD评分与Child-Pugh 评分呈显著相关(r = 0.69, P<0.001).
结论: MELD评分及Child-Pugh评分均可有效地预测肝硬化患者的短期和中期预后, MELD评分短期评估效率优于Child-Pugh分级, 能更准确反应病情危急程度, 值得临床应用.
引文著录: 熊伍军, 刘菲, 赵中辛, 邱德凯. 终末期肝病模型在评估肝硬化患者预后中的价值. 世界华人消化杂志 2004; 12(5): 1159-1162
Revised: January 9, 2004
Accepted: February 1, 2004
Published online: May 15, 2004
AIM: To evaluate the short- and medium-term prognosis of liver cirrhotic patients by using the model for end-stage liver disease (MELD).
METHODS: The data of 199 cirrhotic patients were analyzed with a cohort method retrospectively and the follow-up period was at least one year. Both MELD score and Child-Pugh score were computed for each patient according to the original formula on admission day. Area under of receiver operating characteristic curve (ROC) was used to compare the value of MELD score with Child-Pugh's for predicting the prognosis. Kaplan-Meier survival curves were made using the cut-offs identified by means of ROC. MELD values were correlated with Child-Pugh scores.
RESULTS: Thirty-seven patients died in three months, MELD scores and Child-Pugh scores for non-survivors (23.4± 9.90, 10.8±2.29) were higher than those for survivors (14.3± 4.66, 8.68±2.21) significantly (P < 0.001). Fifty-nine patients died within the first year, MELD scores and Child-Pugh scores for non-survivors (20.3±9.31, 10.3±2.32) were higher than those for survivors (14.0±5.11, 8.43±2.23) significantly (P < 0.001). Area under the ROC of MELD for 3 months (0.826) was significantly (P < 0.05) different from that of Child-Pugh (0.745), but there was no difference in area under the ROC for 1 year (P > 0.05) between MELD value (0.758) and Child-Pugh score (0.724). Survival curves showed both MELD and Child-Pugh scores was clearly discriminated between patients who survived and those who died in short term as well as in the medium term (P < 0.001). MELD grading system showed significant correlation with Child-Pugh scores (r = 0.69, P < 0.001).
CONCLUSION: MELD grading is an objective predictive system for both short- and medium- term survival. It is more efficient than Child-Pugh score for short-term prognosis and is worth using in clinical setting.
- Citation: Xiong WJ, Liu F, Zhao ZX, Qiu DK. Application of an end-stage liver disease model in prediction of prognosis in patients with liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1159-1162
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1159.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1159
预测肝硬化患者的生存期及评估患者的预后对确定有效治疗方案十分重要. 血白细胞计数、血清白蛋白及前白蛋白、凝血酶原时间、血清胆红素、载脂蛋白、胆固醇、血清钠、AST/ALT比值、χ2微球蛋白、血清细胞因子水平等生化指标在一定程度上可反映慢性肝病患者肝功能状况[1-27], 但均难以准确地判断预后. Child-Pugh分级是目前广泛应用的肝功能评估系统, 基本上准确地反映了慢性肝病患者的预后, 并有助于手术危险性的评估, 但亦存在诸多缺陷. 近来国外研究表明终末期肝病模型(model of end stage liver disease, MELD)评分可有效评价各种中晚期肝脏疾病的严重程度, 并将其作为终末期肝病患者进行肝移植的器官分配标准 [28-30]. 目前国内尚无应用MELD评分对肝硬化患者的预后进行评估的报道, 我们应用MELD评分回顾性分析了199例肝硬化患者的生存状况, 旨在评估MELD评分对肝硬化患者短期和中期生存预测的价值, 并与Child-Pugh评分系统比较, 明确二者评价肝硬化预后的优缺点.
我院1998-09/2002-09住院肝硬化患者199例, 男124例, 女75例. 诊断依据1995年全国传染病寄生虫病学术会议制定的标准. 173例为乙型肝炎, 1例为丙型肝炎, 10例为血吸虫肝病, 7例为酒精性肝病, 自身免疫性肝病4例, 隐源性4例.
Child-Pugh计分按文献(慢性肝病临床并发症现代诊治概念. 上海: 上海科学技术出版社, 2001:25.)计算. 依照Mayo临床小组[28], 根据血清胆红素水平、血清肌酐水平和凝血酶原时间国际标准化比(INR)计算MELD计分: MELD计分=3.8×loge(血清胆红素(mg/dl)+ 11.2×loge(INR)+9.6×loge(血清肌酐(mg/dl)+ 6.4×loge(病因: 胆汁淤积或酒精性为0, 其他为1), 访问http://www.unos.org/resources, 填入相应的参数得到评分. 患者的MELD评分及Child评分指标为入院首日的检查结果.
统计学处理 采用SPSS统计软件进行, 3 mo及1年生存组与死亡组之间的临床及生化指标的比较用t检验, MELD评分与Child-Pugh评分的相关性用Spearman等级相关检验, 两种评分方法区别死亡与存活能力的评价用分辨度(即ROC曲线下面积)来衡量, 依据ROC曲线的截断值绘制Kaplan-Meier生存曲线. 以P<0.05为有统计学意义.
在肝硬化患者199例中, 随访3 mo内死亡37例, 2例(5.4%)为Child-Pugh A级, 9例(24.3%)为Child-Pugh B级, 26例(70.3%)为Child-Pugh C级; 随访1年内死亡59例, 其中5例(8.4%)为Child-Pugh A级, 17例(28.8%)为Child-Pugh B级, 37例(62.7%)为Child-Pugh C级, 死因均与肝病相关(表1). 3 mo生存组MELD及Child-Pugh评分分别为14.3±4.66和8.68±2.21, 死亡组分别为23.4±9.90和10.8±2.29, 两组比较有显著差异(P<0.001); 1年生存组MELD及Child-Pugh评分分别为14.0±5.11和8.43±2.23, 死亡组分别为20.3±9.31和10.3±2.32, 两组比较有显著差异(P<0.001).
| 临床特征 | 随访3 mo | 随访1年 | ||
| 生存组 | 死亡组 | 生存组 | 死亡组 | |
| 性别(男/女) | 104/58 | 20/17 | 89/51 | 35/24 |
| 年龄(岁) | 61.1±13.3 | 64.3±14.5 | 60.5±13.3 | 63.6±13.6 |
| 肝性脑病(有/无) | 28/134 | 11/26a | 25/109 | 16/43a |
| 腹水(有/无) | 105/57 | 32/5a | 69/65 | 51/8a |
| 胆红素(umol/L) | 36.6±35.2 | 93.2±98.5b | 36.6±36.8 | 72.0±83.4b |
| 白蛋白(g/L) | 27.1±6.12 | 23.1±4.73b | 27.8±6.04 | 23.9±5.12b |
| 肌酐(umol/L) | 103.4±50.4 | 135.3±76.9b | 90.2±61.0 | 119.3±66.3b |
| INR | 1.62±0.49 | 2.58±1.65b | 1.61±0.49 | 2.25±1.41b |
| Child-Pugh计分 | 8.68±2.21 | 10.8±2.29b | 8.43±2.23 | 10.3±2.32b |
| MELD计分 | 14.3±4.66 | 23.4±9.90b | 14.0±5.11 | 20.3±9.31b |
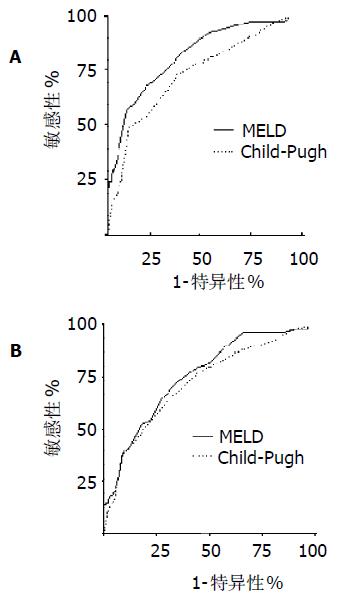
MELD和Child-Pugh对肝硬化患者3 mo预后预测ROC曲线下面积分别为0.826 (95%可信区间0.752-0.900), 0.745 (95% 可信区间0.656-0.835), 两组比较有显著差异(P<0.05, 图1); MELD和Child-Pugh对肝硬化患者1年预后预测ROC曲线下面积分别为0.758 (95% 可信区间0.687-0.830), 0.724(95% 可信区间0.646-0.802), MELD评分分辨度在数值上要优于Child-Pugh计分, 但两组间比较无显著性差异(P>0.05).
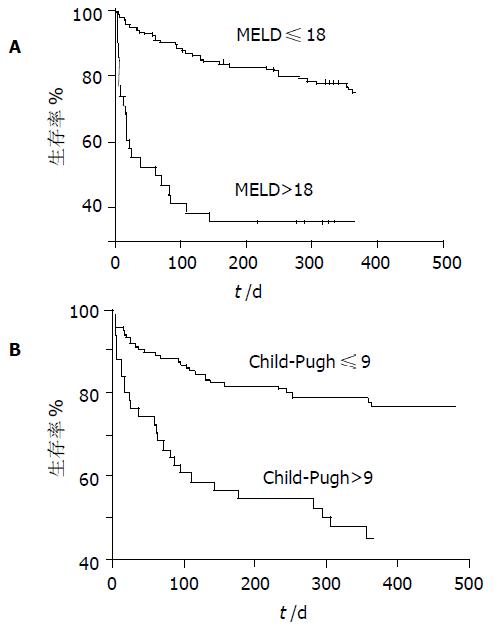
依据ROC曲线, MELD及Chlid-Pugh计分对3 mo预后判断的截断值分别为20和10; 对1年预后判断的截断值分别为18和9. 表明MELD与Child-Pugh计分评分均可有效分辨3 mo及1年内可能生存及死亡的患者(P<0.001,图2). Spearman等级相关分析表明MELD评分与Child评分显著相关, 相关系数为0.69 (P<0.001).
Child-Pugh计分可较准确地反映慢性肝病患者的预后, 并有助于手术危险性的估测. 近年来, 等待肝移植的患者急剧增加, 而肝移植供者十分短缺, 导致等待肝移植患者的死亡不断增加. 因此, 需要更好地评价患者疾病的严重程度和肝移植需要的紧急程度, 来决定供肝的分配. 随着经验的积累, 采用CTP积分的移植肝分配系统的许多缺陷逐渐暴露出来, 如他使用了诸如肝性脑病和腹水之类的主观标准, 所以学者们一直在探讨新的能客观反应肝硬化患者病情严重程度以决定肝移植器官分配优先权的预后判别模式. 2001年Mayo Clinic的Kamathet al[28]提出了一个新的评价系统, 称为终末期肝病模型(MELD), 他以血清胆红素、肌酐和INR等3个生化变量为依据, 具有简便可行、重复性好、客观性强等特点. 由于以上优点, 并且MELD评分系统可以较准确地反映终末期肝病患者病情严重程度, 2002年美国器官分配网络开始应用MELD评分系统决定供肝的分配[30].
Botta et al[31]报告MELD评分方法是预测欧洲肝硬化患者6 mo和1年生存率的良好指标, MELD评分方法至少不比Child-Pugh 评分差, MELD评分较高者肝功能较差. Giannini et al[32]研究表明MELD可用于病毒性肝硬化患者预后的评估, 联合AST/ALT比值可提高MELD评分3 mo预后预测的准确性. Wiesner et al[33]进行了一项前瞻性研究, 采用MELD积分对患者超过3 mo以上的死亡风险进行评估, 发现MELD评分小于9的肝病患者3 mo死亡率为1.9%, 而MELD评分大于或等于40的患者死亡率到达71.3%, 采用C统计方法, 以3 mo死亡率为终点, MELD积分的ROC曲线下面积为0.83, 而CTP积分为0.76, 二者存在显著性差异, 提示MELD积分在估计患者3 mo死亡危险上明显优于CTP积分, 认为MELD可为肝移植部门提供一个连贯的肝病严重程度积分评估方法, 因而可用于肝移植的供肝分配.
我们发现肝硬化患者3 mo及1年死亡组的MELD评分与Child-Pugh 评分均明显高于生存组, 与文献[28,33]报道一致. ROC分析表明MELD评分与Child-Pugh 评分均有较大的曲线下面积, 表明其分辨度好, 能较好地区分可能死亡和可能存活的患者, 且MELD评分的短期分辨率显著优于Child-Pugh评分, 表明MELD评分较Child-Pugh评分更能反应疾病的危急程度. 生存曲线表明MELD评分与Child-Pugh 评分均可有效地分辨3 mo及1年内可能生存及死亡的患者. 对比传统的Child-Pugh分级而言, MELD评分以血清胆红素等3个常用的生化变量为依据, 不仅考虑了肝功能状况, 而且兼顾了肾功能和不同的病因, 具有可动态观察及客观性强等特点, 避免了Child-Pugh分级中的主观因素, 其中期评估效率与Child-Pugh分级相似, 短期评估效率优于Child-Pugh评分, 能较好地预测终末期肝病死亡发生的危险度, 值得临床应用.
| 3. | 徐 学刚, 张 美稀, 董 惠芳, 杨 协珍, 金 树根, 陈 建杰, 王 灵台. 肝病患者血清肿瘤坏死因子alpha水平变化. 世界华人消化杂志. 2003;11:856-858. [DOI] |
| 11. | 赵 超, 陈 少波, 周 建平, 肖 文, 范 汉恭, 吴 学威, 冯 干炘, 何 维雄. 影响肝硬变食管胃底静脉曲张破裂出血预后的分析. 世界华人消化杂志. 2000;8:466-467. [DOI] |
| 20. | 唐 宝璋, 燕 奎华, 黄 礼云, 庄 林, 游 晶, 陈 红英. 慢性乙型肝炎患者血清内毒素、IL-4、IL-18水平的变化. 世界华人消化杂志. 2003;11:2041-2042. [DOI] |
| 23. | Chen YD, Liu MY, Yu WL, Li JQ, Dai Q, Zhou ZQ, Tisminetzky SG. Mix-infections with different genotypes of HCV and with HCV plus other hepatitis viruses in patients with hepatitis C in China. World J Gastroenterol. 2003;9:984-992. [PubMed] [DOI] |
| 24. | Han DW. Intestinal endotoxemia as a pathogenetic mechanism in liver failure. World J Gastroenterol. 2002;8:961-965. [PubMed] [DOI] |
| 25. | Zeng WJ, Liu GY, Xu J, Zhou XD, Zhang YE, Zhang N. Pathological characteristics, PCNA labeling index and DNA index in prognostic evaluation of patients with moderately differentiated hepatocellular carcinoma. World J Gastroenterol. 2002;8:1040-1044. [PubMed] [DOI] |
| 26. | Hao XS, Chen KX, Wang PP, Rohan T. Changes in survival patterns in urban Chinese patients with liver cancer. World J Gastroenterol. 2003;9:1212-1215. [PubMed] [DOI] |
| 27. | Li XP, Chen Z, Meng ZQ, Huang WX, Liu LM. Concurrent hyperglycemia does not influence the long-term prognosis of unresectable hepatocellular carcinomas. World J Gastroenterol. 2003;9:1848-1852. [PubMed] [DOI] |
| 28. | Kamath PS, Wiesner RH, Malinchoc M, Kremers W, Therneau TM, Kosberg CL, D'Amico G, Dickson ER, Kim WR. A model to predict survival in patients with end-stage liver disease. Hepatology. 2001;33:464-470. [PubMed] [DOI] |
| 29. | Forman LM, Lucey MR. Predicting the prognosis of chronic liver disease: an evolution from child to MELD. Mayo End-stage Liver Disease. Hepatology. 2001;33:473-475. [PubMed] [DOI] |
| 30. | Everson GT. MELD: the answer or just more questions? Gastroenterology. 2003;124:251-254. [PubMed] [DOI] |
| 31. | Botta F, Giannini E, Romagnoli P, Fasoli A, Malfatti F, Chiarbonello B, Testa E, Risso D, Colla G, Testa R. MELD scoring system is useful for predicting prognosis in patients with liver cirrhosis and is correlated with residual liver function: a European study. Gut. 2003;52:134-139. [PubMed] [DOI] |
| 32. | Giannini E, Botta F, Testa E, Romagnoli P, Polegato S, Malfatti F, Fumagalli A, Chiarbonello B, Risso D, Testa R. The 1-year and 3-month prognostic utility of the AST/ALT ratio and model for end-stage liver disease score in patients with viral liver cirrhosis. Am J Gastroenterol. 2002;97:2855-2860. [PubMed] [DOI] |
| 33. | Wiesner R, Edwards E, Freeman R, Harper A, Kim R, Kamath P, Kremers W, Lake J, Howard T, Merion RM. Model for end-stage liver disease (MELD) and allocation of donor livers. Gastroenterology. 2003;124:91-96. [PubMed] [DOI] |