修回日期: 2004-02-15
接受日期: 2004-02-21
在线出版日期: 2004-05-15
目的: 探讨环氧化酶-2(cyclooxygenase-2, COX-2)抑制剂Celecoxib和顺铂联合应用对胰腺癌细胞增生、凋亡的影响.
方法: 用Celecoxib和顺铂处理胰腺癌BxPC-3细胞后, 用噻唑蓝(MTT)检测细胞的相对存活率, RT-PCR检测COX-2 mRNA的表达, 流式细胞术和Hoechst-33 258染色检测其对BxPC-3的凋亡诱导作用.
结果: Celecoxib 作用于BxPC-3细胞后, 细胞的存活率呈剂量和时间依赖性, 其中24 h的IC50值为100 nM, Celecoxib可明显降低BxPC-3细胞COX-2 mRNA的表达; Celecoxib和顺铂联合应用对胰腺癌细胞增生的抑制和凋亡的诱导作用更加明显, Hoechst-33 258染色可呈现凋亡的形态学改变.
结论: COX-2抑制剂和顺铂联合应用对抑制胰腺癌细胞增生和诱导细胞凋亡的高效性, 表明其在临床上具有潜在的应用价值.
引文著录: 刘江伟, 李开宗, 窦科峰, 宋振顺, 苏明权, 于文彬. COX-2抑制剂联合顺铂对胰腺癌细胞增生和凋亡的影响. 世界华人消化杂志 2004; 12(5): 1139-1143
Revised: February 15, 2004
Accepted: February 21, 2004
Published online: May 15, 2004
AIM: To investigate the effects of proliferation and apoptosis induced by cyclooxygenase-2 (COX-2) inhibitor celecoxib in combination with cisplatin.
METHODS: The human pancreatic cancer cell line BxPC-3 cells were treated with COX-2 inhibitors celecoxib and cisplatin. The cell relative viability was examined using 3 (4, 5-dimethylethiazoly 1-2-) 2, 5-diphonyl tetrazolium bromide (MTT) assays. the expression of COX-2 mRNA was detected by RT-PCR, flow cytometry and Hoechst-33258 were used to demonstrate apoptotic changes in celecoxib and cisplatin treated cells.
RESULTS: After treatment of BxPC-3 cells with celecoxib, as measured by MTT, cell viability was inhibited in a dose-dependent and time-dependent manner with an IC50 of 100 nM at the time of 24h. The expression of COX-2 mRNA could be significantly decreased by celecoxib. Furthermore, we demonstrated that the combination of celecoxib with cisplatin inhibited cell growth and induced cell apoptosis to a greater degree than either compound alone. The apoptotic morphologies were demonstrated by Hoechst-33 258.
CONCLUSION: Combination of celecoxib with cisplatin inhibits cell proliferation and induces cell apoptosis, and the potent effectiveness of celecoxib in combination with gemcitabine may hold a promise in the clinical treatment of pancreatic cancer.
- Citation: Liu JW, Li KZ, Dou KF, Song ZS, Su MQ, Yu WB. Effects of COX-2 inhibitor with cisplatin on proliferation and apoptosis of pancreatic cancer cells. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1139-1143
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1139.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1139
环氧化酶-2(cyclooxygenase-2, COX-2)是炎症过程中催化前列腺素合成的一个关键诱导酶, 与多种肿瘤细胞增生、抗凋亡和血管生成, 与肿瘤的发生、发展和预后密切相关[1-27]. COX-2抑制剂能抑制多种肿瘤细胞的增生和诱导细胞凋亡[28-34]. Celecoxib(塞来昔布)为一种选择性COX-2抑制剂, 是近年来被FDA批准上市的非甾体类抗炎药物(Nonsteroidal anti-inflammatory drugs, NSAIDs), 基于COX-2在胰腺癌组织中高表达[35], 我们将Celecoxib与顺铂联合应用, 为胰腺癌的治疗寻求新的途径.
胰腺癌BxPC-3细胞系购自第四军医大学口腔生物细胞培养库, 以含100 mL/L的新生小牛血清(56 ℃, 灭活30 min)、100 kU/L青霉素、100 mg/L链霉素的RPMI1 640培养基(Gibco公司), 在37 ℃, 50 mL/L CO2饱和湿度条件下培养, 每当2-3 d换液传代, 取对数期生长的细胞实验. RNA提取液(Trizol), 购自Life Technologies公司, RT-PCR购自Takara公司; MTT(Sigma公司); Annexin V试剂盒(Roche 公司); Celecoxib (Searle公司), 用1 kg/L二甲基亚砜(DMSO)溶解, 制成20 moL/L的储存液, -20 ℃保存; 顺铂(锦州制药一厂).
1.2.1 细胞存活率的影响: 单细胞悬液以每孔5×10 3 个细胞100 mL接种于96孔培养板中, 贴壁24 h后更换培养液, 同时加入不同浓度的celecoxib溶液, 各组终浓度为20 mmoL/L, 40 mmoL/L, 80 mmoL/L, 100 mmoL/L, 120 mmoL/L ; 空白对照组只加含1 g/L 的DMSO培养液. 分别于12, 24, 48, 72, 96 h加入MTT溶液(5 g/L) 20 mL, 37 ℃, 4 h后弃上清, 加入二甲基亚砜(DMSO) 150 mL, 震荡10 min, 选490 nm波长在酶联免疫检测仪上测定各孔吸光度(A)值, 每个浓度设3个复孔, 计算肿瘤细胞相对存活率 = 实验孔A值/对照孔A值×100%. 单细胞悬液以每孔5×10 3 个细胞100 mL接种于96孔培养板中, 贴壁24 h后更换培养液, 同时实验根据加入顺铂的浓度分6组: 0 mg/L, 1 mg/L, 2.5 mg/L, 5 mg/L, 10 mg/L, 15 mg/L; 再在每个浓度组中分别加入celecoxib使其终浓度分别为: 0 mmol/L、40 mmoL/L、 80 mmoL/L、100 mmoL/L, 作用24 h后用MTT分别检测各孔吸光度(A)值, 计算相对存活率, 实验同时设3个复孔.
1.2.2 COX-2 mRNA的表达: 用100 mmoL/L celecoxib作用BxPC-3细胞24 h, 收获1×106细胞, 用RNA提取液(Trizol)提取总RNA, 并用紫外分光光度计准确定量. 取1 mg总RNA用于逆转录合成cDNA, 20 mL反应体系包括: MgCl2 (25 mmoL/L) 4 mL , 10×RNA PCR 缓冲液2 mL, dNTP混合物(各10 mmol/L)2 mL, RNase 抑制剂(40 MU/ L) 0.5 mL, AMV逆转录酶(5 MU/ L) 1 mL, 随机引物(50mmoL/L) 1 mL. 转录条件为 30 ℃ 10 min, 42 ℃ 30 min, 99 ℃ 5 min至4 ℃保存. 10 mL cDNA用于PCR反应, 50 mL反应体系包括: MgCl2 (25 mmoL/L) 3 mL, 10×RNA PCR 缓冲液4 mL, Takara Taq酶(5 MU/L) 0.25 mL, 上、下游引物各0.5 mL. COX-2引物序列: 5'-TGAAACCCACTCCAAACACAG -3'(F)和5'-TCATCAGGCACAGGAGGAAG-3'(R), 232 bp; 内参β-actin引物序列为: 5'-CTTCTACAATGAGCTGCGTG-3'(F)和5'-TCATGAGGTAGTCAGTCAGG-3'(R), 309 bp. 扩增条件: 94 ℃预变性2 min, 94 ℃变性30 s, 51 ℃退火30 s (β-actin为59 ℃), 72 ℃延伸90 s, 32个循环后, 72 ℃延伸5 min. PCR 产物5 mL在2 g/L琼脂糖上电泳(含0.5 mg/L溴化乙锭), 经凝胶图像分析仪分析结果, 将COX-2和β-actin的比值做为COX-2表达的参数, 对COX-2的PCR产物进行相对定量. 取未处理的BxPC-3细胞做对照, 实验重复2次.
1.2.3 细胞凋亡的检测: 分别用100 mL的培养瓶培养细胞至70-80%铺满后, 根据加入的药物和浓度实验分4组: (1)对照组(未做处理); (2)100 mmoL/L celecoxib; (3) 5 mg/L顺铂; (4) 100 mmoL/L celecoxib+5 mg/L顺铂, 作用BxPC-3细胞24 h, 漂浮细胞和用胰酶消化下的细胞5×105, PBS洗涤2次, 加入annexin V-FITC和碘化丙锭(PI), 室温下避光孵育15 min, 立即进行流式细胞仪检测, 实验重复1次. 另将密度5×104的BxPC-3细胞加入不同的放有盖玻片的培养皿中, 让细胞在盖玻片贴壁生长, 2 d更换培养液, 同时加入不同浓度的药物: (1)对照组(未做处理); (2)100 mmol/L celecoxib、(3)5 mg/L顺铂(4)100 mmoL/L celecoxib+5mg/L顺铂. 作用24 h后, 弃培养液, 加入4%多聚甲醛固定20 min, PBS冲洗, 加入1 mmol/L 的Hoechst 33 258 (Sigma公司, 美国) 室温染色15 min, 封片, 在激发365 nm波长荧光的荧光显微镜(Olympus Optical Co., 日本)下观察细胞核形态.
统计学处理 采用SPSS 10.0, 进行作图和统计分析, 均数比较用t检验.
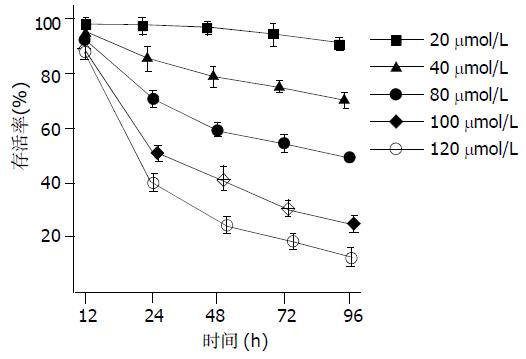
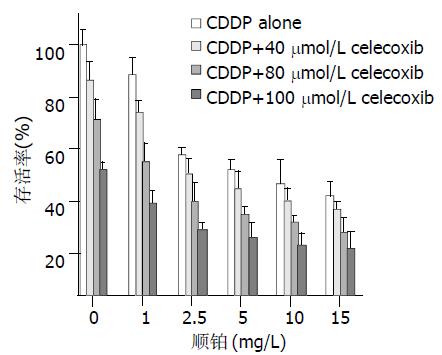
celecoxib处理BxPC-3细胞后, 细胞存活率呈明显时间和浓度依赖性(图1), 20 mmol/L celecoxib对细胞的存活率影响最小, 20 mmoL/L, 40 mmoL/L, 80 mmoL/L的celecoxib在96 h细胞的存活率分别为90.5±0.8%、70.4±1.2%、49.1±0.6%, 而100 mmoL/L celecoxib 在24 h细胞的存活率可降到51.0±1.1% (接近 IC50值), 以120mmoL/L celecoxib作用效果最明显, 24 h细胞存活率为40.4±0.7%, 96 h细胞的存活率可降低到13.3±0.8%. 24 h单独应用80mmoL/L celecoxib细胞的存活率为70.7±3.4%; 单独应用顺铂1 mg/L, 2.5 mg/L, 5 mg/L, 10 mg/L, 15 mg/L, 细胞的存活率分别为88.4±2.8%、56.4±1.3%、50.4±1.8%、45.0±3.9%、40.0±2.4%; 80 mmoL/L celecoxib和不同浓度的顺铂联合应用, 细胞的存活率分别为: 53.5±3.1%、37.7±2.2%、32.5±1.2%、29.6±1.1%、25.5±2.3%; 联合实验组与单独应用二者相比均能明显降低细胞的存活率, 差异均有显著性(P<0.01). 联合实验的效果与celecoxib的浓度呈依赖性, 在100 mmoL/L celecoxib存在的情况下, 可使5 mg/L顺铂对细胞的存活率降为23.6±2.3%, 其效果强于80 mmoL/L celecoxib和15 mg/L顺铂联合应用对细胞存活率的影响(图2).
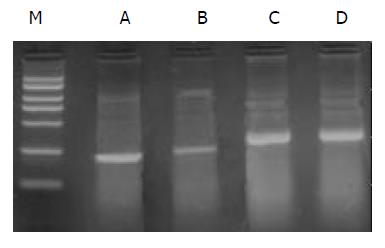
RT-PCR产物电泳显示, 对照组和处理组在232 bp处均出现特异性COX-2条带, 实验组COX-2 mRNA表达明显低于对照组, 经凝胶图像分析仪分析结果显示: 实验组和对照组COX-2/β-actin分别为0.31±0.03和0.86±0.06, 二者之间差异具有显著性(P<0.01)(图3).
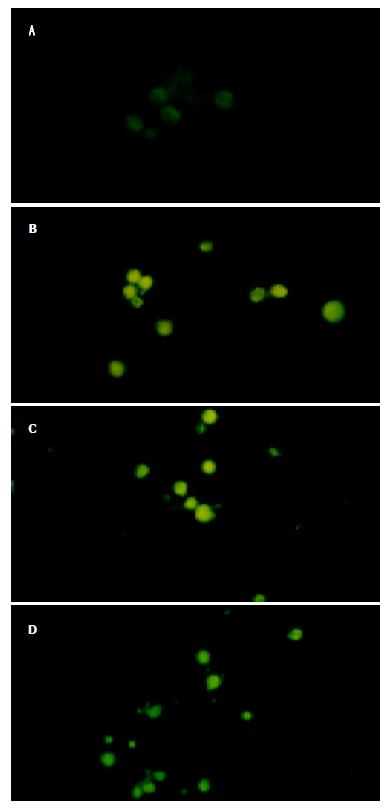
各实验组(1)对照组; (2)100 mmoL/L celecoxib、(3) 5 mg/L顺铂 (4)100 mmoL/L celecoxib+5 mg/L顺铂)作用BxPC-3细胞24 h, 流式细胞仪检测细胞凋亡率分别为0.25±0.07%、14.55±0.35%、8.95±2.75%和22.2±1.27%, 其中各实验组与对照组相比以及联合用药组与单独用药组相比, 均具有显著性差异(P<0.01). Hoechst 33 258荧光染色显示 正常对照组细胞发出微弱的绿色荧光, 细胞核无明显的形态学改变, 在各实验组均发现有细胞核浓缩聚集, 核碎裂, 并发出较强的绿色荧光. (图4A-D).
非甾体类抗炎药物(nonsteroidal anti-inflammatory drugs NSAIDs)能够有效地预防肿瘤, NSAIDs主要作用于环氧化酶. 环氧化酶有两种同工酶COX-1和COX-2. COX-2在大多数正常组织中不表达, 但在细胞受到各种刺激如炎症因子、生长因子、促癌剂等的诱导下迅速合成, 参与炎症过程和肿瘤的发生[36]. COX-2过表达和预后不良有关[37]. 我们发现[35], COX-2在胰腺癌中的表达率为74.5%, 而在癌旁非肿瘤胰腺组织中未见表达; COX-2的表达与患者的临床分期和淋巴结转移呈密切正相关(P<0.05), 表明COX-2抑制剂可能成为治疗胰腺癌的有效药物, 因传统的NSAIDs同时抑制COX-1和COX-2, 易引起胃出血和肾功能损害等副作用, 而选择性COX-2抑制剂则可避免这些不良反应, celecoxib是近年来被FDA批准上市的NSAIDs, 是一种选择性的COX-2抑制剂, 我们应用 celecoxib作用于胰腺癌BxPC-3细胞, 可明显降低COX-2 mRNA的表达, 对细胞增生的抑制呈明显的剂量和时间依赖性, 100 mmoL/L celecoxib 在24 h时细胞的存活率可降到50.99%(接近 IC50值), 以120 mmoL/L celecoxib作用效果最明显, 24 h时细胞的存活率为40.4%, 96 h时细胞的存活率可降低到13.3%.
我们研究发现, 联合实验组与单独应用两种药物相比均能明显降低细胞的存活率, 差异均具有显著性(P<0.01). 80 mmoL/L celecoxib与2.5 mg/L顺铂联合应用, 细胞的存活率(37.7±2.2%)低于单独应用15 mg/L顺铂时的细胞存活率(40.0±2.4%); 100mmoL/L celecoxib和5 mg/L顺铂联合应用对BxPC-3细胞增生抑制效果强于80 mmoL/L celecoxib和15 mg/L顺铂联合应用. 可见, 适当浓度的celecoxib与顺铂联合应用不但能减少顺铂的用量, 而且能增强抗肿瘤效能. 流式细胞仪对细胞凋亡率的检测发现: celecoxib和顺铂均能诱导细胞凋亡、二者联合应用更能促进凋亡的发生.
COX-2的诱导凋亡机制目前尚未阐明, 可能与以下机制有关: COX-2 抑制剂诱导肿瘤细胞的凋亡可通过细胞色素c的释放和caspase-9和 caspase-3的激活[38]; COX-2 抑制剂可降低肿瘤细胞Bcl-2的表达或通过抑制肿瘤细胞抗凋亡激酶Akt(又称蛋白激酶B)活性来诱导细胞凋亡 [34]; COX-2在胆囊癌细胞的抗凋亡作用可通过上调Bcl-2家族的抗凋亡基因Mcl-1来实现[39]; Celecoxib诱导结肠癌HT-29细胞的凋亡可通过抑制3-磷酸肌醇依赖性激酶(3-phosphoinositide-dependent kinase 1, PDK1)的活性来完成[40]; Grosch et al[41]认为, celecoxib的抗肿瘤效应可通过下调cyclin A, cyclin B1, 和CDK-1(cyclin-dependent kinase-1)和上调周期抑制蛋白p21Waf1 和p27Kip1使细胞在G0/G1期阻滞, 表明celecoxib的抗肿瘤作用可能通过非依赖性COX-2途径实现, 因而celecoxib对肿瘤的作用可能并不局限于COX-2的肿瘤. 至于celecoxib诱导胰腺癌细胞凋亡的机制尚需进一步研究, 我们的结果已显示COX-2 抑制剂celecoxib可明显诱导胰腺癌细胞的凋亡和抑制细胞增生, celecoxib和顺铂联合应用的高效性, 表明COX-2抑制剂在胰腺癌的治疗上具有潜在的临床应用价值.
| 1. | Moran EM. Epidemiological and clinical aspects of nonsteroidal anti-inflammatory drugs and cancer risks. J Environ Pathol Toxicol Oncol. 2002;21:193-201. [PubMed] |
| 2. | 郜 恒骏, 于 连珍, 孙 亮, 缪 琨, 白 剑峰, 张 小勇, 吕 秀珍, 赵 志泉. 胃癌及癌旁组织中COX-2基因蛋白的表达. 世界华人消化杂志. 2000;8:578-579. [DOI] |
| 3. | 吴 汉平, 吴 开春, 李 玲, 幺 立萍, 兰 梅, 王 新, 樊 代明. 人环氧合酶-2(hCOX-2)编码基因的克隆及其反义核酸转染胃癌细胞 的初步研究. 世界华人消化杂志. 2000;8:1211-1217. [DOI] |
| 4. | Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, Miu K, L XZ, Zhang XY, Zhao ZQ. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions:H.pylori infection, histological types and staging. World J Gastroenterol. 2000;6:848-854. [PubMed] [DOI] |
| 6. | 孙 波, 吴 云林, 张 学军, 王 升年, 贺 恒益, 乔 敏敏, 章 永平, 钟 捷. 舒林酸抑制人胃腺癌细胞增生及诱导凋亡. 世界华人消化杂志. 2001;9:997-1002. [DOI] |
| 9. | Wang X, Lan M, Wu HP, Shi YQ, Lu J, Ding J, Wu KC, Jin JP, Fan DM. Direct effect of croton oil on intestinal epithelial cells and colonic smooth muscle cells. World J Gastroenterol. 2002;8:103-107. [PubMed] [DOI] |
| 11. | 胡 国勇, 于 皆平, 冉 宗学, 余 保平, 罗 和生. 选择性COX-2抑制剂尼美舒利抑制胃癌细胞株SGC7901端粒酶的活性. 世界华人消化杂志. 2003;11:25-28. [DOI] |
| 14. | 谢 传高, 王 兴鹏, 董 育玮, 杜 勤, 蔡 建庭, 钱 可大. 选择性环氧合酶-2抑制剂Celebrex对胰腺癌PGE2和血管内皮因子表达的 影响. 世界华人消化杂志. 2003;11:979-981. [DOI] |
| 15. | Wu AW, Gu J, Ji JF, Li ZF, Xu GW. Role of COX-2 in carcinogenesis of colorectal cancer and its relationship with tumor biological characteristics and patients' prognosis. World J Gastroenterol. 2003;9:1990-1994. [PubMed] [DOI] |
| 16. | Shi H, Xu JM, Hu NZ, Xie HJ. Prognostic significance of expression of cyclooxygenase-2 and vascular endothelial growth factor in human gastric carcinoma. World J Gastroenterol. 2003;9:1421-1426. [PubMed] [DOI] |
| 17. | Dong WG, Mei Q, Yu JP, Xu JM, Xiang L, Xu Y. Effects of melatonin on the expression of iNOS and COX-2 in rat models of colitis. World J Gastroenterol. 2003;9:1307-1311. [PubMed] [DOI] |
| 18. | Li HX, Chang XM, Song ZJ, He SX. Correlation between expression of cyclooxygenase-2 and angiogenesis in human gastric adenocarcinoma. World J Gastroenterol. 2003;9:674-677. [PubMed] [DOI] |
| 19. | Li HX, Chang XM, Song ZJ, He SX. Correlation between expression of cyclooxygenase-2 and angiogenesis in human gastric adenocarcinoma. World J Gastroenterol. 2003;9:674-677. [PubMed] [DOI] |
| 20. | Guo XL, Wang LE, Du SY, Fan CL, Li L, Wang P, Yuan Y. Association of cyclooxygenase-2 expression with Hp-cagA infection in gastric cancer. World J Gastroenterol. 2003;9:246-249. [PubMed] [DOI] |
| 21. | Ristimäki A, Sivula A, Lundin J, Lundin M, Salminen T, Haglund C, Joensuu H, Isola J. Prognostic significance of elevated cyclooxygenase-2 expression in breast cancer. Cancer Res. 2002;62:632-635. [PubMed] |
| 22. | Xu XC. COX-2 inhibitors in cancer treatment and prevention, a recent development. Anticancer Drugs. 2002;13:127-137. [PubMed] [DOI] |
| 23. | Niki T, Kohno T, Iba S, Moriya Y, Takahashi Y, Saito M, Maeshima A, Yamada T, Matsuno Y, Fukayama M. Frequent co-localization of Cox-2 and laminin-5 gamma2 chain at the invasive front of early-stage lung adenocarcinomas. Am J Pathol. 2002;160:1129-1141. [PubMed] [DOI] |
| 24. | Zahner G, Wolf G, Ayoub M, Reinking R, Panzer U, Shankland SJ, Stahl RA. Cyclooxygenase-2 overexpression inhibits platelet-derived growth factor-induced mesangial cell proliferation through induction of the tumor suppressor gene p53 and the cyclin-dependent kinase inhibitors p21waf-1/cip-1 and p27kip-1. J Biol Chem. 2002;277:9763-9771. [PubMed] [DOI] |
| 25. | Wu GS, Zou SQ, Liu ZR, Wang DY. Bile from a patient with anomalous pancreaticobiliary ductal union promotes the proliferation of human cholangiocarcinoma cells via COX-2 pathway. World J Gastroenterol. 2003;9:1094-1097. [PubMed] [DOI] |
| 26. | Wu GS, Zou SQ, Luo XW, Wu JH, Liu ZR. Proliferative activity of bile from congenital choledochal cyst patients. World J Gastroenterol. 2003;9:184-187. [PubMed] [DOI] |
| 27. | Qiu DK, Ma X, Peng YS, Chen XY. Significance of cyclooxygenase-2 expression in human primary hepatocellular carcinoma. World J Gastroenterol. 2002;8:815-817. [PubMed] [DOI] |
| 28. | Tian G, Yu JP, Luo HS, Yu BP, Yue H, Li JY, Mei Q. Effect of nimesulide on proliferation and apoptosis of human hepatoma SMMC-7721 cells. World J Gastroenterol. 2002;8:483-487. [PubMed] [DOI] |
| 29. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of Sulindac on Human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [PubMed] [DOI] |
| 30. | Wu GS, Zou SQ, Liu ZR, Tang ZH, Wang JH. Celecoxib inhibits proliferation and induces apoptosis via prostaglandin E2 pathway in human cholangiocarcinoma cell lines. World J Gastroenterol. 2003;9:302-306. [DOI] |
| 31. | Li MY, Deng H, Zhao JM, Dai D, Tan XY. PPARgamma pathway activation results in apoptosis and COX-2 inhibition in HepG2 cells. World J Gastroenterol. 2003;9:1220-1226. [PubMed] [DOI] |
| 32. | Li JY, Wang XZ, Chen FL, Yu JP, Luo HS. Nimesulide inhibits proliferation via induction of apoptosis and cell cycle arrest in human gastric adenocarcinoma cell line. World J Gastroenterol. 2003;9:915-920. [PubMed] [DOI] |
| 33. | Li HL, Chen DD, Li XH, Zhang HW, Lu YQ, Ye CL, Ren XD. Changes of NF-κB, p53, Bcl-2 and caspase in apoptosis induced by JTE-522 in human gastric adenocarcinoma cell line AGS cells: role of reactive oxygen species. World J Gastroenterol. 2002;8:431-435. [PubMed] [DOI] |
| 34. | Mizutani Y, Kamoi K, Ukimura O, Kawauchi A, Miki T. Synergistic cytotoxicity and apoptosis of JTE-522, a selective cyclooxygenase-2 inhibitor, and 5-fluorouracil against bladder cancer. J Urol. 2002;168:2650-2654. [PubMed] [DOI] |
| 36. | Ristimäki A, Sivula A, Lundin J, Lundin M, Salminen T, Haglund C, Joensuu H, Isola J. Prognostic significance of elevated cyclooxygenase-2 expression in breast cancer. Cancer Res. 2002;62:632-635. [PubMed] |
| 37. | Costa C, Soares R, Reis-Filho JS, Leitão D, Amendoeira I, Schmitt FC. Cyclo-oxygenase 2 expression is associated with angiogenesis and lymph node metastasis in human breast cancer. J Clin Pathol. 2002;55:429-434. [PubMed] [DOI] |
| 38. | Li M, Wu X, Xu XC. Induction of apoptosis in colon cancer cells by cyclooxygenase-2 inhibitor NS398 through a cytochrome c-dependent pathway. Clin Cancer Res. 2001;7:1010-1016. [PubMed] |
| 39. | Nzeako UC, Guicciardi ME, Yoon JH, Bronk SF, Gores GJ. COX-2 inhibits Fas-mediated apoptosis in cholangiocarcinoma cells. Hepatology. 2002;35:552-559. [PubMed] [DOI] |
| 40. | Arico S, Pattingre S, Bauvy C, Gane P, Barbat A, Codogno P, Ogier-Denis E. Celecoxib induces apoptosis by inhibiting 3-phosphoinositide-dependent protein kinase-1 activity in the human colon cancer HT-29 cell line. J Biol Chem. 2002;277:27613-27621. [PubMed] [DOI] |