修回日期: 2004-01-09
接受日期: 2004-01-15
在线出版日期: 2004-05-15
目的: 观察血管紧张素转换酶抑制剂培哚普利抗大鼠肝纤维化的疗效及作用机制.
方法: 将80只Wistar大鼠随机分为5组, 每组16只大鼠. A组为正常对照组; B, C组为肝纤维化模型组; D, E组为培哚普利治疗组. B, C, D和E组大鼠均给四氯化碳8 wk诱导肝纤维化; D, E组大鼠分别于4, 8 wk予以培哚普利灌胃治疗. A, B, D组大鼠于8 wk处死, C, E组大鼠于12 wk处死. RT-PCR检测大鼠肝组织TGFb1与TGFRⅡmRNA; 免疫组化技术检测Smad3及Smad7在肝内的表达及定位; HE染色及电镜检测检测肝组织病理改变.
结果: 与模型组大鼠比较, RT-PCR显示经培哚普利治疗大鼠肝内TGFb1与TGFRⅡ mRNA (P<0.05或P<0.01), 以及Smad3表达明显降低; 而Smad7的表达增加, Smad3的免疫阳性反应信号主要位于纤维间隔中的细胞质, Smad7则主要在肝细胞质表达.大鼠肝组织TGFb1与TGFRⅡ mRNA, Smad3与Smad7在D组与E组表达比较差异有显著性(P<0.05), 而上述物质在B组与C组比较差异无显著性(P>0.05). 培哚普利治疗后, 大鼠肝小叶结构趋于正常, 纤维间隔明显变薄, 肝细胞超微结构改善.
结论: 培哚普利能有效地减轻肝纤维化大鼠的肝脏损伤及纤维化程度, 其机制可能与抑制肝内TGFb1与TGFRⅡ mRNA及Smad3表达, 促进Smad7表达有关.
引文著录: 龚作炯, 宋仕玲, 阮鹏, 向龙奎, 张志荣. 血管紧张素转换酶抑制剂对肝纤维化大鼠TGFb,TGFR II,Smad3,7表达的影响. 世界华人消化杂志 2004; 12(5): 1132-1135
Revised: January 9, 2004
Accepted: January 15, 2004
Published online: May 15, 2004
AIM: To assess the effects of an angiotensin-converting enzyme inhibitor, perindopril on preventing hepatic fibrosis induced by CCl4 in rats and to investigate the alternation of the expression of transforming growth factor-beta1 (TGFb1) and its receptor Ⅱ (TGFRⅡ) and smads on liver tissues.
METHODS: 80 Wistar rats were randomly allocated into five groups: group A was healthy controls, groups B and C were hepatic fibrotic models induced by carbon tetrachloride (CCl4), groups D and E were models treated with perindopril starting at the first and fourth week since rat exposured CCl4. Except for group A, rats were subcutaneously injected with CCl4 for eight weeks. Rats in groups A, B and D were killed at eighth week, and rats in groups C and E were sacrificed at twelveth week. The blood and liver of rats were collected for further determinations. The effects of perindopril on hepatic fibrosis were evaluated by detecting the level of TGFb1 and TGFRⅡmRNA by RT-PCR. And the expression and its localization of Smad3 and Smad7 in liver tissue by an immunohistochemical staining. The liver histopathology was also examined by HE staining and an electron microscope.
RESULTS: Contrasted to the groups B and C, the level of TGFb1, TGFRⅡ mRNA and the expression of Smad3 were significantly decreased in groups D and E, and the expression of Smad7 was also significantly increased in liver of the two groups (P < 0.05 or P < 0.01). The expression of TGFb1 and TGFRbⅡmRNA, Smad3 and Smad7 were not different between groups B and C (P > 0.05), but there was a significant difference between groups D and E (P < 0.05). Compared with model groups, the histological changes of fibrosis and the dynamic ultrastructureal alterations in rats treated with perindopril were also obviously improved (P < 0.05).
CONCLUSION: The angiotensin-converting enzyme inhibitor, perindopril has a protective effect on liver injury and can ameliorate hepatic fibrosis in rats induced by CCl4. The mechanisms of perindopril anti-fibrosis may be associated with their effects of down-regulating TGFb1 and TGFRⅡ mRNA and smad3, up-regulating Smad7 and result in suppressing the activation of hepatic stellate cells.
- Citation: Gong ZJ, Song SL, Ruan P, Xiang LK, Zhang ZR. Effects of angiotensin-converting enzyme inhibitor on expression of TGFb1 and TGFRⅡmRNA, Smad3 and Smad7 on CCl4-inducing rat hepatic fibrogenesis. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1132-1135
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1132.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1132
局部肾素-血管紧张素系统(renin-angiotensin system, RAS)可促进损伤组织修复和纤维化. 心, 肾及肝中的RAS有促纤维化作用[1-3]. RAS的这种促纤维化作用主要由多细胞产生并具多功能的转化生长因子b1(transforming growth factorbeta1, TGFb1)介导. RAS中首要效应器分子血管紧张素Ⅱ(angiotensin Ⅱ, AngⅡ)可增强TGFb1的作用[4-6], 并刺激肝星状细胞(hepatic stellate cells, HSC) 增生和肝内细胞外基质(extracellular matrix, ECM)形成. 肝内TGFb1与其受体结合后, 再由Smad蛋白传导TGFb1的信号至细胞内发挥作用[7-8], TGFb1在肝纤维形成中起着重要作用[9-10]. 既往研究已经证实ACEI具有抗肝纤维化作用, 但其机制不甚明了. 我们研究血管紧张素转换酶抑制剂(angiotensin-converting enzyme inhibitor, ACEI)培哚普利(perindopril)对TGFb1信号转导各阶段的影响, 探索培哚普利抗实验性肝纤维化的可能作用机制.
Wistar大鼠80只, 雌雄各半, 180-220 g, 6-8周龄, 武汉大学人民医院实验动物中心提供, 饲养期间, 动物自由进食饮水.四氯化碳(carbon tetrachloride, CCl4)分析纯购自武汉亚法生物技术有限公司, 以食用色拉油配制成400 mL/L溶液. 培哚普利(perindopril)由法国施维雅公司(Les Laboratoires Servier)提供. Catrimox-14TM RNA提取试剂盒, AMV逆转录酶, Taq DNA聚合酶, dNTP混合物, DL2000 Marker等均为Takara公司产品.引物委托大连Takara公司合成. (1)TGFb1: 正义序列 5'-TGAGTGGCTGTCTTTTGACG -3', 反义序列5'-ACTTCCAACC CAGGTCCTTC -3', 产物350 bp; (2)TGFRⅡ: 正义序列5'-CTACAAGGCC AAGCTGAAGC-3', 反义序列5'-AGCCATGGAGTAGACATCCG-3', 产物580 bp; (2)GAPDH: 正义序列5'-TCCCTCA ACATTGTCAGCAA-3', 反义序列5'-AGCTCCACAACGGATACATT- 3', 产物309 bp. 抗Smad3, 抗Smad7多克隆抗体为美国Santa Cruza公司产品.即用型S-P试剂盒为福州迈新生物技术开发公司产品.
肝纤维化大鼠模型制作参照Wang et al[11]方法略加改进. 大鼠随机分为5组: A组为正常对照组, B组为肝纤维化模型1组, C组为肝纤维化模型2组, D组为培哚普利治疗1组, E组为培哚普利治疗2组, 每组各有大鼠16只. 除A组外, 各组大鼠按3 mL/kg sc 400 mL/L CCl4, A组予以生理盐水3 mL/kg sc, 2次/wk, 共8 wk. D, E组分别于造模4, 8 wk开始培哚普利5 mg/kg, 加入生理盐水ig, 1次/d, 共用药各8 wk. A, B, D组大鼠于8 wk处死. C, E组大鼠于12 wk处死, 分离血清-20 ℃冰箱保存; 剖腹取部分肝左叶组织分别用40 g/L中性甲醛及25 g/L戊二醛固定, 其余肝组织-70 ℃冰箱保存.
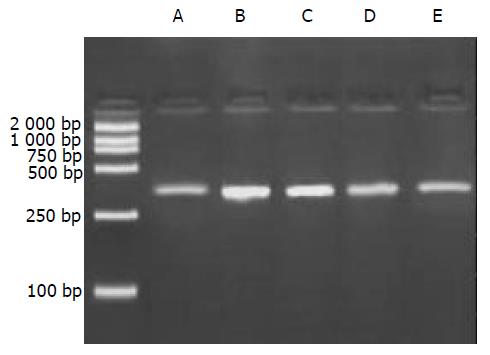
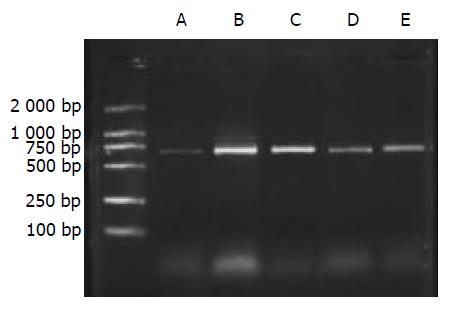
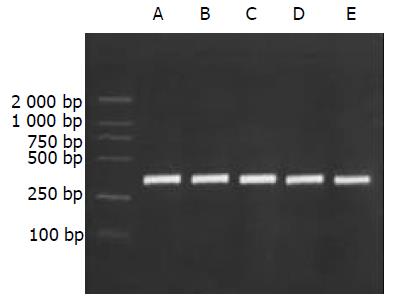
1.2.1 肝组织总RNA提取及RT-PCR反应: 抽提肝组织总RNA按照Catrimox-14TM RNA提取试剂盒说明书操作, 测定样品A268nm/A280nm比值1.6-1.8时提取RNA纯度较好. 逆转录反应: 无菌0.2 mL的Eppendorf管中加入总RNA 1 mg, Random primer (50 mmoL/L) 1 mL, Ribonaclease inhibitor (40 MU/L) 1 mL, dNTP (2.5 mmoL/L) 4 mL, MgCl2 (25 mmmoL/L) 1.5 mL, AMV (5MU/L) 1 mL, 5×AMV buffer 4 mL加DEPC处理的dd H2O 至20 mL.反应条件为42 ℃ 1 h, 95 ℃ 5 min. PCR扩增: 在无菌0.2 mL的Eppendorf管中加入: 10×Buffer 5 mL, dNTP (2.5 mmmoL/L) 4 mL, 正,反义引物(30 mmoL/mL)各1 mL, cDNA 4 mL, Taq DNA聚合酶0.5 mL, 加无菌dd H2O至50 mL, 最后加石蜡油40 mL. 扩增条件: 94 ℃ 5 min, 1个循环; 94 ℃ 1 min, 55 ℃ 1 min, 72 ℃1 min, 共30个循环; 72 ℃ 10 min, 1个循环. 取PCR产物10 mL进行20 g/L琼脂糖凝胶电泳, 拍照后进行扫描测定灰度值, 将目的mRNA与GAPDH的RT-PCR产物的灰度值比值作为目的mRNA相对表达量.
1.2.2 免疫组织化学法检测大鼠肝组织Smad3和Smad7表达: 具体步骤参照SP试剂盒说明书进行. 抗Smad3和抗Smad7多克隆抗体稀释度均为1:100. PBS代替一抗作阴性对照. 光学显微镜下观察, 阳性组织呈棕黄色, 阴性部分呈蓝色. 随机选取每张切片10个视野(×400倍)测定阳性细胞的A值与所占视野面积, 取其乘积平均值为该组织切片所得值, 两项乘积越大表明组织中该抗原含量越高.
1.2.3 肝组织病理形态学观察: HE染色光镜下观察肝组织炎症与纤维化程度. 肝纤维化积分参照《肝纤维化诊断及诊疗评估共识》[12]. 电镜观察大鼠肝脏超微结构变化.
统计学处理 各组计量资料以均数±标准差(mean±SD)表示, 数据呈正态分布采用SPSS统计软件(11.0版)进行单因素组间方差分析.
A组大鼠肝脏仅微弱表达, B, C组模型大鼠肝组织内高表达, 两组表达相对含量无明显差别(P>0.05). D, E组显示缬沙坦对TGFb1与TGFRⅡ mRNA有较强抑制作用, 两种物质在肝内表达减弱, D组两种物质表达相对含量少于E组(P<0.05).见(表1, 图1-3).
| 分组 | n | TGFb1 mRNA | TGFR2 mRNA | Smad3 | Smad7 | 炎症坏死积分 | 纤维化积分 |
| A | 16 | 0.40±0.06 | 0.28±0.03 | 0.248±0.042 | 4.674±1.143 | 0 | 0 |
| B | 11 | 1.41±0.09b | 1.27±0.08b | 0.785±0.904b | 0.414±0.085b | 5.3±1.3 | 7.4±1.6 |
| C | 12 | 1.39±0.05b | 1.31±0.08b | 0.815±0.677b | 0.481±0.104b | 4.9±1.3 | 7.0±1.6 |
| D | 14 | 0.59±0.05d | 0.46±0.03bd | 0.279±0.085d | 2.137±1.011d | 3.2±1.0b | 4.4±1.3b |
| E | 13 | 0.693±0.057bfg | 0.563±0.045bfg | 0.323±0.094fg | 1.674±1.015fg | 3.8±1.0ce | 5.5±1.5de |
Smad3与Smad7表达阳性物质主要集中在胞质内, 胞膜上也有少量表达.A组在正常肝细胞内未见Smad3表达, 汇管区基质及间质细胞胞质内少量表达; Smad7在肝细胞胞质内强烈表达, 部分肝细胞核膜也有表达, 在汇管区未见明显表达. B, C组肝内Smad3表达明显增强, 主要见于小叶周围扩大的纤维组织内的成纤维细胞, 窦周细胞, 炎性细胞以及增生的胆小管周围梭状细胞内, 肝细胞内无表达; Smad7表达极少, 集中在少数肝细胞及纤维间隔梭状细胞胞质内, 阳性细胞着色浅淡. 两种物质在B, C组表达量无明显差别; D, E组肝组织: Smad3表达量减少, 接近正常肝组织水平, 阳性表达集中在汇管区,间质细胞和炎性细胞胞质内; Smad7在肝细胞胞质内的表达强烈, 汇管区及纤维组织内表达较少, 二组阳性程度强于B, C组, D组表达量与E组比较差异有显著性(P<0.05). (见表1).
光镜下A组肝脏肝小叶结构正常, 肝细胞索排列规则有序, 肝窦与汇管区成纤维细胞少; B,C组正常肝小叶结构紊乱, 肝细胞坏死分布不规则, 部分肝细胞呈脂肪变性, 可见嗜酸性小体, 中央静脉偏位,缺如或二个以上, 肝细胞索失去放射状肝索结构, 间质中有炎性细胞浸润, 坏死区及汇管区纤维结缔组织增生形成细小的条索, 纤维宽窄不一, 呈星芒状向肝小叶内延伸; D,E组肝细胞坏死,纤维组织增生减少, 肝小叶结构较为正常, 肝内炎症细胞减少, 接近正常肝组织.见表1. 电镜下A组大鼠肝细胞结构完整, Disse间隙内可见富含脂滴的HSC, 内皮细胞窗孔丰富, 内皮细胞外侧未见基底膜存在, 细胞间隙未见明显胶原纤维.模型B, C组大鼠肝内成纤维细胞形成, 细胞间隙增宽, 其间有大量胶原纤维沉积; 肝细胞内线粒体肿胀, 粗面内质网数量减少, 滑面内质网增多; 内皮细胞间窗孔明显减少, 细胞外侧可见基底膜形成.D,E治疗组成纤维细胞减少, 可见含有脂滴的HSC, 肝细胞间胶原纤维明显减少, 线粒体形态基本正常, 内皮细胞间窗孔增多, D组大鼠肝组织细胞间胶原纤维少于E组大鼠, 细胞间隙增宽不明显.
培哚普利可显著减轻肝纤维化大鼠肝脏炎症和纤维化程度, 电镜观察肝组织超微结构显示, 与肝纤维化模型组大鼠对比, 经培哚普利治疗后肝细胞器结构接近正常, 细胞间隙变窄, 其间胶原纤维显著减少, 内皮细胞间窗孔明显增多, 未见到成纤维细胞. 说明培哚普利对CCl4诱导大鼠肝纤维化具有保护肝细胞, 减少胶原纤维形成并在细胞间隙沉积作用, 减轻肝窦毛细血管化, 阻断肝纤维化发生. 既往研究已经证明ACEI具有抗实验性肝纤维化作用[1,6,13], 该类药物可降低肝纤维化动物血清羟脯氨酸酶, 胶原含量, 通过蛋白激酶C抑制TIMP-1表达, 减少a-平滑肌肌动蛋白在HSC的表达, 本实验结果与之吻合.
慢性肝病时血液循环中AngⅡ增多, HSC能表达AngⅡ的Ⅰ型受体(AngⅡreceptor typeⅠ, AT1R)[14], 外源性AngⅡ通过AT1R能促进HSC分裂增生和胶原合成[15-16], 上调大鼠原代HSC内TGFb1[17]. HSC能通过自分泌与旁分泌作用正反馈增加TGFb1合成分泌[18-19], TGFb1又正反馈刺激HSC活化, 增生并转化为成纤维细胞, 最终大量ECM沉积于肝内, 形成肝纤维化.本结果显示, 肝纤维化大鼠肝组织内TGFb1及TGFRⅡ mRNA表达明显上升, 而经过培哚普利治疗大鼠肝组织内这两种物质表达明显减少, 说明培哚普利使肝纤维化大鼠TGFb1与其受体结合受阻, TGFb1信号下传在其受体水平上首先被抑制. 我们发现在CCl4致肝纤维化过程中, 早期应用培哚普利防治肝纤维化的作用明显优于晚期治疗组, 并接近于正常组, 说明早期给与ACEI培哚普利抑制Ang Ⅱ生成, 可以早期阻止HSC活化分泌TGFb1与TGFRⅡ, 并早期阻断二者结合. 基因转导Smad7可抑制实验性小鼠肝纤维化, Smad7通过活化的TGFb受体, 封锁TGFb1 信号转导, 抑制Smad2/3磷酸化和活化的Smad复合物向核内易位, 最终降低Ⅰ型胶原表达, 消除HSC的TGFb1 依赖增生抑制作用. TGFb可快速诱导Smad7 mRNA表达, Smad7参与调控TGFb反应的负反馈环路, 但在肝纤维化大鼠中中未见到TGFb诱导性Smad7上调, 而Smad3 mRNA则有增加. 而Smad3与HSC中的TGFb反应元件相连接, 刺激aⅠ型胶原与Ⅰ型纤溶酶原激活物抑制因子(plasminogen activator inhibitor-1, PAI-1)基因转录, 与Smad2不同的是, 这种作用不受Smad7过表达的抑制. 我们研究发现, 肝纤维化大鼠经培哚普利治疗后, 在TGFb1重要的下游信号通道蛋白Smad中, 对TGFb1具有正反馈作用的Smad3表达显著减少, 而具有负反馈作用的Smad7表达显著增多, 培哚普利早期治疗组对肝纤维化大鼠肝组织Smad作用强于晚期治疗组. 即使大鼠仍不断受到CCl4促纤维化刺激作用下, ACEI不但使纤维化大鼠肝组织内TGFb1及其Ⅱ型受体的合成, 结合受到抑制, 且作用于TGFb1细胞内信号通道蛋白, 促进抑制型Smad7合成, 降低途径限制型Smad3合成, 在多水平阻止TGFb1发挥病理作用, 以抑制HSC活化转化为成纤维细胞, 减少ECM减轻肝纤维化程度. 证实ACEI培哚普利具有抗试验性大鼠肝纤维化作用, 该药可改善肝组织细胞结构, 通过抑制TGFb1和TGFRⅡ受体mRNA表达, 肝内TGFb下游信号通道蛋白Smad3与Smad7削弱TGFb的信号传导通路, 从而抑制CCl4诱导的大鼠肝纤维化程度. 由于病毒性肝炎及肝纤维化在我国是较严重的问题[15-16], 本课题须待进一步研究.
| 1. | Border WA, Noble N. Maximizing hemodynamic-independent effects of angiotensin II antagonists in fibrotic diseases. Semin Nephrol. 2001;21:563-572. [PubMed] [DOI] |
| 2. | Reaves PY, Gelband CH, Wang H, Yang H, Lu D, Berecek KH, Katovich MJ, Raizada MK. Permanent cardiovascular protection from hypertension by the AT(1) receptor antisense gene therapy in hypertensive rat offspring. Circ Res. 1999;85:e44-e50. [PubMed] [DOI] |
| 3. | Bader M. Molecular interactions of vasoactive systems in cardiovascular damage. J Cardiovasc Pharmacol. 2001;38 Suppl 2:S7-S9. [PubMed] [DOI] |
| 4. | Powell EE, Edwards-Smith CJ, Hay JL, Clouston AD, Crawford DH, Shorthouse C, Purdie DM, Jonsson JR. Host genetic factors influence disease progression in chronic hepatitis C. Hepatology. 2000;31:828-833. [PubMed] [DOI] |
| 5. | Paizis G, Gilbert RE, Cooper ME, Murthi P, Schembri JM, Wu LL, Rumble JR, Kelly DJ, Tikellis C, Cox A. Effect of angiotensin II type 1 receptor blockade on experimental hepatic fibrogenesis. J Hepatol. 2001;35:376-385. [PubMed] [DOI] |
| 6. | Yoshiji H, Kuriyama S, Fukui H. Angiotensin-I-converting enzyme inhibitors may be an alternative anti-angiogenic strategy in the treatment of liver fibrosis and hepatocellular carcinoma. Possible role of vascular endothelial growth factor. Tumour Biol. 2002;23:348-356. [PubMed] [DOI] |
| 7. | Blobe GC, Schiemann WP, Pepin MC, Beauchemin M, Moustakas A, Lodish HF, O'Connor-McCourt MD. Functional roles for the cytoplasmic domain of the type III transforming growth factor beta receptor in regulating transforming growth factor beta signaling. J Biol Chem. 2001;276:24627-24637. [PubMed] [DOI] |
| 8. | Fortuno ES 3rd, LeSueur JA, Graff JM. The amino terminus of Smads permits transcriptional specificity. Dev Biol. 2001;230:110-124. [PubMed] [DOI] |
| 9. | Yang C, Zeisberg M, Mosterman B, Sudhakar A, Yerramalla U, Holthaus K, Xu L, Eng F, Afdhal N, Kalluri R. Liver fibrosis: insights into migration of hepatic stellate cells in response to extracellular matrix and growth factors. Gastroenterology. 2003;124:147-159. [PubMed] [DOI] |
| 10. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 11. | Wang YQ, Ikeda K, Ikebe T, Hirakawa K, Sowa M, Nakatani K, Kawada N, Kaneda K. Inhibition of hepatic stellate cell proliferation and activation by the semisynthetic analogue of fumagillin TNP-470 in rats. Hepatology. 2000;32:980-989. [PubMed] [DOI] |
| 13. | Yoshiji H, Yoshii J, Ikenaka Y, Noguchi R, Tsujinoue H, Nakatani T, Imazu H, Yanase K, Kuriyama S, Fukui H. Inhibition of renin-angiotensin system attenuates liver enzyme-altered preneoplastic lesions and fibrosis development in rats. J Hepatol. 2002;37:22-30. [PubMed] [DOI] |
| 14. | Bataller R, Ginès P, Nicolás JM, Görbig MN, Garcia-Ramallo E, Gasull X, Bosch J, Arroyo V, Rodés J. Angiotensin II induces contraction and proliferation of human hepatic stellate cells. Gastroenterology. 2000;118:1149-1156. [PubMed] [DOI] |
| 15. | Wei HS, Li DG, Lu HM, Zhan YT, Wang ZR, Huang X, Zhang J, Cheng JL, Xu QF. Effects of AT1 receptor antagonist, losartan, on rat hepatic fibrosis induced by CCl(4). World J Gastroenterol. 2000;6:540-545. [PubMed] [DOI] |
| 16. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Fukui H. Angiotensin-II type 1 receptor interaction is a major regulator for liver fibrosis development in rats. Hepatology. 2001;34:745-750. [PubMed] [DOI] |
| 17. | Kurikawa N, Suga M, Kuroda S, Yamada K, Ishikawa H. An angiotensin II type 1 receptor antagonist, olmesartan medoxomil, improves experimental liver fibrosis by suppression of proliferation and collagen synthesis in activated hepatic stellate cells. Br J Pharmacol. 2003;139:1085-1094. [PubMed] [DOI] |
| 18. | Okuno M, Akita K, Moriwaki H, Kawada N, Ikeda K, Kaneda K, Suzuki Y, Kojima S. Prevention of rat hepatic fibrosis by the protease inhibitor, camostat mesilate, via reduced generation of active TGF-beta. Gastroenterology. 2001;120:1784-1800. [PubMed] [DOI] |