修回日期: 2004-01-09
接受日期: 2004-02-01
在线出版日期: 2004-05-15
目的: 利用原代培养的大鼠肝细胞与骨髓间质干细胞共同培养, 研究骨髓间质干细胞对肝细胞功能的影响, 以便更好用于肝细胞移植及生物人工肝.
方法: 采用低浓度胶原酶原位循环灌流法分离大鼠肝细胞, 获得有活性的肝细胞进行原代培养. 台盼蓝排斥法计算细胞产量和细胞活性; 光镜下动态观察细胞形态学改变, 并收集不同时期培养上清检测其细胞分泌等功能. 比较肝细胞单纯培养及其与骨髓间质干细胞共同培养时细胞的功能.
结果: 培养7 d时两组均仍然维持白蛋白分泌及尿素合成功能; 共同培养组与单纯肝细胞培养组在白蛋白分泌 (13.75>2.179, P<0.05) 及尿素合成功能 (7.27>2.179, P<0.05) 存在显著性差异, 共同培养组明显高于单纯培养组.
结论: 肝细胞与骨髓间质干细胞共同培养, 可以使肝细胞维持特异性功能, 提高肝细胞活性.
引文著录: 黄艳欣, 杜雅菊, 李宝杰. 肝细胞与骨髓间质干细胞共同培养时的肝细胞功能. 世界华人消化杂志 2004; 12(5): 1129-1131
Revised: January 9, 2004
Accepted: February 1, 2004
Published online: May 15, 2004
AIM: To study of the effect on the function of rat hepatocytes cultured with bone marrow cells.
METHODS: Rat hepatocytes were isolated by the modified two-step method described by Seglen. The primary cultured hepatocytes and bone marrow cells were served as cocultured group, and single cultured hepatocytes as control group. The yield and viability were assessed by trypan blue exclusion. The morphologic changes of cultured hepatocytes were observed. The concentrations of albumin and urea in the supernatant in different cultural period were examined.
RESULTS: The albumin synthesis (13.75 > 2.179, P < 0.05) and urea level (7.27 > 2.179, P < 0.05) had fluctuating changes in one week, and cocultured group had higher albumin synthesis and urea level.
CONCLUSION: Cocultured hepatocytes with bone marrow cells can improve the function of hepatocytes.
- Citation: Huang YX, Du YJ, Li BJ. Effect on function of rat hepatocytes cultured with bone marrow cells. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1129-1131
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1129.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1129
各种重型肝炎和晚期肝硬化患者的主要死因是肝功能衰竭[1-3]. 目前肝细胞移植和生物人工肝是较为有前景的治疗方法[4-10]. 研究表明, 原代肝细胞仍然是其最理想的生物材料[11-12]. 但肝细胞由于组织分化程度高, 体外几乎不发生增生分裂, 传代极为困难. 因此长期以来, 为尽可能的延长原代肝细胞的生存时间, 研究者进行了不懈的探索. 国外有人开始尝试将肝细胞与骨髓间质干细胞共同培养, 但国内未见报道. 我们应用原位胶原酶灌注法分离大鼠肝细胞, 获得有活性的肝细胞, 并将肝实质细胞与骨髓间质干细胞共同培养, 采用白蛋白和尿素合成作为指标, 与单纯肝细胞培养进行比较研究, 以期望找到能使肝细胞在体外大量长期存活并保持良好功能的培养方法.
♀3月龄Wistar 大鼠, 质量150-200 g由哈尔滨医科大学二院动物实验中心提供. 胎牛血清、DMEM培养基、胶原酶溶液Ⅳ、胰蛋白酶(Oifco)、EDTA(Amres10)购于Gibco公司. 0.22 mm针头滤器(Millipore), Millex-GP 50 mL塑料培养瓶(Orange Scientific). 肝脏灌洗液为D-Hanks液, 肝脏消化液为用Hanks液配制的0.3 g/L Ⅳ胶原酶溶液. 配制2.5 g/L胰蛋白酶-0.2 g/L EDTA溶液用以消化传代骨髓间质干细胞.
取3月龄Wistar♀大鼠, 麻醉消毒后取得大鼠的骨髓细胞置入培养瓶中, 1 d后首次进行换液, 后每3 d换液1次. 待原代培养的细胞增生到85%时, 用相应的消化液进行消化, 使之成为单细胞悬液. 收集细胞, 离心去上清. 按1:2或1:3分配传代培养, 传代的骨髓间质干细胞以备共同培养之用. 以低浓度胶原酶原位循环灌流法分离获得肝细胞悬液. 将分离的肝细胞悬液经离心提纯后加入肝细胞培养液DMEM, 将肝细胞密度调整为4×108/L . 将第二代的骨髓间质干细胞经消化提纯后, 调节细胞密度为1×108/L.取肝细胞与骨髓间质干细胞共同放入培养瓶中, 于培养箱中培养. 单纯肝细胞培养组. 两组都于接种24 h后, 换液并继续培养, 此后每24 h更换1次培养液. 采用台盼蓝排斥法测定肝实质细胞活性, 显微镜下计数200个细胞, 测得细胞活性率. 光镜观察下对培养中的肝细胞进行形态观察并照相纪录. 白蛋白及尿素合成功能检测, 用Beckman全自动生化分析仪测定肝细胞培养各次换液时所取上清液中白蛋白及尿素含量.
统计学处理 所有数据用均值±标准差表示, 采用对资料t检验进行数据处理, 以P<0.05作为显著性界限, 利用SPSS8.0软件进行处理.
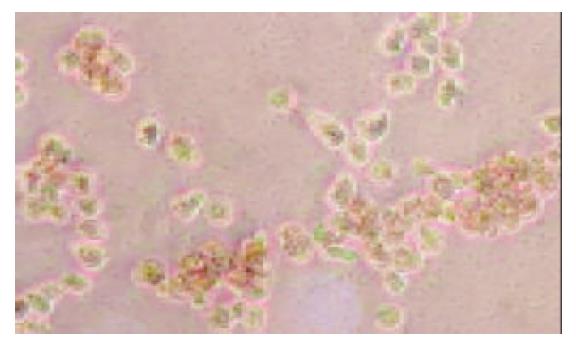
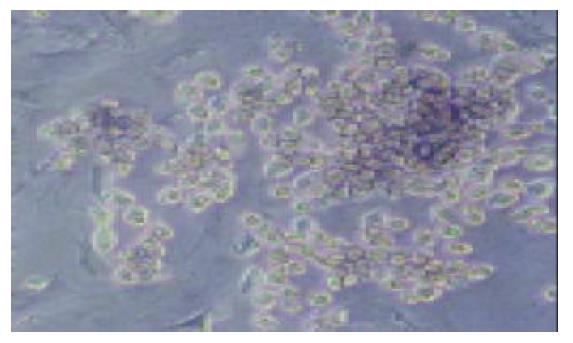
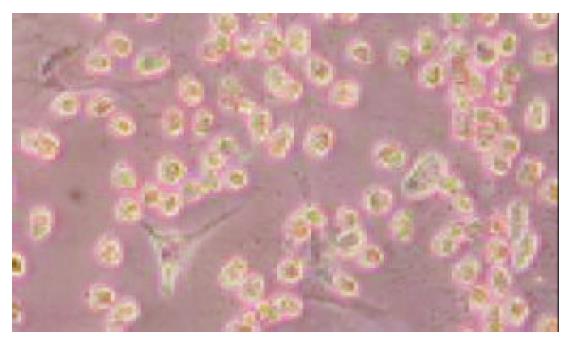
平均每只鼠肝可获取1.20×108个肝细胞, 平均细胞活力92.6%. 在倒置相差显微镜下观察, 可见新鲜分离的离体肝细胞为透亮的圆形细胞, 培养24 h后大部分肝细胞贴壁, 呈典型的上皮细胞样的多角形形态, 少数活力差的细胞悬浮于培养液中, 换液时可以去除. 培养2 d后, 单纯肝细胞培养组中肝细胞黏附于培养瓶壁, 相互融合, 连接成岛状或条索状(图1); 肝细胞与骨髓间质干细胞共同培养组中, 有部分肝细胞呈岛状或条索状排列生长, 另有大部分肝细胞被分散的骨髓间质干细胞包围(图2)或以骨髓间质干细胞为中心成片生长(图3). 培养3 d后肝细胞开始增生, 在老的肝细胞周围出现少数透明的, 体积较小的上皮样细胞. 培养6 d时, 单纯培养的肝细胞部分开始颜色变深, 颗粒增粗, 细胞膜破损, 细胞器流出细胞之外, 细胞开始脱壁. 而共同培养组, 只有少数肝细胞直接黏附于瓶壁之上的肝细胞出现同样的改变, 多数肝细胞黏附甚至埋于骨髓间质干细胞所分泌的胶原中, 仍成片生长.
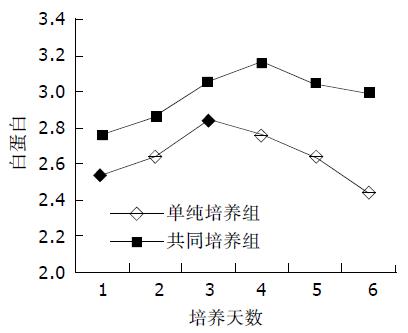
单纯肝细胞培养组与共同培养组不同培养时间各组内白蛋白的含量存在显著差异(P<0.05). 从白蛋白分泌的时效曲线分析(图4), 单纯培养组中成年大鼠肝细胞在培养3 d时达到峰值, 其后逐渐下降, 于6 d开始下降较为明显. 而共同培养组4 d达到峰值, 其后呈下降趋势, 于5 d开始进入平台期(表1). 开始二者均呈递增趋势, 共同培养组峰值较单纯培养组高; 其后二者均呈下降趋势, 共同培养组呈现出平台期, 而单纯培养组则下降得更快一些. 培养上清液中尿素含量肝细胞单纯培养组与共同培养组存在显著性差异(P<0.05), 二者尿素合成均逐渐减少, 单纯培养组尿素由1.33±0.05 mmoL/L下降到0.51±0.03 mmoL/L, 共同培养组由1.51±0.04 mmoL/L下降到0.67±0.03 mmoL/L, 单纯培养组较共同培养下降迅速(表2).
近年应用肝细胞移植和生物人工肝治疗肝衰竭有了很大的发展. 但无论是肝细胞移植还是生物人工肝, 其支持作用都源于肝细胞良好的生物代谢功能. 理想的肝细胞应该是在培养环境中, 持续大量增生分化, 并且保持较高生物活性, 保持肝细胞的全部功能, 包括合成蛋白、保持酶的活性、代谢毒物、合成尿素等. 为了达到以上目标, 研究者在改进细胞分离及培养方法上进行了不懈的探索.
到目前为止, 我们所选用的胶原酶消化法, 尤其是Seglen的改良二步胶原酶灌注法分离肝细胞, 是目前最常用的细胞分离方法, 肝细胞产量可达到75-85%, 分离肝细胞活率可达90%以上. 虽然培养方法不断改进, 但都不能使细胞充分扩增, 且细胞功能衰退较快. 近来, 人们研究发现肝细胞和非实质细胞共同培养, 可以更加充分模拟肝细胞在体内的生存环境, 延长肝细胞生存时间, 使肝细胞保持其特有功能. 骨髓间质干细胞是一种具有多种分化潜能的细胞, 既容易获得又易于在体外扩增, 并且已经有研究表明在肝细胞生长因子的作用下骨髓间质干细胞可以转化为肝细胞, 所以我们选用骨髓间质干细胞和肝细胞共同培养, 以初步探讨骨髓间质干细胞对肝细胞体外培养中生物性状的影响. 结果显示, 共同培养的肝细胞比单纯培养的生存时间有所延长, 生物活性更稳定. 这其中可能有多种原因: 骨髓间质干细胞可以产生各种促分裂素和促肝细胞生长因子(HGF), 这可能是骨髓间质干细胞促进肝细胞增生分裂的主要原因, 但是否有部分骨髓间质干细胞转化成肝细胞并具有一定的肝细胞的功能还值得进一步探讨.因为肝细胞是一种"抛锚"生长的细胞, 生长时需要基质支撑, 才能保持其正常的生长和分化; 而在试验中观察到, 骨髓间质干细胞分泌大量胶原, 有试验表明骨髓间质干细胞可以合成细胞外基质, 包括I型胶原、纤维结合素、IV型胶原及基底膜的层粘连蛋白, 形成集中的网状结构, 可更好模拟体内微环境, 维持肝细胞的立体构型. 这可能是共同培养时肝细胞的贴壁数量明显多于单纯培养的原因之一.
总之, 肝细胞与骨髓间质干细胞共同培养, 可以使肝细胞培养7 d时仍然维持特异性功能, 并且可以提高肝细胞活性; 而且培养4 d前后, 共同组的肝细胞处于功能活性的最佳状态, 可望成为应用于临床上肝细胞移植及生物人工肝支持治疗的最佳时机.
| 1. | Sass DA, Shakil AO. Fulminant hepatic failure. Gastroenterol Clin North Am. 2003;32:1195-1211. [PubMed] [DOI] |
| 2. | Chung YJ, Lee HJ, Koh YT, Kim SB, Kim SH, Choi SH, Yi NJ, Chang SH, Yang EL, Suh KS. [Isolation and culture of pig hepatocyte in large scale for the application of bioartificial liver system]. Taehan Kan Hakhoe Chi. 2002;8:249-255. [PubMed] |
| 3. | Adham M. Extracorporeal liver support: waiting for the deciding vote. ASAIO J. 2003;49:621-632. [PubMed] [DOI] |
| 4. | Patzer II JF, Lopez RC, Zhu Y, Wang ZF, Mazariegos GV, Fung JJ. Bioartificial liver assist devices in support of patients with liver failure. Hepatobiliary Pancreat Dis Int. 2002;1:18-25. [PubMed] |
| 5. | Fox IJ, Chowdhury JR. Hepatocyte transplantation. Am J Transplant. 2004;4 Suppl 6:7-13. [PubMed] [DOI] |
| 6. | Sen S, Williams R. New liver support devices in acute liver failure: a critical evaluation. Semin Liver Dis. 2003;23:283-294. [PubMed] [DOI] |
| 7. | Di Campli C, Gasbarrini G, Gasbarrini A. Review article: a medicine based on cell transplantation -- is there a future for treating liver diseases? Aliment Pharmacol Ther. 2003;18:473-480. [PubMed] [DOI] |
| 8. | Di Campli C, Nestola M, Piscaglia AC, Santoliquido A, Gasbarrini G, Pola P, Gasbarrini A. Cell-based therapy for liver diseases. Eur Rev Med Pharmacol Sci. 2003;7:41-44. [PubMed] |
| 9. | Suzuki A, Nakauchi H, Taniguchi H. In vitro production of functionally mature hepatocytes from prospectively isolated hepatic stem cells. Cell Transplant. 2003;12:469-473. [PubMed] [DOI] |
| 10. | van de Kerkhove MP, Hoekstra R, van Gulik TM, Chamuleau RA. Large animal models of fulminant hepatic failure in artificial and bioartificial liver support research. Biomaterials. 2004;25:1613-1625. [PubMed] [DOI] |
| 11. | Tsiaoussis J, Newsome PN, Nelson LJ, Hayes PC, Plevris JN. Which hepatocyte will it be? Hepatocyte choice for bioartificial liver support systems. Liver Transpl. 2001;7:2-10. [PubMed] [DOI] |