修回日期: 2003-12-19
接受日期: 2004-01-08
在线出版日期: 2004-05-15
目的: 构建含HBV PreS2S 和Fc融合基因的真核表达载体pcDNA3 S2S/Fc并在真核细胞中进行表达.
方法: 应用重叠延伸剪切技术(splicing by overlapping extension, 简称SOE)经两次PCR获得嵌合基因片段S2S/Fc, 回收后克隆到pGEM-T Easy TA克隆载体, 获得合适的酶切位点, 再采用双粘端连接法转克隆入真核表达载体pcDNA3中, 得到真核重组载体pcDNA3 S2S/Fc. 然后用脂质体法转染SP2/0细胞.
结果: 对重组载体进行了限制性酶切鉴定及测序分析, 证明连接正确; 经间接免疫荧光检测证实该重组载体能在真核细胞中表达插入的外源性基因编码的融合蛋白.
结论: 真核表达载体pcDNA3 S2S/Fc的成功构建及在SP2/0细胞中的有效表达, 为进一步探讨HBV感染的特异性免疫治疗提供了实验依据.
引文著录: 陈红梅, 白雪帆, 黄长形, 李光玉, 洪沙. HBV PreS2S/Fc融合基因真核表达载体的构建及表达. 世界华人消化杂志 2004; 12(5): 1081-1084
Revised: December 19, 2003
Accepted: January 8, 2004
Published online: May 15, 2004
AIM: To construct and express a recombinant eukaryotic expression vector bearing fusion gene of HBV S2S and Fc fragment.
METHODS: The technique of splicing by overlapping extension and twice PCR were used, and fusion gene fragment was obtained and cloned into pGEM-T Easy TA cloning vector to get suited enzyme sites. Recombinant eukaryotic expression vector pcDNA3 S2S/Fc was constructed by double adhesive terminal ligation. Then the recombinant vector was transferred into SP2/0 cells by using Lipofectamine.
RESULTS: The recombinant vector was identified by digestion with restriction enzymes and confirmed by DNA sequencing analysis. And the vector bearing fusion gene could be expressed in eukaryotic cells detected by indirect immunofluotescence technique.
CONCLUSION: The relative efficient expression of the fusion gene in SP2/0 cells may provide an experimental basis for specific immunotherapy for HBV infection.
- Citation: Chen HM, Bai XF, Huang CX, Li GY, Hong S. Construction and expression of eukaryotic vector bearing fusion gene of HBV PreS2S and Fc fragment. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1081-1084
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1081.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1081
乙型病毒性肝炎是一种发病率高、严重危害人类健康的传染病[1-10]. 25%的慢性乙肝患者可发展为肝硬化和肝细胞癌[11-15], 至今尚无一种真正有效的治疗药物[16]. 目前, 基因免疫在流感、艾滋病、乙丙型肝炎[17-18]等感染性疾病的治疗研究中呈现出广阔的应用前景. 体内外实验表明基因疫苗可以同时诱导针对病原的体液和细胞免疫反应. 已知乙型肝炎病毒(HBV)是嗜肝DNA病毒, 其包膜蛋白由HBsAg, preS1Ag和preS2Ag组成, 中和表位位于S区. preS1Ag和preS2Ag也均含有T细胞和B细胞表位, 可增强S抗原的免疫原性[19]. 而免疫球蛋白的Fc片段可以通过受体途径提高抗原的提呈效率[20]. 因此, 我们采用分子克隆技术, 将HBV preS2+S基因与Fc基因重组成融合基因, 构建了真核表达载体pcDNA3 S2S/Fc, 以期通过表达的融合蛋白发挥二者的协同作用, 增强基因疫苗诱导的免疫反应.
含有人Fc 片段编码基因的pCMVsFc质粒由陈思毅教授(J Immunol 2000;165(8):4581-91)惠赠. 含HBV全基因的质粒p1.2 II载体质粒pcDNA3及SP2/0细胞由本室保存. 高保真polybest DNA聚合酶购自TaKaRa公司. 各种限制性内切酶, Taq DNA 聚合酶, WizardTM PCR Preps DNA Purification System和pGEM-T Easy Vector Systems 均购自Promega 公司. 小提质粒试剂盒购自华舜公司. 脂质体转染试剂盒LipofectamineTM2000 Reagent 购自GIBCO 公司. 人抗HBsAg购自上海生物制品研究所, 小鼠抗人Fc为第四军医大学免疫学教研室产品. FITC标记山羊抗鼠IgG、兔抗人IgG均为北京中山生物技术有限公司进口分装试剂. 胰蛋白胨、酵母提取物为英国Oxford产品. 其余生化试剂均为常规分析纯的进口或国产试剂. RPMI1640和DMEM培养基, 均购自GIBCO公司.胎牛血清购自杭州四季青生物制品公司.
真核表达载体pcDNA3 S2S/Fc的构建参照文献(J Exp Med 1992;175:495-502), 用重叠延伸剪接术(splicing by overlap extention, SOE)经两次PCR获得嵌和基因片段S2S/Fc, 回收后, 克隆入pGEM-T Easy TA 克隆载体, 转化大肠杆菌JM109, 挑选阳性克隆酶切鉴定后, 酶切目的片段转克隆入真核表达载体pcDNA3中. 根据HBV-adr亚型中国株基因序列和Fc基因序列合成并纯化4条引物, 引物由上海基康和Takara生物技术有限公司合成. 引物序列如下: 上游引物F: 5'-CGGAAGCTTA TGCAGTGGAA CTCCACAAC-3' 中间引物M1: 5'-GCATGTGTGA GTTTTAATGT ATACCCAAAG-3'; 中间引物M2: 5'-CTTTGGGTAT ACATTAAAAC TCACACATGC-3'; 下游引物R: 5'-TATTATCATT TACCCGGAGA CAG-3'. F为HBV preS2S基因的上游引物, 引入HindⅢ酶切位点;中间引物M1和M2是完全互补的, 分别含HBV S基因C端15 bp (2 639 nt-2 653 nt)和Fc N端去掉起始码和信号肽后的15 bp, 共30 bp的序列; R为Fc 片段的下游引物. 第1次PCR, 以质粒p1.2 II为模板, 用引物F和M1扩增HBV preS2S基因片段(约850 bp). 以质粒pCMVsFc为模板, 用引物M2和R扩增Fc基因片段(634 bp). 反应条件: 94 ℃预变性5 min, 94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸45 s, 35个循环, 最后72 ℃延伸10 min. 用10 g/L琼脂糖凝胶电泳分离上述PCR产物后, 以WizardTM PCR Preps DNA Purification System回收产物. 第2次PCR, 以第1次PCR产物为模板, 各取100 ng, 用引物F和R扩增, 获得基因片段S2S/Fc. 反应条件: 94 ℃预变性5 min, 94 ℃变性45 s, 58 ℃退火1 min, 72 ℃延伸1 min, 35个循环, 最后72 ℃延伸30 min. 回收第2次PCR产物. 目的片段S2S/Fc与pGEM-T Easy TA克隆载体的连接, 按操作说明书进行. 挑取单克隆菌落于3 mL+Amp的LB培养基中, 震荡过夜, 用小提质粒试剂盒提取质粒. 分别用Eco RⅠ进行单、双酶切鉴定插入片段的大小. 将目的片段转克隆入真核表达载体pcDNA3中, 用Hind III和EcoR I双酶切pGEM-T EasyS2S/Fc质粒和载体pcDNA3, 得到目的片段和线形载体, 采用双粘端连接法连接, 转化新鲜的感受态菌JM109. 挑取单克隆菌落于3 mL+Amp的LB培养基中, 震荡过夜, 用小提质粒试剂盒提取质粒. 分别用Hind III和EcoR I+ Hind III进行单、双酶切鉴定. 并送上海生物工程有限公司测序.
1.2.1 pcDNA3 S2S/Fc在SP2/0细胞中的瞬时表达: 用含100 mL/L胎牛血清的DMEM培养基, 于37 ℃, 50 mL/L CO2孵箱中培养. 用小提质粒试剂盒提取质粒. 重组质粒的转染用脂质体介导转染法进行. 按照脂质体转染试剂盒LIPOFECTAMINETM2000 Reagent的操作说明书, (1)将SP2/0细胞接种于25 mL培养瓶内; (2)培养18-24 h, 使处于对数生长期的细胞达90-95%融和; (3)无菌Ep管中制备, 10 mg DNA溶于100 mL无血清、无抗生素的DMEM中; 15 mL Lipofectamine溶于85 mL无血清、无抗生素的DMEM中.将此两溶液在5 min内混合; (4)用无血清、无抗生素的DMEM洗涤细胞2次. 加入1.8 mL无血清、无抗生素的DMEM; (5)将Lipofectamine+DNA混合物200 mL小心滴加至细胞上. (6) 37 ℃, 50 mL/L CO2孵箱中培养4-6 h后, 换为完全培养基继续培养; (7)转染48-72 h内检测重组质粒的表达. (8)同时设置一空白和空载体对照孔.
1.2.2 用间接免疫荧光法检测抗原的表达: 参照实用免疫细胞化学与核酸分子杂交技术(四川科学技术出版社, 1994), (1)将转染细胞悬液滴加至用多聚赖氨酸预处理的载玻片上, 风干后, 置冷丙酮中固定10 min; (2)用pH 7.2的PBS冲洗5 min×2次; (3)滴加含50 mL/L胎牛血清的PBS封闭30 min; (4)分别滴加未标记的第一抗体人抗HBsAg和鼠抗Fc(按1:50稀释)于固定细胞上, 置湿盒中37 ℃作用1 h; (5)用PBS冲洗5 min×3次; (6)分别滴加FITC标记的兔抗人和山羊抗鼠的第二抗体(按1:100稀释), 置37 ℃湿盒中作用1 h; (7)用PBS冲洗5 min×3次; (8)风干后, 用含500 mL/L甘油, 500 mL/L 0.01 moL/L, pH 7.2的PBS溶液封片, 荧光显微镜下观察.
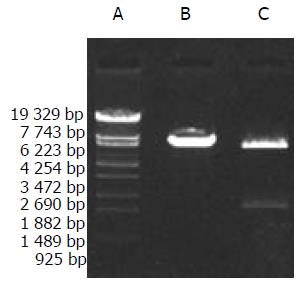
重组质粒分别经HindⅢ和HindⅢ+EcoRⅠ单双酶切, 可见与理论结果一致的6.8 kb, 5.4 kb和1.4 kb的电泳条带(图1), 测序确证.
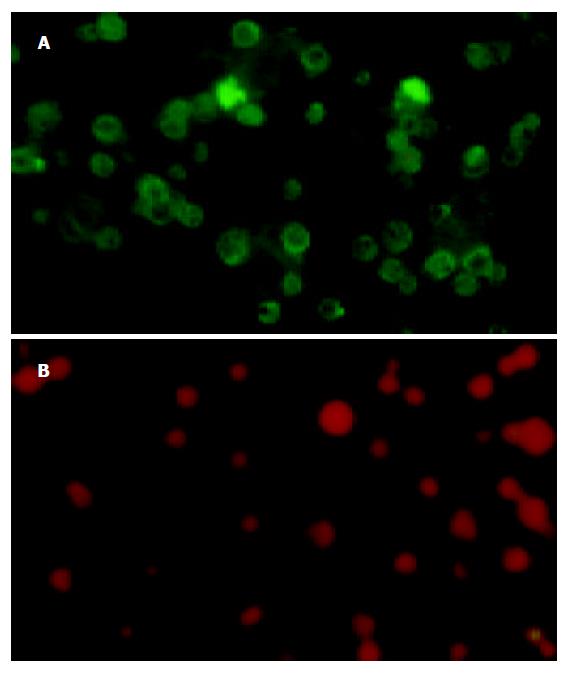
用间接免疫荧光法, 在荧光显微镜下观察到了融合抗原的表达(图2).
HBV S基因含前S1, 前S2和HBsAg基因, 分别编码前S1, 前S2和HBsAg, 他们是HBV包膜的主要成分, 可诱导机体产生相应的抗体, 这些抗体能保护机体免受HBV的感染, 产生保护性免疫. 近年来研究表明, 在HBV感染过程中, 前S2可能起着非常重要的作用. 阻断前S2的作用将可能阻止HBV的感染. 研究表明, 含前S1, 前S2和HBsAg的第三代重组疫苗的免疫原性较强, 能诱导机体产生较高的抗-HBs水平和免疫保护能力[21]. 应用前S2/HIVgp120嵌合基因[22]和前S2/HCV嵌合基因[23]的DNA疫苗可诱导小鼠产生很强的抗-HIV和抗-HCV的体液和细胞免疫反应, 显示前S2可能是一种广谱的免疫佐剂.
DNA疫苗诱导免疫反应的效率相对较低, 尤其是对于大动物种系和人类, 这削弱了他们的实际应用. 尽管花费了相当大的努力来提高DNA疫苗的运输效率, 但在接种DNA疫苗后仅少量抗原能够表达发挥免疫功效. 目前应用的提高和调节DNA疫苗诱导的免疫反应补充策略之一是, 通过与细胞表面受体分子结合的抗原融合将DNA疫苗编码的抗原靶向导入到细胞表面. 通过与MHCII类分子结合将抗原靶向到APCs, 以增强靶向蛋白的免疫原性. 诱导对靶向蛋白的体液免疫反应的水平和反应的速度都能被极大的提高, 尤其是应用低剂量的抗原时[24-30]. 基于以上的研究策略, 我们成功构建了含HBV preS2S与Fc融合基因的真核表达载体pcDNA3 S2S/Fc, 并在SP2/0细胞中进行了有效的表达, 为进一步提高HBV DNA的免疫效果创造了条件.
| 1. | Wang FS. Current status and prospects of studies on human genetic alleles associated with hepatitis B virus infection. World J Gastroenterol. 2003;9:641-644. [PubMed] [DOI] |
| 2. | Tang ZY. Hepatocellular carcinoma--cause, treatment and metastasis. World J Gastroenterol. 2001;7:445-454. [PubMed] [DOI] |
| 3. | Hou CS, Wang GQ, Lu SL, Yue B, Li MR, Wang XY, Yu JW. Role of activation-induced cell death in pathogenesis of patients with chronic hepatitis B. World J Gastroenterol. 2003;9:2356-2358. [PubMed] [DOI] |
| 4. | Wang RX, Boland G, Guo Y, Lei SP, Yang CH, Chen J, Tian J, Wen JY, Du KH, van Hattum J. Is a low dose of hepatitis B vaccine enough for a rapid vaccination scheme? World J Gastroenterol. 2003;9:2353-2355. [PubMed] [DOI] |
| 5. | Bai YJ, Zhao JR, Lv GT, Zhang WH, Wang Y, Yan XJ. Rapid and high throughput detection of HBV YMDD mutants with fluorescence polarization. World J Gastroenterol. 2003;9:2344-2347. [PubMed] [DOI] |
| 6. | Gao PJ, Piao YF, Liu XD, Qu LK, Shi Y, Wang XC, Yang HY. Studies on specific interaction of beta-2-glycoprotein I with HBsAg. World J Gastroenterol. 2003;9:2114-2116. [PubMed] [DOI] |
| 7. | Wang JY, Liu P. Abnormal immunity and gene mutation in patients with severe hepatitis-B. World J Gastroenterol. 2003;9:2009-2011. [PubMed] [DOI] |
| 8. | Wang NS, Wu ZL, Zhang YE, Guo MY, Liao LT. Role of hepatitis B virus infection in pathogenesis of IgA nephropathy. World J Gastroenterol. 2003;9:2004-2008. [PubMed] [DOI] |
| 9. | Li XM, Yang YB, Hou HY, Shi ZJ, Shen HM, Teng BQ, Li AM, Shi MF, Zou L. Interruption of HBV intrauterine transmission: a clinical study. World J Gastroenterol. 2003;9:1501-1503. [PubMed] [DOI] |
| 10. | Chen XS, Wang GJ, Cai X, Yu HY, Hu YP. Inhibition of hepatitis B virus by oxymatrine in vivo. World J Gastroenterol. 2001;7:49-52. [PubMed] [DOI] |
| 11. | Rabe C, Pilz T, Klostermann C, Berna M, Schild HH, Sauerbruch T, Caselmann WH. Clinical characteristics and outcome of a cohort of 101 patients with hepatocellular carcinoma. World J Gastroenterol. 2001;7:208-215. [PubMed] [DOI] |
| 12. | Yang X, Tang XP, Lei JH, Luo HY, Zhang YH. A novel stop codon mutation in HBsAg gene identified in a hepatitis B virus strain associated with cryptogenic cirrhosis. World J Gastroenterol. 2003;9:1516-1520. [PubMed] [DOI] |
| 13. | Shen LJ, Zhang HX, Zhang ZJ, Li JY, Chen MQ, Yang WB, Huang R. Detection of HBV, PCNA and GST-pi in hepatocellular carcinoma and chronic liver diseases. World J Gastroenterol. 2003;9:459-462. [PubMed] [DOI] |
| 14. | Assy N, Paizi M, Gaitini D, Baruch Y, Spira G. Clinical implication of VEGF serum levels in cirrhotic patients with or without portal hypertension. World J Gastroenterol. 1999;5:296-300. [PubMed] |
| 15. | Han LH, Sun WS, Ma CH, Zhang LN, Liu SX, Zhang Q, Gao LF, Chen YH. Detection of soluble TRAIL in HBV infected patients and its clinical implications. World J Gastroenterol. 2002;8:1077-1080. [PubMed] [DOI] |
| 16. | Lu LG, Zeng MD, Mao YM, Li JQ, Wan MB, Li CZ, Chen CW, Fu QC, Wang JY, She WM. Oxymatrine therapy for chronic hepatitis B: a randomized double-blind and placebo-controlled multi-center trial. World J Gastroenterol. 2003;9:2480-2483. [PubMed] |
| 17. | Maier I, Wu GY. Hepatitis C and HIV co-infection: a review. World J Gastroenterol. 2002;8:577-579. [PubMed] [DOI] |
| 18. | Wang QC, Nie QH, Feng ZH. RNA interference: antiviral weapon and beyond. World J Gastroenterol. 2003;9:1657-1661. [PubMed] [DOI] |
| 19. | Shi CH, Cao C, Xhig JS, Li J, Ma QJ. Gene fusion of cholera toxin B subunit and HBV PreS2 epitope and the antigenicity of fusion protein. Vaccine. 1995;13:933-937. [PubMed] [DOI] |
| 20. | You Z, Huang XF, Hester J, Rollins L, Rooney C, Chen SY. Induction of vigorous helper and cytotoxic T cell as well as B cell responses by dendritic cells expressing a modified antigen targeting receptor-mediated internalization pathway. J Immunol. 2000;165:4581-4591. [PubMed] [DOI] |
| 21. | Pride MW, Bailey CR, Muchmore E, Thanavala Y. Evaluation of B and T-cell responses in chimpanzees immunized with Hepagene, a hepatitis B vaccine containing pre-S1, pre-S2 gene products. Vaccine. 1998;16:543-550. [PubMed] [DOI] |
| 22. | Fomsgaard A, Nielsen HV, Bryder K, Nielsen C, Machuca R, Bruun L, Hansen J, Buus S. Improved humoral and cellular immune responses against the gp120 V3 loop of HIV-1 following genetic immunization with a chimeric DNA vaccine encoding the V3 inserted into the hepatitis B surface antigen. Scand J Immunol. 1998;47:289-295. [PubMed] [DOI] |
| 23. | Major ME, Vitvitski L, Mink MA, Schleef M, Whalen RG, Trépo C, Inchauspé G. DNA-based immunization with chimeric vectors for the induction of immune responses against the hepatitis C virus nucleocapsid. J Virol. 1995;69:5798-5805. [PubMed] |
| 24. | Wang H, Griffiths MN, Burton DR, Ghazal P. Rapid antibody responses by low-dose, single-step, dendritic cell-targeted immunization. Proc Natl Acad Sci USA. 2000;97:847-852. [PubMed] [DOI] |
| 25. | Schjetne KW, Gundersen HT, Iversen JG, Thompson KM, Bogen B. Antibody-mediated delivery of antigen to chemokine receptors on antigen-presenting cells results in enhanced CD4+ T cell responses. Eur J Immunol. 2003;33:3101-3108. [PubMed] [DOI] |
| 26. | Robson NC, Beacock-Sharp H, Donachie AM, Mowat AM. The role of antigen-presenting cells and interleukin-12 in the priming of antigen-specific CD4+ T cells by immune stimulating complexes. Immunology. 2003;110:95-104. [PubMed] [DOI] |
| 27. | Creusot RJ, Thomsen LL, Tite JP, Chain BM. Local cooperation dominates over competition between CD4+ T cells of different antigen/MHC specificity. J Immunol. 2003;171:240-246. [PubMed] [DOI] |
| 28. | Storni T, Bachmann MF. On the role of APC-activation for in vitro versus in vivo T cell priming. Cell Immunol. 2003;225:1-11. [PubMed] [DOI] |
| 29. | Preynat-Seauve O, Coudurier S, Favier A, Marche PN, Villiers C. Oxidative stress impairs intracellular events involved in antigen processing and presentation to T cells. Cell Stress Chaperones. 2003;8:162-171. [PubMed] [DOI] |
| 30. | Wauben MH, 't Hoen EN, Taams LS. Modulation of T cell responses after cross-talk between antigen presenting cells and T cells: a give-and-take relationship. Novartis Found Symp. 2003;252:211-220; discussion 220-225, 257-267. [PubMed] [DOI] |