修回日期: 2004-01-09
接受日期: 2004-01-12
在线出版日期: 2004-05-15
目的: 探讨大肠癌组织中血管内皮生长因子-C(VEGF-C)的表达及其与临床病理指标和预后的关系.
方法: 应用免疫组化SP法检测96例大肠癌组织中VEGF-C的表达, 并分析其与大肠癌临床病理指标和预后的关系.
结果: 大肠癌组织VEGF-C阳性率明显高于正常大肠组织(42/96 vs 19/96, P<0.01); 大肠癌VEGF-C表达与大肠癌分化程度、Dukes分期、淋巴结转移及患者预后密切相关(P<0.01或P<0.05), 但是与患者年龄、性别、肿瘤大小、部位、浸润深度以及远处器官转移无关(P>0.05). 41例有淋巴结转移病例的转移灶和原发灶癌组织的VEGF-C表达相当一致(P<0.01).
结论: VEGF-C可能通过诱导淋巴管生成促进大肠癌淋巴结转移, 并且可以作为指导大肠癌治疗和判断预后的一个重要指标.
引文著录: 牟江洪, 阎晓初, 王东, 吴小华, 李增鹏, 向德兵. 大肠癌VEGF-C表达与淋巴结转移和预后的关系. 世界华人消化杂志 2004; 12(5): 1061-1064
Revised: January 9, 2004
Accepted: January 12, 2004
Published online: May 15, 2004
AIM: To explore the expression of endothelial growth factors C (VEGF-C) in large intestine carcinoma, and its relationship to clinicopathological features and prognosis.
METHODS: The expression of VEGF-C in 96 cases of large intestine carcinoma was detected by SP immunohistochemical technique and its relationship to clinicopathological features and prognosis were analysed.
RESULTS: The expression of VEGF-C was significantly higher in intratumoral tissue than that in normal mucosa(42/96 vs 19/96, P < 0.01). VEGF-C positive expression was significantly correlated with tumor differentiation, Dukes' stage, lymph node metastasis and prognosis in 96 cases of large intestine carcinoma (P < 0.01 or P < 0.05), but its relationship to age and gender of patient, size, site and depth of invasion of tumour and organ metastasis was not found (P>0.05). The expression of VEGF-C in metastatic lymph nodes was fairly consistent with that in the primary tumour (P < 0.01).
CONCLUSION: The overexpression of VEGF-C in large intestine carcinoma can develop lymph node metastasis by inducing lymphangiogenesis, and it may serve as one prognostic factor and guide the treatment.
- Citation: Mou JH, Yan XC, Wang D, Wu XH, Li ZP, Xiang DB. Relationship between VEGF-C expression and lymph node metastasis and prognosis in large intestinal carcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1061-1064
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1061.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1061
大肠癌发病率很高[1-10], 并且具有较高的淋巴结转移率[11-14]. 血管内皮生长因子-C(VEGF-C)是第一个被发现的能够诱导淋巴管生成的生长因子, 其在肿瘤生长和转移中的作用已经逐渐引起人们的重视. VEGF-C在大肠癌组织中的表达及其与临床病理指标之间的关系国内尚未见报道, 我们应用免疫组化SP法检测VEGF-C在人大肠癌组织中的表达并探讨其与临床病理指标和预后之间的关系.
大坪医院1996/1998年大肠癌根治术石蜡标本96例, 男50例, 女46例, 年龄22-83(平均53岁, 中位57岁); 术前均未进行任何形式的治疗. 其中有淋巴结转移的41例, 无淋巴结转移的55例; 有远处器官转移的14例, 无远处器官转移的82例. 所有患者均有术后随访记录, 总体随访时间3-83 mo, 总体5年生存率61.5%.
所有标本经40 g/L中性甲醛液固定, 常规石蜡包埋, 4 mm切片, 水化后行免疫组化SP法染色, 切片均采用胰酶消化和微波修复的抗原双暴露技术, 其余步骤参照试剂盒说明进行. 每例标本均做癌组织和癌旁正常组织染色, 有淋巴结转移或远处器官转移的病例同时做淋巴结或器官转移灶染色. 抗人VEGF-C多克隆抗体购自Santa Cruz, SP试剂盒购自北京中山生物技术公司. VEGF-C表达根据细胞着色强弱和着色细胞比例联合确定[15]. 着色强弱分为四级: 不着色等于0, 弱着色等于1, 中等着色等于2, 强着色等于3; 细胞着色比例也分为四级: 无细胞着色等于0, 着色细胞比例小于25%等于1, 着色细胞比例25-50%等于2, 着色细胞比例大于50%等于3. 细胞着色强弱和着色细胞比例二者积分小于或等于2为阴性表达, 大于2为阳性表达.
统计学处理 应用SPSS10.0统计软件对VEGF-C表达与大肠癌临床病理指标之间的关系进行χ2检验; 生存率采用Kaplan-Meier法计算, 组间差异用Log-rank检验, P<0.05表示差异显著有统计学意义.
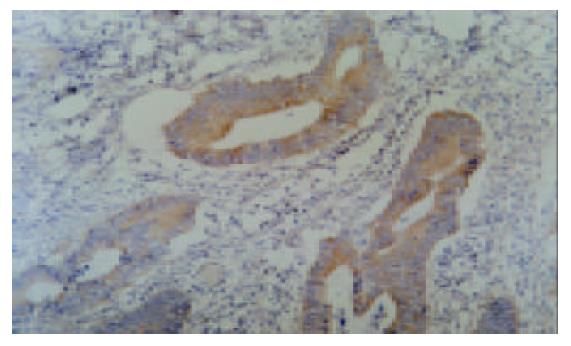
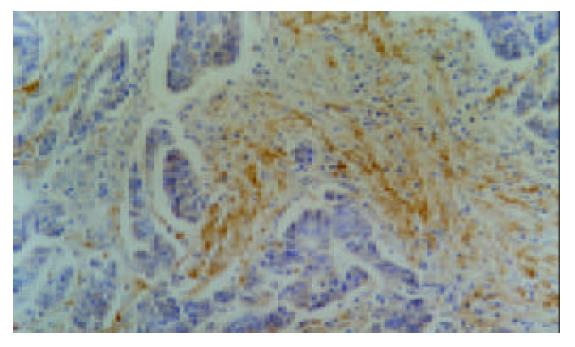
VEGF-C阳性物质呈棕黄色细颗粒状, 主要定位于大肠癌癌细胞胞质, 少数病例癌细胞胞核着色, 另外有2例癌细胞阴性而间质纤维细胞阳性. (图1-2) 96例大肠癌标本中VEGF-C阳性42例(43.8%), 阴性54例(56.2%); 正常大肠组织VEGF-C阳性19例(19.8%), 阴性77例(80.2%). 大肠癌组织VEGF-C阳性率明显高于正常大肠组织(42/96 vs 19/96, P<0.01), 并且同一病例癌细胞着色都强于正常大肠黏膜上皮细胞, 大肠癌VEGF-C阴性病例的正常黏膜没有VEGF-C表达. 41例转移至淋巴结的癌组织与原发部位癌组织VEGF-C表达相当一致(P>0.05, 表1).
| 淋巴结转移灶 | P值 | ||
| VEGF-C(+) | VEGF-C(-) | ||
| 原发灶 VEGF-C(+) | 24 | 3 | P<0.05 |
| VEGF-C(-) | 7 | 7 | |
经χ2检验VEGF-C表达与大肠癌分化程度、Dukes分期及淋巴结转移密切相关(P<0.05或P<0.01). 低分化腺癌VEGF-C阳性率(16.7%)低于高分化腺癌(51.9%); Dukes分期的C和D期VEGF-C阳性率(63.0%)明显高于A和B期(26.0%); 有淋巴结转移的病例VEGF-C阳性率(65.9%)显著高于无淋巴结转移病例(27.3%). 但是VEGF-C表达与患者年龄、性别、肿瘤大小、部位、浸润深度以及远处器官转移没有关系(P>0.05, 表2).
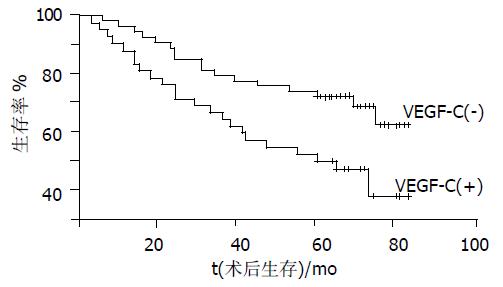
大肠癌患者96例术后生存5年及以上者59例, 总体5年生存率61.5%. VEGF-C阳性和VEGF-C阴性病例的Kaplan-Meier生存率曲线图如图3所示. 经Log-rank检验, 大肠癌VEGF-C表达与患者预后显著相关(P<0.05), VEGF-C阳性病例的5年生存率为50.0%明显低于阴性病例70.4%的5年生存率, 预后不良.
肿瘤扩散是肿瘤恶性发展和预后差的主要原因之一, 包括局部浸润、血道和淋巴道转移. VEGF家族中VEGF-C具有与VEGF-A不同的特性[16-18]. VEGF-C的受体为VEGFR-2和VEGFR-3, 尽管两种受体在血管和淋巴管都有表达, 但是VEGFR-3主要位于淋巴管内皮细胞, 而且VEGF-C与VEGFR-3结合的亲和力比VEGFR-2要高的多, 所以VEGF-C更多地表现出促进淋巴管生成与扩张[19-21]. 大肠癌是严重威胁我国人民身体健康的恶性肿瘤, 发病率逐年上升, 国内统计已上升至第4位[22], 并且具有较高的淋巴结转移率.淋巴结转移是大肠癌预后的一个重要指标, 发生淋巴结转移的患者5年生存率明显低于未转移者. VEGF-C诱导淋巴管生成的特性使人们越来越希望了解其在肿瘤生长和转移中的作用. 本研究中96例大肠癌有42例(43.8%)VEGF-C阳性, 54例(56.3%)阴性; 正常大肠组织VEGF-C阳性19例(19.8%), 阴性77例(80.2%). 大肠癌组织VEGF-C阳性率明显高于正常大肠组织(P<0.01), 并且同一病例癌细胞着色都强于正常大肠黏膜上皮细胞, 大肠癌VEGF-C阴性病例的正常黏膜没有VEGF-C表达.
VEGF-C是一种分泌型蛋白, 研究表明其在肿瘤组织中主要由肿瘤细胞合成. 我们的试验结果显示大肠癌VEGF-C的确主要在癌细胞中表达. 但是有意思的是, 有2例大肠癌癌细胞VEGF-C阴性, 而间质纤维细胞呈强阳性表达, 并且这2例病例均出现了淋巴结转移. 这表明除了肿瘤细胞外, 间质纤维细胞也可以合成分泌VEGF-C, 至少在大肠癌中是这样. 这印证了Ristamaki et al[23]的观点, 他认为巨噬细胞能够分泌某些细胞因子如TNF-α上调肿瘤细胞和纤维母细胞中VEGF-C的表达. 我们的研究表明, 42例VEGF-C阳性病例的淋巴结转移率(27/42, 64.3%)显著高于VEGF-C阴性病例(14/54, 25.9%, P<0.01). 同时与患者预后有关的Dukes分期也和大肠癌VEGF-C表达密切相关(P<0.01), Dukes分期的C和D期VEGF-C阳性率(63.0%)明显高于A和B期(26.0%). 41例转移至淋巴结的癌组织与原发部位癌组织VEGF-C表达相当一致(P<0.01). 对于7例原发部位VEGF-C阴性而转移灶阳性的病例, 我们发现原发部位VEGF-C阴性只是根据我们评定VEGF-C表达的标准来判定的, 但是其中都有部分癌细胞表达VEGF-C, 也许正是这些癌细胞转移到了淋巴结. 这似乎可以理解为对于单个癌细胞而言, 表达VEGF-C的癌细胞更具有侵袭淋巴管转移至淋巴结的可能性.
尽管很多人类肿瘤VEGF-C高表达与淋巴结转移密切相关[24-28], 但是现在还不完全清楚VEGF-C是如何促进肿瘤细胞转移的. 多数学者认为VEGF-C促进肿瘤转移的可能的解释是[29], VEGF-C通过诱导淋巴管生成, 增加了肿瘤细胞与淋巴管内皮细胞的接触面积, 进而增加转移的可能性; 此外, VEGF-C也可能通过增加淋巴管通透性、改变淋巴管内皮细胞黏附特性以及调节细胞因子(如肿瘤细胞趋化因子)、化学因子表达等多种方式促进肿瘤转移. 尽管高表达VEGF-C的肿瘤有更高的转移倾向, 但是只有部分动物模型发生了肿瘤淋巴结转移. 同时, 我们的研究显示低分化大肠癌VEGF-C表达明显低于高分化大肠癌, 这似乎与低分化大肠癌淋巴结转移率高的特性不符合[30], 表明低分化大肠癌的转移机制中VEGF-C并非一个主要因素. 以上事实提示, 大肠癌转移除了与VEGF-C有关外, 还存在一些别的重要影响因素. 总之, 肿瘤转移是一个多因素参与的多机制的过程, 对肿瘤转移的机制还有待于更进一步的深入研究.
肿瘤可以通过淋巴道或血道转移至远处器官, 但是我们的研究没有发现大肠癌VEGF-C表达与远处器官转移之间的关系(P>0.05). 另外, 大肠癌VEGF-C表达也与患者年龄、性别、肿瘤大小、部位以及肿瘤浸润深度无关(P>0.05).
大肠癌VEGF-C表达与淋巴结转移密切相关, 因此对于VEGF-C阴性患者, 尤其是高分化大肠癌患者采用肿瘤局部切除的手术方式也许是可行的. 同时, 我们的研究也表明大肠癌VEGF-C表达与患者预后显著相关(P<0.05), VEGF-C阳性患者的5年生存率为50%明显低于阴性病例70.4%的5年生存率, 预后不良. 尽管大肠癌手术切除、化疗和放疗方法不断改进, 但是其恶性发展并没有得到根本抑制, 预后依然很差[31], 大肠癌VEGF-C可能成为指导手术和放化疗方案以及判断预后的一个重要指标, 具有重要的临床意义.
| 1. | Chen K, Cai J, Liu XY, Ma XY, Yao KY, Zheng S. Nested case-control study on the risk factors of colorectal cancer. World J Gastroenterol. 2003;9:99-103. [PubMed] [DOI] |
| 2. | Cai SJ, Xu Y, Cai GX, Lian P, Guan ZQ, Mo SJ, Sun MH, Cai Q, Shi DR. Clinical characteristics and diagnosis of patients with hereditary nonpolyposis colorectal cancer. World J Gastroenterol. 2003;9:284-287. [PubMed] [DOI] |
| 3. | Jiang YA, Fan LF, Jiang CQ, Zhang YY, Luo HS, Tang ZJ, Xia D, Wang M. Expression and significance of PTEN, hypoxia-inducible factor-1 alpha in colorectal adenoma and adenocarcinoma. World J Gastroenterol. 2003;9:491-494. [PubMed] [DOI] |
| 4. | Lin LJ, Zheng CQ, Jin Y, Ma Y, Jiang WG, Ma T. Expression of survivin protein in human colorectal carcinogenesis. World J Gastroenterol. 2003;9:974-977. [PubMed] [DOI] |
| 5. | Xu XM, He C, Hu XT, Fang BL. Tumor necrosis factor-related apoptosis-inducing ligand gene on human colorectal cancer cell line HT29. World J Gastroenterol. 2003;9:965-969. [PubMed] [DOI] |
| 6. | Platell C, Lim D, Tajudeen N, Tan JL, Wong K. Dose surgical sub-specialization influence survival in patients with colorectal cancer? World J Gastroenterol. 2003;9:961-964. [PubMed] [DOI] |
| 7. | Kim JI, Park YJ, Kim KH, Kim JI, Song BJ, Lee MS, Kim CN, Chang SH. hOGG1 Ser326Cys polymorphism modifies the significance of the environmental risk factor for colon cancer. World J Gastroenterol. 2003;9:956-960. [PubMed] [DOI] |
| 8. | Xu MH, Deng CS, Zhu YQ, Lin J. Role of inducible nitric oxide synthase expression in aberrant crypt foci-adenoma-carcinoma sequence. World J Gastroenterol. 2003;9:1246-1250. [PubMed] [DOI] |
| 9. | Xiong B, Sun TJ, Yuan HY, Hu MB, Hu WD, Cheng FL. Cyclooxygenase-2 expression and angiogenesis in colorectal cancer. World J Gastroenterol. 2003;9:1237-1240. [PubMed] [DOI] |
| 10. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] [DOI] |
| 11. | Zhou ZG, Wang Z, Yu YY, Shu Y, Cheng Z, Li L, Lei WZ, Wang TC. Laparoscopic total mesorectal excision of low rectal cancer with preservation of anal sphincter: a report of 82 cases. World J Gastroenterol. 2003;9:1477-1481. [PubMed] [DOI] |
| 12. | Zhang JC, Wang ZR, Cheng YJ, Yang DZ, Shi JS, Liang AL, Liu NN, Wang XM. Expression of proliferating cell nuclear antigen and CD44 variant exon 6 in primary tumors and corresponding lymph node metastases of colorectal carcinoma with Dukes' stage C or D. World J Gastroenterol. 2003;9:1482-1486. [PubMed] [DOI] |
| 13. | Gu J, Ma ZL, Li Y, Li M, Xu GW. Angiography for diagnosis and treatment of colorectal cancer. World J Gastroenterol. 2003;9:288-290. [PubMed] [DOI] |
| 14. | Hu HY, Liu XX, Jiang CY, Zhang Y, Bian JF, Lu Y, Geng Z, Liu SL, Liu CH, Wang XM. Cloning and expression of ornithine decarboxylase gene from human colorectal carcinoma. World J Gastroenterol. 2003;9:714-716. [PubMed] [DOI] |
| 17. | Joukov V, Pajusola K, Kaipainen A, Chilov D, Lahtinen I, Kukk E, Saksela O, Kalkkinen N, Alitalo K. A novel vascular endothelial growth factor, VEGF-C, is a ligand for the Flt4 (VEGFR-3) and KDR (VEGFR-2) receptor tyrosine kinases. EMBO J. 1996;15:290-298. [PubMed] |
| 18. | Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999;13:9-22. [PubMed] |
| 19. | Joukov V, Sorsa T, Kumar V, Jeltsch M, Claesson-Welsh L, Cao Y, Saksela O, Kalkkinen N, Alitalo K. Proteolytic processing regulates receptor specificity and activity of VEGF-C. EMBO J. 1997;16:3898-3911. [PubMed] [DOI] |
| 20. | Oh SJ, Jeltsch MM, Birkenhäger R, McCarthy JE, Weich HA, Christ B, Alitalo K, Wilting J. VEGF and VEGF-C: specific induction of angiogenesis and lymphangiogenesis in the differentiated avian chorioallantoic membrane. Dev Biol. 1997;188:96-109. [PubMed] [DOI] |
| 21. | Jeltsch M, Kaipainen A, Joukov V, Meng X, Lakso M, Rauvala H, Swartz M, Fukumura D, Jain RK, Alitalo K. Hyperplasia of lymphatic vessels in VEGF-C transgenic mice. Science. 1997;276:1423-1425. [PubMed] [DOI] |
| 23. | Ristamaki A, Narko K, Enholm B, Joukov V, Alitalo K. Pro-inflammatory cytokines regulate expression of the lymphatic endothelial mitogen vascular endothelial growth factor-C. J Biol Chem. 1998;273:8413-8418. [PubMed] [DOI] |
| 24. | Mandriota SJ, Jussila L, Jeltsch M, Compagni A, Baetens D, Prevo R, Banerji S, Huarte J, Montesano R, Jackson DG. Vascular endothelial growth factor-C-mediated lymphangiogenesis promotes tumour metastasis. EMBO J. 2001;20:672-682. [PubMed] [DOI] |
| 25. | Nakamura Y, Yasuoka H, Tsujimoto M, Yang Q, Tsukiyama A, Imabun S, Nakahara M, Nakao K, Nakamura M, Mori I. Clinicopathological significance of vascular endothelial growth factor-C in breast carcinoma with long-term follow-up. Mod Pathol. 2003;16:309-314. [PubMed] [DOI] |
| 26. | Neuchrist C, Erovic BM, Handisurya A, Fischer MB, Steiner GE, Hollemann D, Gedlicka C, Saaristo A, Burian M. Vascular endothelial growth factor C and vascular endothelial growth factor receptor 3 expression in squamous cell carcinomas of the head and neck. Head Neck. 2003;25:464-474. [PubMed] [DOI] |
| 27. | Schietroma C, Cianfarani F, Lacal PM, Odorisio T, Orecchia A, Kanitakis J, D'Atri S, Failla CM, Zambruno G. Vascular endothelial growth factor-C expression correlates with lymph node localization of human melanoma metastases. Cancer. 2003;98:789-797. [PubMed] [DOI] |
| 28. | Li Q, Dong X, Gu W, Qiu X, Wang E. Clinical significance of co-expression of VEGF-C and VEGFR-3 in non-small cell lung cancer. Chin Med J (Engl). 2003;116:727-730. |