修回日期: 2004-01-09
接受日期: 2004-01-12
在线出版日期: 2004-05-15
目的: 探讨咖啡酸苯乙酯(caffeic acid phenethyl ester, CAPE)对体外培养的大肠癌细胞HCT116细胞增生、细胞周期和凋亡的影响.
方法: 不同浓度CAPE处理体外培养的HCT116细胞后, 采用MTT法检测处理后24、48、72、96 h HCT116细胞的增生活性; PI染色、流式细胞仪检测处理后24 h细胞周期分布; Annexin V-FITC/PI双染色、流式细胞仪检测处理后24 h细胞凋亡率.
结果: 80, 40, 20, 10, 5.0, 2.5 mg/L CAPE处理HCT116细胞24, 48, 72, 96 h后, 细胞增生明显受到抑制, 呈时间和剂量依赖性特点. 流式细胞仪细胞周期分析表明, 10, 5.0, 2.5 mg/L CAPE处理HCT116细胞24 h后, G0 /G1 期细胞百分率上升, S期细胞百分率下降, 呈剂量依赖性. 流式细胞仪细胞凋亡率分析表明: 10, 5.0, 2.5 mg/L CAPE处理HCT116细胞24 h后, 细胞凋亡率上升, 呈剂量依赖性.
结论: CAPE对HCT116细胞具有明显的增生抑制作用, 其机制与其阻滞细胞周期和诱导凋亡有关.
引文著录: 向德兵, 何渝军, 吴晓华, 王东, 李增鹏, 何玉虹, 牟江洪, 肖华亮, 张沁宏. 咖啡酸苯乙酯对大肠癌HCT116细胞增生的抑制作用. 世界华人消化杂志 2004; 12(5): 1053-1056
Revised: January 9, 2004
Accepted: January 12, 2004
Published online: May 15, 2004
AIM: To study the effect of caffeic acid phenethyl ester (CAPE) on proliferation, cell cycle, apoptosis in the cultured colorectal cancer cell line HCT116.
METHODS: HCT116 cells were treated with CAPE at serial concentrations of 80, 40, 20, 10, 5, and 2.5 mg/L. The proliferative status of HCT116 cells was measured by using methabenzthiazuron (MTT) assay. Cell cycle was analyzed by using flow cytometry (FCM) with propidium iodide (PI) labeling method. The rate of apoptosis was detected by using FCM with Annexin V-FITC and PI double labeling method.
RESULTS: After HCT116 cells were exposed to CAPE (80, 40, 20, 10, 5 and 2.5 mg/L) for 24, 48, 72 and 96 h, CAPE displayed a strong growth inhibitory effect on HCT116 cells in a dose-and time-dependent manner. FCM analysis showed that G0 /G1 phase rate increased, S phase rate decreased and apoptosis rate increased after HCT116 cells were exposed to CAPE (10, 5, and 2.5 mg/L) for 24 h, which were positively related to the concentration of CAPE.
CONCLUSION: CAPE can inhibit the proliferation of human colorectal cancer cell line HCT116, which is related to the cell cycle arrest and apoptosis.
- Citation: Xiang DB, He YJ, Wu XH, Wang D, Li ZP, He YH, Mou JH, Xiao HL, Zhang QH. Inhibitirve effect of caffeic acid phenethyl ester on proliferation of human colorectal cancer cell line HCT116. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1053-1056
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1053.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1053
咖啡酸苯乙酯(caffeic acid phenethyl ester, CAPE)是一种酚类抗氧化剂, 广泛存在于多种含树脂的植物和蜂胶中, 也能人工合成. 蜂胶在国外作为一种民间药物, 证明其有抗病原微生物, 抗炎和抗肿瘤作用. 近年国外有报道, CAPE作为蜂胶抗肿瘤作用的主要活性成分, 对人白血病和多种实体瘤细胞有抑制增生和诱导凋亡作用[1-5], 且发现CAPE可显著降低转基因小鼠(转染突变型APC基因)和致癌剂诱发的大鼠大肠肿瘤的发生率[6-7], 但CAPE能否抑制大肠癌细胞HCT116的增生,作用机制如何,目前尚不清楚.我们探讨CAPE对体外培养的大肠癌细胞HCT116的增生抑制作用及其对细胞周期和凋亡的影响, 初步阐明其抗肿瘤作用机制.
大肠癌细胞HCT116购自美国ATCC. CAPE、二甲基亚砜(DMSO)、四甲基偶氮唑盐(MTT)、碘化丙啶(PI)为Sigma公司产品. RPMI1640培养基、小牛血清为Hyclone公司产品. Annexin V-FITC试剂盒为美国贝克曼库尔特公司产品.
HCT116细胞置于37 ℃, 饱和湿度, 含50 mL/L CO2的孵箱中培养, 培养液RPMI1640含有100 mL/L小牛血清, 1.0×105U/L青霉素和链霉素. 根据细胞生长状况每2-3 d换液1次, 当细胞生长状态稳定, 呈对数生长期时, 用于实验. CAPE临用前以DMSO溶解, 用RPMI 1640液稀释(RPMI 1640液中DMSO浓度小于1 mL/L).
1.2.1 细胞增生抑制实验: 采用MTT法检测CAPE对HCT116细胞生长的抑制作用. 对数生长期的HCT116细胞以4×103/孔接种于96孔培养板培养, 24 h后吸除原培养液,加入含CAPE浓度分别为2.5, 5.0, 10, 20, 40, 80 mg/L的RPMI1640培养液180 mL, 设培养液中不加药物(加相同浓度的DMSO)的为对照组, 另设只加培养液, 不加细胞和药物的为空白组. 每组6个复孔. 将各组细胞继续培养24, 48, 72, 96 h后, 进行MTT实验, 每孔加MTT溶液(5 g/L)20 mL, 继续培养4 h, 终止培养, 小心吸弃孔内培养上清液, 每孔加入DMSO 150 mL, 振荡10 min, 使结晶充分溶解, 用酶标仪在490nm波长处测定各孔的吸光度A值(A490), 按下列公式计算细胞生长抑制率:
细胞生长抑制率R = [1-(A实验组-A空白组)/(A对照组-A空白组)]×100%.
1.2.2 细胞周期检测: 对数生长期的HCT116细胞接种于6孔培养板培养, 24h后吸除原培养液, 加入含CAPE浓度分别为2.5, 5.0, 10 mg/L的RPMI1640培养液, 设培养液中不加药物(加相同浓度的DMSO)的为对照组, 继续培养24 h后收集细胞, 2000转4 ℃离心5 min后弃上清, 冷PBS重悬, 离心, 弃上清, 用体积分数为700 mL/L冷乙醇固定, 4 ℃过夜, 染色前用PBS洗涤离心, 去除固定液, 用RNaseA(终浓度20 mg/L)消化, 37 ℃水浴30 min, 再加入PI染色液(终浓度50 mg/L), 混匀, 4 ℃避光染色30 min, 流式细胞仪上进行DNA含量和细胞周期分析, 得出细胞各周期的百分率.
1.2.3 细胞凋亡检测: 对数生长期的HCT116细胞接种于6孔培养板培养, 24 h后吸除原培养液, 加入含CAPE浓度分别为2.5, 5.0, 10 mg/L的RPMI1640培养液, 设培养液中不加药物(加相同浓度的DMSO)的为对照组, 继续培养24 h后收集细胞, 2 000 r/min 4 ℃离心5 min后, 冷PBS重悬, 离心, 弃上清, 再次重悬离心, 加Annexin-V-FITC溶液5 mL和PI 2.5 mL到100 mL细胞悬浮液中, 混匀后避光反应10 min, 加150 mL样品稀释液到样品中, 混匀后上机检测.
统计学处理 所有数据均以均数±标准差(mean±SD)表示. 以SPSS9.0版专用统计分析程序对各组数据进行单因素方差分析. 以CalcuSyn Demo Version 1.1.4统计软件计算IC50.
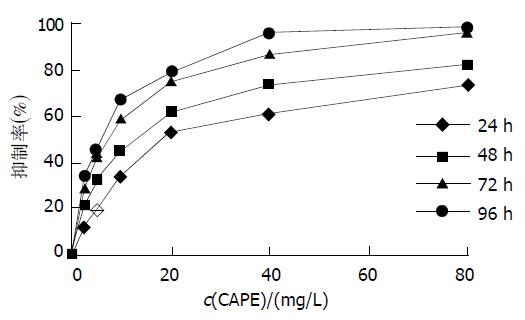
CAPE作用24, 48, 72, 96 h后HCT116细胞的生长抑制率曲线(图1)可见, 随着CAPE浓度的增加和作用时间的延长, HCT116细胞的生长抑制率逐渐升高, 抑制作用表现量效依赖性和时间依赖性. 24, 48, 72, 96 h的IC50分别为22.45, 12.07, 6.47, 5.36 mg/L.
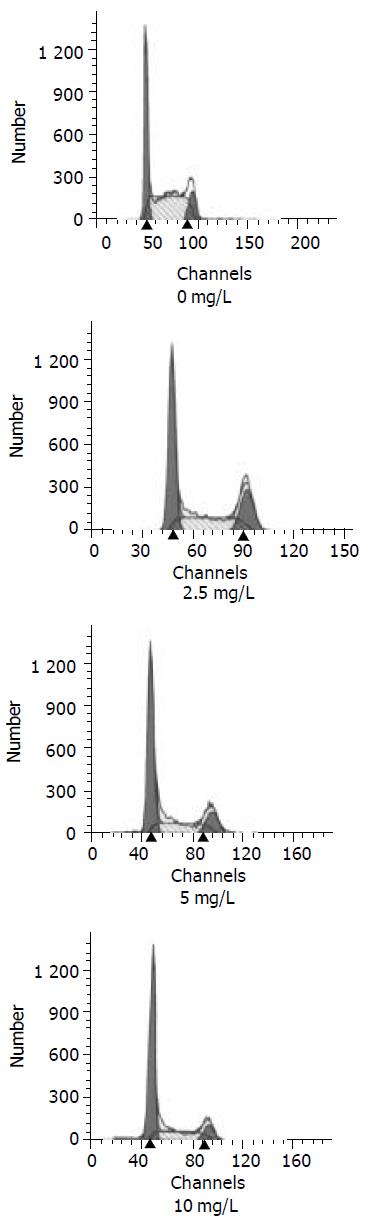
HCT116细胞经2.5, 5.0, 10 mg/L的CAPE作用24 h后, 随着CAPE剂量的增加, G0/G1期细胞逐渐增加, S期细胞逐渐下降, 与对照组比较, 差异有显著性, 而G2/M期改变不明显(表1, 图2).
大肠癌是我国最常见的恶性肿瘤之一[8-13], 其发病呈上升趋势[14-16], 严重威胁人民生命健康[17-21], 目前国内外仍在积极探讨有效的治疗方法[22-25]. 流行病学调查显示, 大肠癌的发病与饮食结构有关, 西方发达国家人群中其发病率明显高于那些以素食为主、进食较少肉类和动物脂肪的人群, 如东南亚地区的居民. CAPE广泛存在于多种含树脂的植物和蜂胶中, 且近年国外有报道, CAPE作为蜂胶抗肿瘤作用的主要活性成分, 对人白血病、口腔鳞癌、乳腺癌、黑色素瘤细胞有抑制增生和诱导凋亡作用, 且与其抑制核因子-κB(nuclear factor-κB, NF-κB)、环氧化酶-2(cyclooxygenase-2, COX-2)的表达有关.
我们应用CAPE作用人结肠癌HCT116细胞24, 48, 72, 96 h, 发现CAPE能明显抑制细胞增生, 随着CAPE浓度的增加和作用时间的延长, HCT116细胞的生长抑制率逐渐升高, 抑制作用表现为剂量依赖性和时间依赖性. Nagaoka et al发现CAPE体外能显著抑制鼠肝转移结肠癌26-L5细胞株, 鼠肝转移恶性黑色素瘤B16-BL6细胞株, 鼠肺转移肺癌LLC细胞株, 人纤维肉瘤HT-1080细胞株, 人肺腺癌A549细胞株和人宫颈癌HeLa 细胞株的生长, 作用72h的EC50分别为0.15, 2.57, 2.18, 14.4, 32.4, 10.7 mM, 说明不同的细胞株对CAPE的敏感性不同.
关于CAPE是否可调控细胞周期, 目前尚未见文献报道. 我们发现, CAPE作用HCT116细胞24 h后, 细胞受阻于G0/G1期, S期细胞减少, 且呈剂量依赖性. 在一个完整的细胞周期中, 有多个影响各时期间过渡的限制点, 他们分别处在由G1期到M期和M期到G1期的过渡阶段中. 由于不同生物细胞的增生周期时间不同, 主要表现在G1期持续时间的差异, 而且G1期的启动是细胞周期的关键. 因此G1-S期的调控尤为重要. G1期阻滞使HCT116细胞生长周期延长, 细胞的恶性增生相应减慢. S期即DNA合成期, 可反映细胞的增生情况. S期细胞占细胞周期的比例高则提示DNA合成活跃, 细胞增生活跃. 一般而言, 肿瘤细胞的S期比例较正常细胞要高, 其增生活性也较正常细胞高. 因此, CAPE可调控细胞周期, 使细胞受阻于G0/G1期, 而不能进入S期, 限制细胞增生.
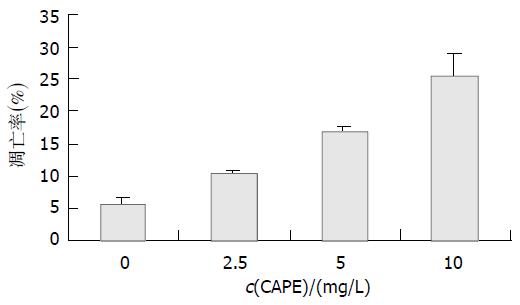
Chen et al[2]研究表明, CAPE能诱导人白血病HL-60细胞凋亡, 呈时间和浓度依赖性. Nomura et al[5]发现CAPE能明显诱导肿瘤细胞株NCI-H388和SK-OV-3等的凋亡, 并且与其调节P53基因功能有关. 我们应用Annexin V-FITC/PI双染色法检测CAPE对HCT116细胞凋亡的影响, 该方法是目前检测凋亡的最敏感的方法之一, 能检测出早期凋亡细胞, 并区分出坏死细胞. 结果显示, CAPE作用HCT116细胞24 h后, 细胞凋亡率明显升高, 呈剂量依赖性特点.
因此, 本结果表明, CAPE对HCT116细胞具有明显的增生抑制作用, 与其阻滞细胞周期和诱导凋亡有关, CAPE具体的抗癌作用机制仍需进一步研究.
| 1. | Chen YJ, Shiao MS, Wang SY. The antioxidant caffeic acid phenethyl ester induces apoptosis associated with selective scavenging of hydrogen peroxide in human leukemic HL-60 cells. Anticancer Drugs. 2001;12:143-149. [PubMed] [DOI] |
| 2. | Chen YJ, Shiao MS, Hsu ML, Tsai TH, Wang SY. Effect of caffeic acid phenethyl ester, an antioxidant from propolis, on inducing apoptosis in human leukemic HL-60 cells. J Agric Food Chem. 2001;49:5615-5619. [PubMed] [DOI] |
| 3. | Lee YJ, Liao PH, Chen WK, Yang CY. Preferential cytotoxicity of caffeic acid phenethyl ester analogues on oral cancer cells. Cancer Lett. 2000;153:51-56. [PubMed] [DOI] |
| 4. | Usia T, Banskota AH, Tezuka Y, Midorikawa K, Matsushige K, Kadota S. Constituents of Chinese propolis and their antiproliferative activities. J Nat Prod. 2002;65:673-676. [PubMed] [DOI] |
| 5. | Nomura M, Kaji A, Ma W, Miyamoto K, Dong Z. Suppression of cell transformation and induction of apoptosis by caffeic acid phenethyl ester. Mol Carcinog. 2001;31:83-89. [PubMed] [DOI] |
| 6. | Mahmoud NN, Carothers AM, Grunberger D, Bilinski RT, Churchill MR, Martucci C, Newmark HL, Bertagnolli MM. Plant phenolics decrease intestinal tumors in an animal model of familial adenomatous polyposis. Carcinogenesis. 2000;21:921-927. [PubMed] [DOI] |
| 7. | Borrelli F, Izzo AA, Di Carlo G, Maffia P, Russo A, Maiello FM, Capasso F, Mascolo N. Effect of a propolis extract and caffeic acid phenethyl ester on formation of aberrant crypt foci and tumors in the rat colon. Fitoterapia. 2002;73 Suppl 1:S38-S43. [PubMed] [DOI] |
| 8. | 房 殿春, 杨 仕明, 杨 建民, 刘 海峰, 彭 贵勇, 肖 天利, 汪 荣泉, 刘 为纹. 大肠癌组织微卫星不稳与hMLH1和hMSH2基因启动子 区甲基化状态. 世界华人消化杂志. 2003;11:302-305. [DOI] |
| 10. | 向 德兵, 吴 晓华, 李 增鹏, 刘 友生. beta-catenin, cyclin D1和c-myc在大肠癌组织中的表达. 世界华人消化杂志. 2002;10:305-308. [DOI] |
| 11. | Chen K, Cai J, Liu XY, Ma XY, Yao KY, Zheng S. Nested case-control study on the risk factors of colorectal cancer. World J Gastroenterol. 2003;9:99-103. [PubMed] [DOI] |
| 12. | Cai SJ, Xu Y, Cai GX, Lian P, Guan ZQ, Mo SJ, Sun MH, Cai Q, Shi DR. Clinical characteristics and diagnosis of patients with hereditary nonpolyposis colorectal cancer. World J Gastroenterol. 2003;9:284-287. [PubMed] [DOI] |
| 13. | Qing SH, Rao KY, Jiang HY, Wexner SD. Racial differences in the anatomical distribution of colorectal cancer: a study of differences between American and Chinese patients. World J Gastroenterol. 2003;9:721-725. [PubMed] [DOI] |
| 15. | Kim JI, Park YJ, Kim KH, Kim JI, Song BJ, Lee MS, Kim CN, Chang SH. hOGG1 Ser326Cys polymorphism modifies the significance of the environmental risk factor for colon cancer. World J Gastroenterol. 2003;9:956-960. [PubMed] [DOI] |
| 16. | Zhou ZG, Wang Z, Yu YY, Shu Y, Cheng Z, Li L, Lei WZ, Wang TC. Laparoscopic total mesorectal excision of low rectal cancer with preservation of anal sphincter: a report of 82 cases. World J Gastroenterol. 2003;9:1477-1481. [PubMed] [DOI] |
| 17. | Zhang JC, Wang ZR, Cheng YJ, Yang DZ, Shi JS, Liang AL, Liu NN, Wang XM. Expression of proliferating cell nuclear antigen and CD44 variant exon 6 in primary tumors and corresponding lymph node metastases of colorectal carcinoma with Dukes' stage C or D. World J Gastroenterol. 2003;9:1482-1486. [PubMed] [DOI] |
| 18. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] [DOI] |
| 22. | 布 立民, 纪 欣, 韩 英, 陈 刚, 王 志红, 孙 淑红. 丁酸钠联合穿琥宁对人大肠癌细胞 HCT-8 增生的影响. 世界华人消化杂志. 2003;11:1193-1196. [DOI] |