修回日期: 2004-01-09
接受日期: 2004-01-15
在线出版日期: 2004-05-15
目的: 了解光动力疗法对结肠癌SW480细胞的周期阻滞作用与G1/S关卡调控因子之间的联系.
方法: 对体外培养的SW480结肠癌细胞进行ALA-PDT实验, 使用流式细胞仪技术观测基于δ-氨基乙酰丙酸的光动力疗法对SW480细胞的细胞周期阻滞作用, 应用免疫细胞化学技术检测光动力疗法对G1/S关卡调 控 因 子Chk2, P21WAF1/Cip1/Sdi1, CyclinD1蛋白表达的影响.
结果: 基于δ-氨基乙酰丙酸的光动力疗法可在其作用后早期诱导SW480细胞产生G0-G1细胞周期阻滞, G0/G1期比例显著增加, 而S期和G2/M期比例明显下降, 且呈时间依赖性变化; 光动力作用诱导SW480细胞G1/S关卡调控因子Chk2, P21WAF1/Cip1/Sdi1蛋白表达增高, 降低CyclinD1蛋白表达, 与G1/S期阻滞进程相一致, 均呈时间依赖性变化.
结论: 基于δ-氨基乙酰丙酸的光动力疗法可诱导SW480细胞产生G0-G1细胞周期阻滞, 光动力疗法对SW480细胞的G0-G1期阻滞作用与其对多个G1/S关卡调控因子的调节事件有关.
引文著录: 肖卫东, 陈炜, 葛海燕, 陈祖林. ALA-PDT对SW480结肠癌细胞周期阻滞作用及对G1/S关卡调控因子的影响. 世界华人消化杂志 2004; 12(5): 1048-1052
Revised: January 9, 2004
Accepted: January 15, 2004
Published online: May 15, 2004
AIM: To investigate the involvement of G1/S regulators during ALA-PDT-mediated cell cycle arrest.
METHODS: Colon carcinoma SW480 cells were treated with 1 mmol/L ALA and 6 h later irradiated with 9 J/cm2 631 nm light from a laser. The analysis of cell cycle arrest by ALA-PDT was performed by flow cytometry. The effect of ALA-PDT on G1/S cell cycle regulators Chk2, CyclinD1 and P21WAF1/Cip1/Sdi1 was examined by using immunocytochemical technique.
RESULTS: ALA-PDT resulted in G0-G1 phase arrest of the tumor cell cycle in post-PDT in a time-dependent manner. Immunocytochemical analysis revealed that PDT resulted in an induction of G1/S checkpoint regulation factors such as Chk2 and P21WAF1/Cip1/Sdi1, and a down-regulation of CyclinD1 in a time-dependent manner.
CONCLUSION: ALA-PDT causes G0-G1 phase arrest of SW480 cell cycle in post-PDT earlier period; PDT-mediated induction of G1/S checkpoint regulators Chk2 and P21WAF1/Cip1/Sdi1 results in the imposition of artificial checkpoint at G1-S checkpoint thereby leading to an arrest of cells in G0-G1 phase of the cell cycle through inhibition in cyclinD1 in a time-dependent manner.
- Citation: Xiao WD, Chen W, Ge HY, Chen ZL. Involvement of G1/S checkpoint regulators during photodynamic-therapy-mediated cell cycle arrest in human colon carcinoma SW480 cells. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1048-1052
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1048.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1048
光动力疗法(photodynamic therapy, PDT)抑制肿瘤细胞的作用机制仍不完全清楚. 已有研究表明PDT可通过阻滞细胞周期于G0-G1期来介导细胞凋亡[1]. 而近来研究表明G1/S期关卡是影响细胞周期进程的关键限制点,他的转换决定着细胞是否进入S期继续增生还是停滞或死亡, 也是改进肿瘤治疗效果的理想干预点, 而G1/S关卡相关调控因子影响着这一进程[2]. 我们研究了ALA-PDT阻滞肿瘤细胞周期与G1/S关卡调控因子chk2, p21 WAF1/Cip1/Sdi1, CyclinD1之间的可能联系.
δ-氨基乙酰丙酸(δ-aminolevulinate acid, δ-ALA)购自Sigma公司, 在实验当天于避光条件下使用D-Hanks液配制过滤后密封, 避光保存于4 ℃备用. 人结肠腺癌SW480细胞株由第四军医大学实验动物中心细胞库提供; RPMI1640培养基购自Gibco公司; 新生小牛血清购自Hyclone公司; 小鼠抗人P21 WAF1/Cip1/Sdi1 mAb、小鼠抗人CyclinD1 mAb购自Santa Cruz公司; 小鼠抗人Chk2 mAb购自Neomarkers公司; 免疫组化EnvisionTM 试剂盒购自DAKO公司.
SW480细胞常规在RPMI1640培养液(含100 mL/L灭活新生小牛血清, 青霉素100 ku/L, 链霉素50 g/L)中培养. 置于CO2孵箱中, 恒温37 ℃, 50ml/L CO2, 饱和湿度. 细胞培养密度0.1×109-1×109/L, 每3-4 d传代1次, 取对数生长期细胞用于实验. A实验组(1 mmoL/L ALA孵育6 h, 激光照射30 min); B正常对照组(不加ALA孵育, 不用激光照射); C光敏剂对照组(1 mmoL/L孵育6 h, 不用激光照射); D激光对照组(不加ALA孵育, 激光照射30 min).
1.2.1 ALA-PDT实验: 参照REN et al[3]及陈祖林 et al[23]的方法, 将SW480细胞按1×108/L密度接种于培养板中(免疫组化实验需预置盖玻片), 待其贴壁后, 吸出含血清培养液后, D-Hanks液轻轻漂洗后弃去, 于暗室按预定时间加入含ALA(1mmol/L)的RMPI1640培养液(不含血清), 孵育6 h, 弃去含ALA之培养液, D-Hanks液轻洗后, 加入新鲜培养液, 实验组和激光组细胞使用半导体激光仪(西南师范大学激光所, 距光斑3 cm处输出功率15 mW, 能量密度 9 J/cm2)垂直照射培养孔, 于暗室连续照射30 min, 照射后细胞置培养箱中继续培养到实验设计各组时间, 0.25%胰蛋白酶液常规消化, D-Hanks液洗涤后收集备用.
1.2.2 SW480细胞周期蛋白表达: 消化收集各组细胞, 1 000 r/min离心5 min, PBS漂洗后吹打成单细胞悬液, 700 mL/L冷乙醇4 ℃下固定24 h后送检, 流式细胞仪(BD公司, FACStar-PLUS型)检测细胞周期. Envision法检测SW480细胞Chk2, cyclinD1, p21WAF1/Cip1/Sdi1蛋白的表达(按DAKO公司说明书, 稍加修改) PDT实验后6, 12, 24 h依次取出盖玻片, PBS轻漂洗后, 4 ℃冷丙酮液固定5min; 内源性过氧化物酶阻断剂室温孵育10 min, PBS漂洗后加入一抗(Chk2 1:100; cyclinD1 1:50; p21WAF1/Cip1/Sdi1 1:40), 湿盒内孵育, 4 ℃过夜; 加入Envision酶复合物, 37 ℃孵育30 min; PBS漂洗后DAB镜下显色, 水洗终止; 苏木素复染, 脱水, 透明, 封片. 结果判断: 光镜下观察, Chk2, CyclinD1, P21WAF1/Cip1/Sdi1蛋白阳性产物呈棕黄色, 以胞核为主, 少量胞质亦可见阳性颗粒. 采用美国Image-pro-plus图像处理系统(Media cybernetics公司)检测, 各实验分组中每个样本随机抽取5个区域进行阳性细胞平均吸光度值(Ax )值测定.
统计学处理 实验采用SPSS11.0软件处理数据结果, 采用均值t检验, 结果用mean±SD表示, 各组间相比采用配对t检验(显著水平a为0.05)
PDT组细胞G0/G1期比例显著增加, 而S期和G2/M期比例明显下降, 同时在PDT作用后早期(6 h)就可观察到此变化, 而在PDT作用后48 h阻滞作用最为明显(表1), 而在3个组中则未见此种变化(本文未显示数据).
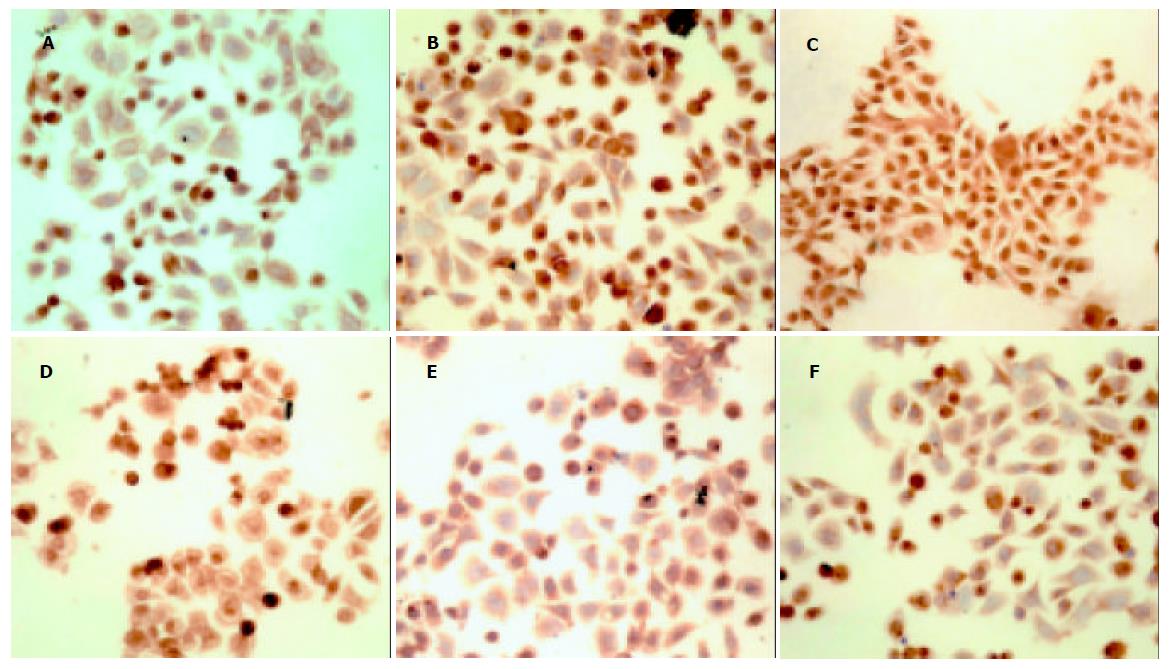
镜下观察可见, P21WAF1/Cip1/Sdi1, CyclinD1, Chk2蛋白表达均呈棕黄色颗粒, 主要分布于细胞核, 胞质可见有少量表达. 在PDT处理后, SW480细胞cyclinD1表达明显减弱, 阳性表达细胞比率降低, 阳性染色变淡, 而P21WAF1/Cip1/Sdi1和Chk2蛋白表达则在PDT处理后表达明显增强, 且均呈时间依赖性变化, 与对照组均有显著性差异 (见图1、表2).
| 蛋白 | 分组 | PDT前 | PDT后6 h | PDT后12 h | PDT后24 h |
| CylinD1 | PDT | 0.317±0.017 | 0.256±0.020a | 0.223±0.014b | 0.216±0.014b |
| 光敏剂 | 0.317±0.017 | 0.298±0.016 | 0.283±0.060f | 0.283±0.026g | |
| 激光 | 0.317±0.017 | 0.282±0.015 | 0.269±0.011ac | 0.263±0.012gh | |
| 正常 | 0.317±0.017 | 0.310±0.020c | 0.297±0.013f | 0.280±0.016g | |
| P21 WAF1 | PDT | 0.159±0.015 | 0.240±0.015b | 0.258±0.016b | 0.255±0.017f |
| 光敏剂 | 0.159±0.015 | 0.158±0.020c | 0.162±0.017f | 0.164±0.029h | |
| 激光 | 0.159±0.015 | 0.152±0.021c | 0.161±0.022f | 0.172±0.022h | |
| 正常 | 0.159±0.015 | 0.166±0.031c | 0.158±0.018f | 0.153±0.026h | |
| Chk2 | PDT | 0.136±0.012 | 0.191±0.012b | 0.195±0.018b | 0.194±0.020a |
| 光敏剂 | 0.136±0.012 | 0.136±0.020d | 0.145±0.014e | 0.148±0.017 | |
| 激光 | 0.136±0.012 | 0.143±0.024c | 0.168±0.012a | 0.150±0.018g | |
| 正常 | 0.136±0.012 | 0.163±0.034 | 0.141±0.034 | 0.142±0.046 |
PDT作为一种全新的肿瘤治疗手段, 近年来备受重视. 但PDT抑制肿瘤细胞的作用机制, 仍不完全清楚, 一般认为单态氧以及其他可能的活性氧成分是产生PDT作用的必要条件. 大量研究表明, PDT可诱导肿瘤细胞凋亡, 也可引起肿瘤细胞坏死, 但目前仍无一种统一的机制来解释这种现象[4,24-26]. Ahmad et al[1]研究表明, PDT以时间依赖方式导致细胞G0-G1期阻滞和生长停滞, 存活率下降, 凋亡. 他们认为PDT诱导的P21WAF1/Cip1/Sdi1的增加抑制了G1/S关卡转位, 从而通过抑制CyclinD1、细胞周期素依赖性激酶2 (cyclin dependent kinase 2, Cdk2)、Cdk6、CyclinE来使细胞阻滞在G0-G1期, 这种细胞周期阻滞是一种不可逆转的过程, 最终导致凋亡. Fisher et al[5]发现PDT可通过诱导肿瘤细胞视网膜神经胶质瘤蛋白(retinoblastoma protein, PRB)快速移位和去磷酸化, 从而诱导P53和P21WAF1/ Cip1/Sdi1(以下简称P21WAF1)的表达, 促使肿瘤细胞G1/S期阻滞和凋亡.
在本研究中, ALA-PDT作用结肠癌细胞SW480后6 h, 即出现细胞生长减缓, 细胞存活率下降, 且表现为时间依赖性方式; 12 h后, 细胞开始出现明显的增生抑制, 活细胞总数有所下降, 而36 h后活细胞总数略有上升, 但细胞总数和存活率仍较对照组差异明显[6]. 流式细胞仪检测PDT后不同时相点结肠癌细胞周期变化, PDT后6-48 h细胞G0/G1指数由30.5±5.5%升至72.6±5.8%; S期指数则由36.9±1.4% 降到了21.9±2.9%; 而G2/M期指数由PDT后6 h的16.1±1.0%降到了5.6±2.9%. 这表明ALA-PDT可以通过阻滞SW480细胞于G0/G1期来抑制肿瘤细胞继续生长分裂, 抑制肿瘤细胞增生.
细胞周期关卡(cell cycle checkpoint)是指控制细胞增生周期中的限速位点, 他在DNA复制和有丝分裂前负责确定DNA合成的完整性, 监控DNA的复制, 在发生DNA损伤后修复和阻断细胞进入有丝分裂期, 精确调节细胞周期的进行, 以防止增生周期中发生错误[7]. 细胞周期关卡控制的失调可导致基因不稳定性, 增加癌症易感性[8]. 在细胞周期关卡调控中, G1/S关卡的调控至关重要, 细胞在该点对DNA损伤、各类信号传导因子等复杂的细胞内外信号进行整合和传递, 决定细胞是否进行分裂、发生凋亡 , 或是进入G0期. G1/S关卡是细胞对DNA损伤的应激反应通路的重要枢钮, 是由感觉因子(sensor)、传导因子(transducer)和效应因子(effector)构成的信号传导通路[9]. 近来研究认为, 在G1/S反应通路的上游是ATM (ataxia-telangiectasia, mutated)和ATR(ataxia-telangiectasia and Rad3-related) 两个信号传导激酶, 属于磷脂酰肌醇激酶(PIK)相关家族; 传导因子主要是两个关卡激酶(check point kinase, Chk): 关卡激酶1(Chk1)和关卡激酶2(Chk2), 他们属于结构上无关但功能互补的丝氨酸/苏氨酸激酶家族, 也是ATM和ATR调控的靶点, 对DNA损伤做出反应. Chk下游是执行关卡反应的效应因子, 这主要包括Chk激酶的底物, 他们是与DNA修复、转录调节、细胞周期控制有关的相关蛋白, 如P21WAF1、P53、BRCA1、Cdc25A/C等[10-12,27-28].
Chk2 [13]可通过调控DNA修复和细胞存亡来调节细胞周期进程[14]. Chk2是保持细胞G1/S关卡完整性的关键信使, 他通过快速放大从DNA损伤到关卡效应因子的信号传导, 来延迟G1/S期进程和激活DNA修复. G1/S关卡调控机制通过ATM/ATR-Chk2-CDC25A关卡通路作用于下游效应因子来诱导快速的G1/S细胞周期阻滞[15-16]. 做为对外界刺激的反应, 上游信号传导激酶ATM/ATR激活Chk2, Chk2活化后, 以关卡通路的下游效应物为靶点, 沿多个通路传导关卡信号, 最终引起细胞周期在G1/S期阻滞, 激活DNA修复, 在细胞损伤严重的情况下, 诱导细胞凋亡坏死[17]. 目前已证实P21WAF1是Chk2的一个重要的下游关卡效应因子[15]. 研究表明Chk2是一个肿瘤抑制因子, Li-Fraumeni Syndrome横纹肌肉瘤家族均携带有突变的Chk2基因[18].
CyclinD1 是参与细胞周期G1/S关卡转换的重要正性调节因子, 他在肿瘤细胞中的过度表达使细胞周期G1/S转换时间缩短, 进而促进细胞周期进程和细胞过度增生, 加速其分裂进程[2]. CyclinD1基因同时又是一种弱致癌基因, 可与多种癌基因协同促进细胞转化, 其临床意义与肿瘤类型密切相关[19]. 在正常细胞中CyclinD1受严格控制, 这是由于CDK抑制蛋白(cyclin-dependent kinase inhibitor, CKI)的抑制作用所致. P21WAF1是CKI家族最重要的成员之一, 是CyclinD1的主要抑制因子以及 G1/S期关卡的重要调控因子, 现认为他可通过抑制Cyclin/CDK复合体, 阻滞DNA损伤后的细胞周期进程[20], 使细胞周期阻滞于G1期以实现对G1/S期的调节[21]. 他的G1期关卡调节因子的关键性已被另外一项研究证实: 作为对外来应激的细胞反应, g射线照射可引起表达p21WAF1的细胞G1期停滞, 但对缺乏p21 WAF1表达的细胞则不能发挥周期阻滞作用[22]. 肿瘤细胞的CKI-Cyclin-CDK调控机制在G1/S关卡存在不同程度的缺陷, 可表现为P21WAF1-CyclinD1-CDK调控机制失常[29-32]. 我们也发现SW480细胞在PDT处理前P21WAF1蛋白阳性表达较弱, CyclinD1则呈强表达, 而在PDT处理后二者呈相反的变化趋势.
PDT对肿瘤细胞的G0-G1期周期阻滞作用, 与G1/S关卡调控因子的变化均表现出相同的时间依赖方式. PDT作用后Chk2和P21WAF1的蛋白表达呈逐渐增高趋势, 而CyclinD1的蛋白水平表达呈渐下降趋势, 表明PDT对SW480细胞的G0-G1期周期阻滞作用与对G1/S关卡调控因子的调节密切相关. 综合实验结果可以初步推测: PDT处理后, PDT产生的光化学反应可能通过损伤肿瘤细胞DNA诱导了G1关卡负向调控因子Chk2和P21WAF1的表达, 从而激活了ATM/ATR-Chk2-P21WAF1关卡通路, 肿瘤细胞在一定程度上恢复了G1/S关卡调控机制, 活化的Chk2激活p21WAF1等下游效应因子, P21WAF1通过抑制CyclinD1与CDK的结合来诱导快速的G1/S细胞周期阻滞, 使其发生坏死或凋亡.
| 1. | Ahmad N, Feyes DK, Agarwal R, Mukhtar H. Photodynamic therapy results in induction of WAF1/CIP1/P21 leading to cell cycle arrest and apoptosis. Proc Natl Acad Sci USA. 1998;95:6977-6982. [PubMed] [DOI] |
| 2. | Bartek J, Lukas J. Pathways governing G1/S transition and their response to DNA damage. FEBS Lett. 2001;490:117-122. [PubMed] [DOI] |
| 3. | Ren QG, Wu SM, Peng Q, Chen JY. Comparison of 5-aminolevulinic acid and its hexylester mediated photodynamic action on human hepatoma cells. Shengwu Huaxue Yu Shengwu Wuli Xuebao (Shanghai). 2002;34:650-654. [PubMed] |
| 4. | Wyld L, Reed MW, Brown NJ. Differential cell death response to photodynamic therapy is dependent on dose and cell type. Br J Cancer. 2001;84:1384-1386. [PubMed] [DOI] |
| 5. | Fisher AM, Ferrario A, Rucker N, Zhang S, Gomer CJ. Photodynamic therapy sensitivity is not altered in human tumor cells after abrogation of p53 function. Cancer Res. 1999;59:331-335. [PubMed] |
| 7. | Elledge SJ. Cell cycle checkpoints: preventing an identity crisis. Science. 1996;274:1664-1672. [PubMed] [DOI] |
| 8. | Zhou BB, Bartek J. Targeting the checkpoint kinases: chemosensitization versus chemoprotection. Nat Rev Cancer. 2004;4:216-225. [PubMed] [DOI] |
| 9. | Zhou BB, Elledge SJ. The DNA damage response: putting checkpoints in perspective. Nature. 2000;408:433-439. [PubMed] [DOI] |
| 10. | Bernstein C, Bernstein H, Payne CM, Garewal H. DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis. Mutat Res. 2002;511:145-178. [PubMed] [DOI] |
| 11. | Ibrahim SO, Lillehaug JR, Vasstrand EN. Mutations of the cell cycle regulatory genes p16INK4A and p21WAF1 and the metastasis-inducing gene S100A4 are infrequent and unrelated to p53 tumour suppressor gene status and data on survival in oropharyngeal squamous cell carcinomas. Anticancer Res. 2003;23:4593-4600. [PubMed] |
| 12. | Pichierri P, Rosselli F. The DNA crosslink-induced S-phase checkpoint depends on ATR-CHK1 and ATR-NBS1-FANCD2 pathways. EMBO J. 2004;23:1178-1187. [PubMed] [DOI] |
| 13. | Zhang J, Willers H, Feng Z, Ghosh JC, Kim S, Weaver DT, Chung JH, Powell SN, Xia F. Chk2 phosphorylation of BRCA1 regulates DNA double-strand break repair. Mol Cell Biol. 2004;24:708-718. [PubMed] [DOI] |
| 14. | Falck J, Petrini JH, Williams BR, Lukas J, Bartek J. The DNA damage-dependent intra-S phase checkpoint is regulated by parallel pathways. Nat Genet. 2002;30:290-294. [PubMed] [DOI] |
| 15. | Hirao A, Kong YY, Matsuoka S, Wakeham A, Ruland J, Yoshida H, Liu D, Elledge SJ, Mak TW. DNA damage-induced activation of p53 by the checkpoint kinase Chk2. Science. 2000;287:1824-1827. [PubMed] [DOI] |
| 16. | Falck J, Mailand N, Syljuåsen RG, Bartek J, Lukas J. The ATM-Chk2-Cdc25A checkpoint pathway guards against radioresistant DNA synthesis. Nature. 2001;410:842-847. [PubMed] [DOI] |
| 17. | McGowan CH. Checking in on Cds1 (Chk2): A checkpoint kinase and tumor suppressor. Bioessays. 2002;24:502-511. [PubMed] [DOI] |
| 18. | Hirao A, Cheung A, Duncan G, Girard PM, Elia AJ, Wakeham A, Okada H, Sarkissian T, Wong JA, Sakai T. Chk2 is a tumor suppressor that regulates apoptosis in both an ataxia telangiectasia mutated (ATM)-dependent and an ATM-independent manner. Mol Cell Biol. 2002;22:6521-6532. [PubMed] [DOI] |
| 19. | Gugger M, Kappeler A, Vonlanthen S, Altermatt HJ, Ris HB, Lardinois D, Borner MM, Heighway J, Betticher DC. Alterations of cell cycle regulators are less frequent in advanced non-small cell lung cancer than in resectable tumours. Lung Cancer. 2001;33:229-239. [PubMed] [DOI] |
| 20. | Campanini F, Santucci MA, Brusa G, Pattacini L, Arpinati M, Rondelli D, Gamberi B, Barbieri E, Babini L, Tura S. Expression of P21(WAF1/CIP1/SID1) cyclin-dependent kinase inhibitor in hematopoietic progenitor cells. Gene. 2001;273:173-180. [PubMed] [DOI] |
| 21. | Owa T, Yoshino H, Yoshimatsu K, Nagasu T. Cell cycle regulation in the G1 phase: a promising target for the development of new chemotherapeutic anticancer agents. Curr Med Chem. 2001;8:1487-1503. [PubMed] [DOI] |
| 22. | Deng C, Zhang P, Harper JW, Elledge SJ, Leder P. Mice lacking p21CIP1/WAF1 undergo normal development, but are defective in G1 checkpoint control. Cell. 1995;82:675-684. [PubMed] [DOI] |
| 27. | Yang J, Xu ZP, Huang Y, Hamrick HE, Duerksen-Hughes PJ, Yu YN. ATM and ATR: sensing DNA damage. World J Gastroenterol. 2004;10:155-160. [PubMed] |
| 28. | Zhu KQ, Zhang SJ. Involvement of ATM/ATR-p38 MAPK cascade in MNNG induced G1-S arrest. World J Gastroenterol. 2003;9:2073-2077. [PubMed] [DOI] |
| 29. | Li GQ, Li H, Zhang HF. Mad2 and p53 expression profiles in colorectal cancer and its clinical significance. World J Gastroenterol. 2003;9:1972-1975. [PubMed] [DOI] |
| 30. | Dong ML, Zhu YC, Hopkins JV. Oil A induces apoptosis of pancreatic cancer cells via caspase activation, redistribution of cell cycle and GADD expression. World J Gastroenterol. 2003;9:2745-2750. [PubMed] [DOI] |
| 31. | Shao JC, Wu JF, Wang DB, Qin R, Zhang H. Relationship between the expression of human telomerase reverse transcriptase gene and cell cycle regulators in gastric cancer and its significance. World J Gastroenterol. 2003;9:427-431. [PubMed] [DOI] |
| 32. | Yu L, Sun ZJ, Wu SL, Pan CE. Effect of resveratrol on cell cycle proteins in murine transplantable liver cancer. World J Gastroenterol. 2003;9:2341-2343. [PubMed] [DOI] |