修回日期: 2003-12-09
接受日期: 2003-12-29
在线出版日期: 2004-05-15
目的: 探讨吲哚美辛(indomethacin, IN)、顺铂(cisplatin, CDDP)对胃癌细胞株MGC803凋亡的影响, 为寻求新的胃癌治疗策略提供理论依据.
方法: MGC803细胞经IN、CDDP处理后, 用MTT法检测药物对细胞增生的抑制; 荧光染色检测细胞凋亡率; 流式细胞仪测定细胞周期.
结果: IN、CDDP均可抑制MGC803细胞的增生、并诱导其凋亡; IN对胃癌细胞系MGC803的作用有较强的量效和时效依赖关系; 高浓度的CDDP (10 mg/L)对此胃癌细胞系有较强的时效依赖关系, 而低浓度的CDDP (0.1 mg/L, 1 mg/L)在作用24 h后, 由于肿瘤细胞的耐药机制, 细胞凋亡率不再发生改变; 中等剂量IN(200 umoL/L)加各种浓度CDDP对此胃癌细胞系也有较强的量效和时效依赖关系, 且加IN后, 低浓度的顺铂诱导凋亡作用接近于单独作用组高浓度顺铂的效用.
结论: 吲哚美辛与顺铂对胃癌细胞株MGC803有协同作用, IN可能能够对抗胃癌对化疗药物的耐药.
引文著录: 牛小平, 袁伟建, 张桂英. 吲哚美辛和、或顺铂对胃癌细胞凋亡的影响. 世界华人消化杂志 2004; 12(5): 1021-1024
Revised: December 9, 2003
Accepted: December 29, 2003
Published online: May 15, 2004
AIM: To investigate the effects of indomethacin (IN) and casplain (CDDP) on apoptosis of gastric cancer cell line MGC803 and to provide the theoretic basis for gastric cancer therapy.
METHODS: Gastric cancer MGC803 cells were treated with IN and /or CDDP. Proliferation of the cells was detected by using MTT assay. Apoptosis of cells was measured by using fluorescence staining, and cell cycle kinetics by flow cytometry.
RESULTS: Both IN and CDDP were able to restrain the proliferation and induce apoptosis of the cells. There was dose-dependent and time-dependent cell proliferation induced by IN. High concentration of CDDP (10 mg/L) had also the time-effect, but a low dose of CDDP (0.1, 1 mg/L) did not. The percentage of apoptotic cells did not changed after 24h incubation with a low dose of CDDP. There also existed good dose-dependent and time-dependent effects when every concentration of CDDP combined with moderate dose IN (200 mmol/L). Low dose CDDP with IN had the similar effect to that of high dose CDDP alone.
CONCLUSION: IN and CDDP have the synergistic action when they work together on gastric cancer cell line MGC-803 and perhaps IN can antagonize the chemo-resistance of gastric cancer to other chemical drugs.
- Citation: Niu XP, Yuan WJ, Zhang GY. Effects of indomethacin and/or casplatin on apoptosis of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1021-1024
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1021.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1021
细胞凋亡是一种不同于坏死的生理性死亡方式, 他与胃癌的发生、发展以及对放化疗的敏感性密切相关[1-4], 研究表明, 大多数化疗药物的主要作用机制在于诱导敏感靶细胞发生凋亡, 对化疗耐药的肿瘤细胞, 其耐药机制除了肿瘤细胞能过度表达mdrl编码的P糖蛋白增加药物排出外, 还在于能抵抗药物诱导的凋亡[5-11]. 近年来的研究表明, 非甾体抗炎药(NSAID)对恶性肿瘤尤其是消化系统肿瘤有较好的作用, 其可能机制: 抑制环氧化酶2(COX-2)、诱导细胞凋亡、抗血管生成等[12-19]. NSAID对结直肠癌的防治从流行病学观察、动物实验及体外研究均已得到证实[20-22], 而对于胃癌, 这方面的研究尚处于初始阶段. 诱导癌细胞凋亡是NSAID与细胞毒性药物抗肿瘤共有的作用机制, 二者联合应用可能具有协同作用, 这一点已有人在肝细胞癌的动物实验中得到证实[23]. 我们通过MTT、流式细胞仪、荧光染色等方法, 观察吲哚美辛(IN)、顺铂(CDDP)在体外对胃癌细胞株MGC-803凋亡的影响, 并探讨其可能作用机制, 为寻求新的胃癌治疗策略提供试验室依据.
人胃癌细胞系MGC803购自湘雅医学院细胞中心; 主要试剂: RPMI1640培养液(GibcoBRL公司), 小牛血清(杭州四季青公司), 噻唑蓝(MTT, Sigma), 溴乙定(EB, Sigma), 丫啶橙(AO, Sigma), 顺铂(山东齐鲁制药厂, 培养基溶), 吲哚美辛(Sigma, 二甲基亚砜溶, 培养基稀释)
MGC803培养于含100 mL/L灭活小牛血清的RPMI1640培养液中, 置37 ℃, 50 mL/L的CO2培养箱内培养.
1.2.1 药物对细胞增生的影响: 以5×103/孔接种MGC803细胞于96孔培养板, 每孔设3个复孔, 与终浓度分别为CDDP 0.1, 1.0, 10.0 mg/L; IN(1)50, 100, 200 mmol/L; 中等剂量IN (200 mmol/L)+上述各种浓度CDDP(空白对照:培养基加生理盐水, 试验对照:MGC803细胞加生理盐水). 分别共同孵育12, 24, 48, 72 h后, 每孔加20 mL的MTT, 继续培养4 h, 弃上清, 加150 mL二甲基亚砜(DMSO)使MTT结晶完全溶解, 酶联免疫检测分析仪测定570 nm处的吸光度A值(A570nm), 并计算该浓度下的抑制率=[(对照组A570nm-试验组A570nm)/对照组A570nm]×100%, 根据回归计算各组半抑浓度.
1.2.2 药物对细胞周期的影响: 将终浓度分别为CDDP 0.1, 1.0 mg/L, 10.0 mg/L; IN50, 100, 200 mmoL/L, 与MGC803细胞共同作用48 h后, 常规消化细胞, 离心, PBS洗2次, 每管加入700 mL/L的冰乙醇1-1.5 mL, 使每个样品含细胞数至少106个, -20 ℃固定3 d后, 经流式细胞仪测定细胞周期中不同时相的细胞数.
1.2.3 药物对细胞凋亡的作用: 将细胞与终浓度分别为CDDP0.1, 1, 10.0 mg/L; IN50, 100, 200 mmol/L; IN(200 mmoL/L )+上述各浓度的CDDP组分别作用12, 24, 48 h, 将各组细胞全部收集离心, 弃上清加入PBS洗3次, 分别制成细胞悬液, 加入终浓度均为100 mg/L的AO, EB, 充分混匀, 滴于玻片上, 分别计数至少200个细胞的凋亡比率. 早期凋亡细胞核染色质着绿色, 呈固缩状或圆珠状. 晚期凋亡细胞核染色质着桔红色, 呈固缩状或破裂状. 坏死细胞核染色质着桔红色, 呈正常细胞结构. 活细胞核染色质着绿色, 呈正常细胞结构[24].
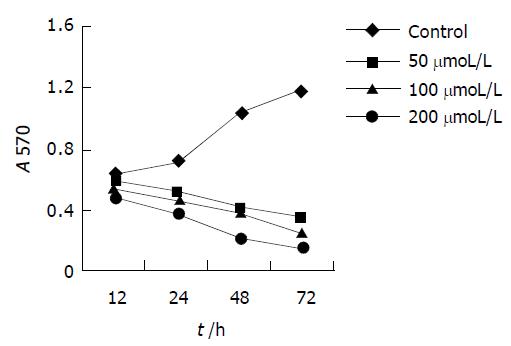
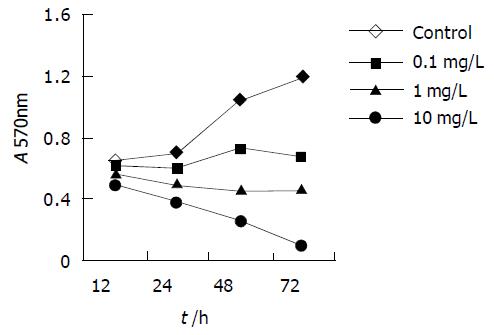
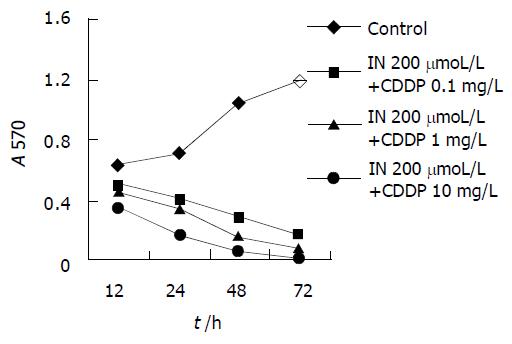
MTT法测定各组药物对MGC803细胞株抑制作用, 并绘制时效依赖曲线. 各浓度IN对胃癌细胞株MGC803的作用具有时间依赖性, 随着时间的延长, 吸光值减少, 表明活细胞数减少, 细胞增生受抑(图1). 除高浓度(10.0 mg/L)的CDDP组曲线有明显的持续下降趋势外, 低浓度 (0.1, 1.0 mg/L) 的CDDP组两条曲线在作用24 h后均无明显下降趋势(图2). 200 mmoL/L的IN加各浓度的CDDP后各条曲线均可看到明显的持续下降趋势(图3).
MGC803细胞经不同浓度的IN、CDDP作用48 h后, 细胞周期均发生明显的改变. IN作用后表现为, G0/G1期细胞比例增加, S期及G2/M期下降; CDDP作用后表现为, S期增加, G2/M期下降. CDDP和IN对细胞周期的影响均具有明显的量效依赖关系(表1-2).
| 浓度(mmol/L) | G0/G1 | S | G2/M |
| 0 | 0.58 | 0.30 | 0.11 |
| 50 | 0.67 | 0.23 | 0.10 |
| 100 | 0.72 | 0.18 | 0.09 |
| 200 | 0.80 | 0.15 | 0.04 |
| 浓度(mg/L) | G0/G1 | S | G2/M |
| 0 | 0.58 | 0.30 | 0.11 |
| 0.1 | 0.51 | 0.38 | 0.12 |
| 10 | 0.51 | 0.40 | 0.08 |
| 100 | 0.53 | 0.47 | 0.00 |
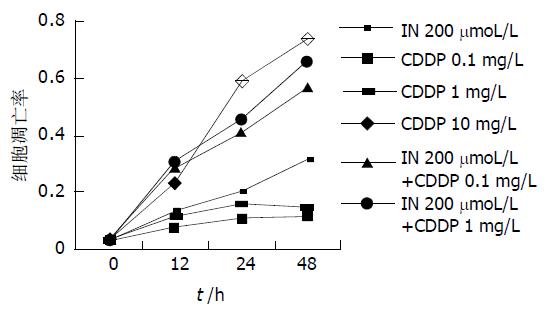
荧光染色计算凋亡细胞数可发现, IN对MGC803细胞凋亡具有明显的浓度、时间依赖性, 随着药物浓度的增加及时间的延长, 凋亡率明显增加. 高浓度的CDDP细胞凋亡率随时间明显增加, 而低浓度的CDDP (0.1, 1 mg/L)作用于胃癌细胞24 h后, 细胞凋亡率不再发生改变. 中等剂量的IN (200 mmol/L)加各浓度的顺铂作用后, 凋亡率随时间明显增加, IN加小剂量的CDDP后, 细胞凋亡率接近于较大剂量顺铂(图4).
胃癌化学治疗的主要作用机制为诱导肿瘤细胞凋亡, 诱导凋亡能力的强弱与化疗敏感性密切相关, 在化疗基础上辅以促凋亡药物可显著提高胃癌的化疗敏感性[25]. NSAID长期用于风湿、类风湿疾病的治疗, 近些年研究表明, 常规服用NSAID可显著降低消化系统恶性肿瘤的发病率和死亡率. 诱导癌细胞凋亡是NSAID与细胞毒性药物抗肿瘤共有的作用机制, 在常规化疗基础上辅以NSAID可增强治疗效果, 这在结肠癌的体内、体外试验中均已得到证实[26]. Ogino et al[27]通过对子宫颈癌细胞的体外研究发现, IN对CDDP, 5-FU等化疗药物具有增效作用, 这些化疗药物与IN合用后, 其在细胞内的浓度与未加IN组相比, 明显增加. 也有人通过对胶质瘤、肺癌的研究发现, 虽然IN可增加其他一些化疗药物如阿霉素、长春新碱等的细胞毒作用, 但对CDDP无影响. 我们采用体外细胞培养的方法, 观察IN、CDDP对胃癌细胞株MGC803增生和凋亡的影响. 研究发现, IN对CDDP具有协同、增效作用; 经IN处理的MGC803细胞, 生长明显受抑, 其抑制率与IN的浓度和作用时间有相关性, 表明IN能有效地抑制MGC803细胞的生长, 提示可能会在胃癌的治疗中发挥作用. 经CDDP处理的MGC803细胞, 高浓度组(10 mg/L)有较好的时间相关性, 低浓度组(0.1, 1 mg/L)在药物作用24 h后, 对细胞增生的抑制作用逐渐丧失, 这可能与肿瘤细胞的耐药机制有关. CDDP加IN处理后, 有较好的时效、浓度相关性, 且小剂量CDDP加IN后, 接近于大剂量CDDP的效用, IN对CDDP具有协同、增效作用, 这与上述文献报道基本一致.
近些年来的研究表明, 某些肿瘤细胞凋亡存在细胞周期的特异性, 表现为不同因素诱导的细胞凋亡发生在细胞周期的不同时相, 这类细胞凋亡的发生, 往往是细胞先被阻滞在细胞周期的某一时相, 然后发生细胞凋亡. 许多抗肿瘤药物正是通过诱导细胞周期特异性细胞凋亡, 达到治疗目的的. 我们的研究发现, IN处理后的胃癌细胞株MGC803, 经流式细胞仪检测发现, 细胞周期发生了变化, 其中 G0/G1期细胞比例增加, S期及G2/M期下降, 说明IN作用在S期和G2/M期, 使G0/G1期细胞堆积,这与有关文献研究结果相一致[28-29]. MGC803细胞经CDDP处理后, S期增加, G2/M期下降, 说明细胞受阻于S期, 不能进入G2/M期. IN和CDDP分别作用于MGC803细胞周期的不同位点, 可能是IN对CDDP具有协同、增效作用原因之一.
肿瘤细胞对CDDP的耐药机制目前尚不十分清楚, 有研究表明, 化疗药物产生耐药的原因之一是化疗药物接触肿瘤细胞后可诱导肿瘤细胞COX-2表达增加,进而诱导抗凋亡基因Bcl-2的表达. 在传统的化疗方案中联合应用NSAID可阻断这一耐药机制, 提高化疗疗效. Zhou et al[30]报道了IN尚可通过上调胃癌细胞bax、bak 的表达以及激活caspase-3而发挥抗肿瘤效果. 新近研究还表明, 胃癌细胞对CDDP的耐药机制之一是CDDP可诱导凋亡抑制基因家族(IAP)的新成员survivin的表达增加[31-32]. 本研究显示, 随着作用时间的延长, MGC803细胞对低剂量的CDDP易产生耐药, 而低剂量CDDP加IN后, 抑制胃癌细胞增生、诱导凋亡作用明显增加,接近于大剂量CDDP. 这可能与IN能够拮抗化疗药物诱导COX-2的表达有关. 此外, IN是否能抑制胃癌细胞survivin的表达, 尚有待于进一步研究.
总之, 本实验发现IN能有效抑制胃癌细胞株MGC803的增生, 对CDDP有协同、增效作用, 能有效地克服胃癌细胞对低浓度CDDP的耐药的发生, 且IN价格低廉, 药源充分, 深入研究其作用机制和体内抗癌剂量, 以减少化疗药物的用量、提高疗效、减少药物的毒副作用, 无疑具有重大的临床意义.
| 1. | Xia HH, Talley NJ. Apoptosis in gastric epithelium induced by Helicobacter pylori infection: implications in gastric carcinogenesis. Am J Gastroenterol. 2001;96:16-26. [PubMed] [DOI] |
| 2. | Wu K, Li Y, Zhao Y, Shan YJ, Xia W, Yu WP, Zhao L. Roles of Fas signaling pathway in vitamin E succinate-induced apoptosis in human gastric cancer SGC-7901 cells. World J Gastroenterol. 2002;8:982-986. [PubMed] [DOI] |
| 3. | Liu LX, Liu ZH, Jiang HC, Qu X, Zhang WH, Wu LF, Zhu AL, Wang XQ, Wu M. Profiling of differentially expressed genes in human gastric carcinoma by cDNA expression array. World J Gastroenterol. 2002;8:580-585. [PubMed] [DOI] |
| 4. | Zhou HB, Zhu JR. Paclitaxel induces apoptosis in human gastric carcinoma cells. World J Gastroenterol. 2003;9:442-445. [PubMed] [DOI] |
| 6. | Yang JY, Luo HY, Lin QY, Liu ZM, Yan LN, Lin P, Zhang J, Lei S. Subcellular daunorubicin distribution and its relation to multidrug resistance phenotype in drug-resistant cell line SMMC-7721/R. World J Gastroenterol. 2002;8:644-649. [PubMed] [DOI] |
| 7. | Wang H, Chen XP, Qiu FZ. Overcoming multi-drug resistance by anti-MDR1 ribozyme. World J Gastroenterol. 2003;9:1444-1449. [PubMed] |
| 8. | Nakamura M, Tsuji N, Asanuma K, Kobayashi D, Yagihashi A, Hirata K, Torigoe T, Sato N, Watanabe N. Survivin as a predictor of cis-diamminedichloroplatinum sensitivity in gastric cancer patients. Cancer Sci. 2004;95:44-51. [PubMed] [DOI] |
| 9. | Soengas MS, Lowe SW. Apoptosis and melanoma chemoresistance. Oncogene. 2003;22:3138-3151. [PubMed] [DOI] |
| 10. | Chang Q, Liu ZR, Wang DY, Kumar M, Chen YB, Qin RY. Survivin expression induced by doxorubicin in cholangiocarcinoma. World J Gastroenterol. 2004;10:415-418. [PubMed] |
| 11. | Zaffaroni N, Pennati M, Colella G, Perego P, Supino R, Gatti L, Pilotti S, Zunino F, Daidone MG. Expression of the anti-apoptotic gene survivin correlates with taxol resistance in human ovarian cancer. Cell Mol Life Sci. 2002;59:1406-1412. [PubMed] [DOI] |
| 13. | Leng J, Han C, Demetris AJ, Michalopoulos GK, Wu T. Cyclooxygenase-2 promotes hepatocellular carcinoma cell growth through Akt activation: evidence for Akt inhibition in celecoxib-induced apoptosis. Hepatology. 2003;38:756-768. [PubMed] [DOI] |
| 14. | Wu YL, Sun B, Zhang XJ, Wang SN, He HY, Qiao MM, Zhong J, Xu JY. Growth inhibition and apoptosis induction of Sulindac on Human gastric cancer cells. World J Gastroenterol. 2001;7:796-800. [PubMed] [DOI] |
| 15. | Tian G, Yu JP, Luo HS, Yu BP, Yue H, Li JY, Mei Q. Effect of nimesulide on proliferation and apoptosis of human hepatoma SMMC-7721 cells. World J Gastroenterol. 2002;8:483-487. [PubMed] [DOI] |
| 16. | Wu GS, Zou SQ, Liu ZR, Tang ZH, Wang JH. Celecoxib inhibits proliferation and induces apoptosis via prostaglandin E2 pathway in human cholangiocarcinoma cell lines. World J Gastroenterol. 2003;9:1302-1306. [PubMed] [DOI] |
| 17. | Amin R, Kamitani H, Sultana H, Taniura S, Islam A, Sho A, Ishibashi M, Eling TE, Watanabe T. Aspirin and indomethacin exhibit antiproliferative effects and induce apoptosis in T98G human glioblastoma cells. Neurol Res. 2003;25:370-376. [PubMed] [DOI] |
| 18. | Moody TW, Leyton J, Zakowicz H, Hida T, Kang Y, Jakowlew S, You L, Ozbun L, Zia H, Youngberg J. Indomethacin reduces lung adenoma number in A/J mice. Anticancer Res. 2001;21:1749-1755. [PubMed] |
| 19. | Connolly EM, Harmey JH, O'Grady T, Foley D, Roche-Nagle G, Kay E, Bouchier-Hayes DJ. Cyclo-oxygenase inhibition reduces tumour growth and metastasis in an orthotopic model of breast cancer. Br J Cancer. 2002;87:231-237. [PubMed] [DOI] |
| 20. | Ricchi P, Zarrilli R, Di Palma A, Acquaviva AM. Nonsteroidal anti-inflammatory drugs in colorectal cancer: from prevention to therapy. Br J Cancer. 2003;88:803-807. [PubMed] [DOI] |
| 21. | Falkowski M, Skogstad S, Shahzidi S, Smedsröd B, Sveinbjörnsson B. The effect of cyclooxygenase inhibitor diclofenac on experimental murine colon carcinoma. Anticancer Res. 2003;23:2303-2308. [PubMed] |
| 22. | Yamazaki R, Kusunoki N, Matsuzaki T, Hashimoto S, Kawai S. Selective cyclooxygenase-2 inhibitors show a differential ability to inhibit proliferation and induce apoptosis of colon adenocarcinoma cells. FEBS Lett. 2002;531:278-284. [PubMed] [DOI] |
| 23. | Li XH, Li XK, Cai SH, Tang FX, Zhong XY, Ren XD. Synergistic effects of nimesulide and 5-fluorouracil on tumor growth and apoptosis in the implanted hepatoma in mice. World J Gastroenterol. 2003;9:936-940. [PubMed] [DOI] |
| 26. | Hattori K, Matsushita R, Kimura K, Abe Y, Nakashima E. Synergistic effect of indomethacin with adriamycin and cisplatin on tumor growth. Biol Pharm Bull. 2001;24:1214-1217. [PubMed] [DOI] |
| 27. | Ogino M, Minoura S. Indomethacin increases the cytotoxicity of cis-platinum and 5-fluorouracil in the human uterine cervical cancer cell lines SKG-2 and HKUS by increasing the intracellular uptake of the agents. Int J Clin Oncol. 2001;6:84-89. [PubMed] [DOI] |
| 28. | Li JY, Wang XZ, Chen FL, Yu JP, Luo HS. Nimesulide inhibits proliferation via induction of apoptosis and cell cycle arrest in human gastric adenocarcinoma cell line. World J Gastroenterol. 2003;9:915-920. [PubMed] [DOI] |
| 29. | Detjen KM, Welzel M, Wiedenmann B, Rosewicz S. Nonsteroidal anti-inflammatory drugs inhibit growth of human neuroendocrine tumor cells via G1 cell-cycle arrest. Int J Cancer. 2003;107:844-853. [PubMed] [DOI] |
| 30. | Zhou XM, Wong BC, Fan XM, Zhang HB, Lin MC, Kung HF, Fan DM, Lam SK. Non-steroidal anti-inflammatory drugs induce apoptosis in gastric cancer cells through up-regulation of bax and bak. Carcinogenesis. 2001;22:1393-1397. [PubMed] [DOI] |