修回日期: 2003-10-01
接受日期: 2003-11-06
在线出版日期: 2004-04-15
目的: 探讨c-MYC与大肠癌血管生成的关系、可能机制及与临床病理特征间的关系.
方法: 采用免疫组化S-P法对50例大肠癌组织, 16例正常大肠组织的c-MYC、血管内皮生长因子(vascular endothelial growth factor, VEGF)及CD34进行检测.
结果: c-MYC与VEGF的表达之间存在显著相关性(χ2 = 9.232, P = 0.002), c-MYC、VEGF阳性组及c-MYC、VEGF双阳性组的MVD值(43.3±9.6、42.3±9.2、42.6±8.9)均显著高于c-MYC、VEGF阴性组及双阴性组的MVD值(t = 2.253、2.105、2.301, P<0.05) ; c-MYC、VEGF及双阳性组大肠癌的淋巴结转移率明显高于阴性组(x2 = 6.879、5.711, P<0.05), 且以双阳性组最高(68.9%); c-MYC、VEGF及双阳性组的阳性率随Dukes分期而增加(χ2 = 9.306、6.330、6.953, P<0.05); 而c-MYC、VEGF的阳性率与大肠癌的组织学类型及分化程度无关(P >0.05).
结论: c-MYC与大肠癌的血管生成相关, 并可能是通过VEGF引起的, 这为以c-MYC为靶点的基因治疗提供了理论依据.
引文著录: 陈立平, 邓长生, 吴江. c-MYC与大肠癌血管生成的关系及临床意义. 世界华人消化杂志 2004; 12(4): 985-987
Revised: October 1, 2003
Accepted: November 6, 2003
Published online: April 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 985-987
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.985
血管生成对肿瘤的生长、侵袭、转移起着重要作用.其出现在肿瘤发展的早期, 如没有血管生成, 肿瘤因得不到充足的血液供应而不能持续生长. c-MYC不仅在细胞的增生与生长方面发挥重要作用, 而且其还是血管生成的重要调节者[1]. 血管内皮生长因子是一个重要的血管生成因子, 在肿瘤的血管生成中发挥着重要作用.为探讨c-MYC在大肠癌血管生成中的作用、可能机制及与临床病理特征间的关系, 我们采用免疫组化方法对50例大肠癌及16例正常标本的c-MYC、VEGF、MVD进行检测, 分析c-MYC与VEGF的表达及MVD间的关系, 现报道如下:
中、晚期大肠癌标本50例, 正常大肠黏膜标本(癌旁5-10 cm)16例取自武汉大学中南医院2002/2003新鲜手术标本. 50例大肠癌中, 男24例, 女26例, 年龄最大69岁, 最小24岁, 平均年龄50.28岁.所有患者手术前均未接受放疗与化疗.根据全国大肠癌病理研究统一规范, 按组织学类型分为腺癌、黏液腺癌、印戒细胞癌; 按组织学分化程度分为高、中、低分化; 按Dukes分期分为A、B、C三期. 所有标本经100 mL/L的甲醛溶液固定, 常规石蜡包埋, 切片厚4 m. 鼠抗人c-MYC、VEGF、CD34单克隆抗体以及超敏S-P试剂盒均购自福州迈新公司.
1.2.1 超敏S-P免疫组化染色法: 一抗工作浓度为1: 50, 以乳腺癌切片作为c-MYC的阳性对照, 大肠癌切片作为VEGF的阳性对照, PBS代替一抗作为阴性对照.
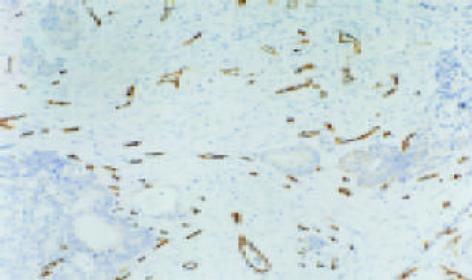
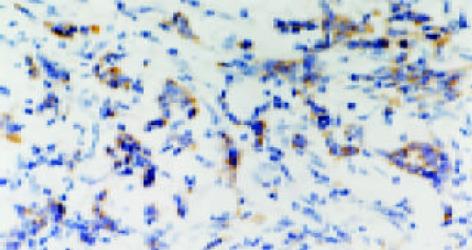
1.2.2 结果判定: MVD计数: 在光镜下计数微血管, 凡染成棕色, 明显与微血管分开的内皮细胞或内皮细胞簇也可视为微血管(图1). 先在低倍镜下找出微血管最丰富区, 在200倍视野下随机计数5个视野, 取平均数为此标本的MVD计数; 对c-MYC、VEGF, 在高倍镜(400倍)下随机数5个视野, 每视野连续数100个细胞, 数胞质或胞核染成棕黄色的细胞, 按平均率有10%以上细胞呈棕黄色定为阳性, 染色细胞数小于10%者为阴性.
统计学处理 统计分析使用SPSS11.5统计软件, 采用χ2检验、确切概率法、t检验对所得结果进行分析, P<0.05为差异有显著性.
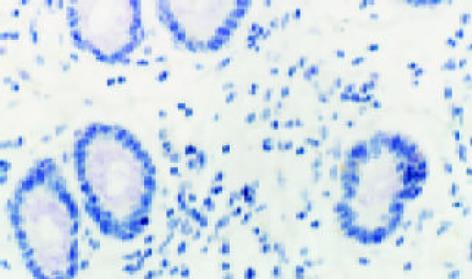
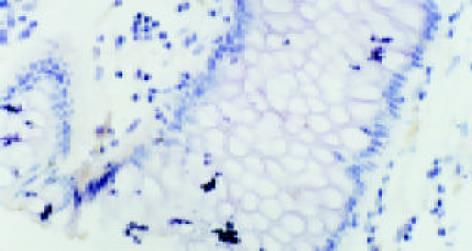
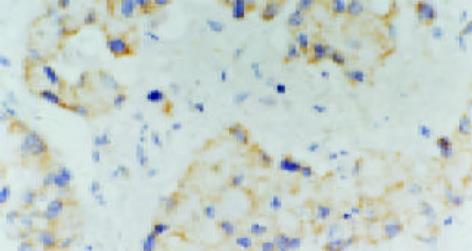
c-MYC主要位于细胞质, 少数位于细胞核(图2); VEGF的表达主要位于细胞质, 也可见于细胞膜(图3).大肠癌组织中, c-MYC表达主要位于细胞质, 也见于细胞核(图4); VEGF表达主要位于细胞质(图5). 在大多数癌组织中, c-MYC呈均一性表达, 在一些癌组织中则呈异质性表达, VEGF亦如此. 正常大肠黏膜偶见黏膜上皮细胞表达c-MYC, 但阳性细胞率低于10%; 正常大肠黏膜未见VEGF表达.在所检测的大肠癌标本中, c-MYC与VEGF的表达之间存在显著相关性(χ2=9.232, P = 0.002)(表1).
| VEGF | c-MYC | 合计 | |
| 阳性 | 阴性 | ||
| 阳性 | 29 | 10 | 39 |
| 阴性 | 2 | 9 | 11 |
| 合计 | 31 | 19 | 50 |
c-MYC、VEGF阳性组的MVD值显著高于阴性组的MVD值; 同样c-MYC、VEGF双阳性组的MVD值也显著高于双阴性组. c-MYC、VEGF阳性组大肠癌淋巴结转移率明显高于阴性组; 双阳性组大肠癌的淋巴结转移率明显高于双阴性组; 双阳性组与单阳性组的转移率之间无显著性差异, 但双阳性组的转移率高于单阳性组的转移率. 总体上, c-MYC、VEGF及双阳性组的阳性率随Dukes分期而增加, 但Dukes A、B期间的c-MYC阳性率及Dukes B、C 期间的VEGF阳性率差异无显著性, 并且双阳性组Dukes B、C 期的比率高于单阳性组; c-MYC、VEGF及双阳性组的阳性率与大肠癌的组织学类型及分化程度无关 (表2).
在许多肿瘤组织, 如大肠癌、乳腺癌、小细胞肺癌、黑色素细胞癌等组织中均能检测到癌基因产物c-MYC的表达增加, 并且其与肿瘤的侵袭性、分化及患者的预后密切相关[2-5]. 近年来, 研究人员发现c-MYC活化时也具有促进肿瘤血管生成的作用. Baudino et al[6]发现, c-MYC-/-的胚胎干细胞和卵黄囊内皮细胞VEGF表达减少, c-Myc-/-的胚胎有明显的血管生成障碍, 并且c-MYC-/-的肿瘤细胞移植到SCID鼠后, 形成的肿瘤明显减小. 此外c-MYC-/-的小鼠的表型与VEGF或其受体Flk-1缺失的小鼠相似, 并且加入VEGF能恢复c-MYC-/-的卵黄囊内皮细胞的生长缺陷.此外, Pelengaris et al[1]发现c-MYC活化的转化细胞在恶变成癌时, 能更早的形成血管及发生转移.VEGF也叫血管通透因子(VFP), 是一种强效血管生成因子, 可促进血管内皮细胞增生, 提高血管通透性, 改变细胞外基质, 从而促进血管生成. 国内外学者[7-10]研究发现VEGF与胃癌、大肠癌、肺癌等多种肿瘤的MVD、浸润、转移相关, 并且与他们的发生、发展及患者的预后密切相关.经过VEGF受体反义核酸处理的胃癌细胞在移植到裸鼠后, 癌细胞凋亡明显增加, 腹腔转移率下降; 并且人化的抗VEGF单克隆抗体(rhuMab VEGF)与常规化疗药物联合使用治疗已经发生转移的大肠癌患者, 能改善其预后, 延长患者的存活时间[11-12]. 我们的研究提示: c-MYC与VEGF的表达之间存在密切相关性, c-MYC可能不仅通过促进细胞的增生, 抑制细胞分化而在大肠癌的发生、发展中发挥作用, 而且还能经VEGF促进大肠癌血管的生成, 进而有利于大肠癌的生长、转移. 同时我们的研究还表明: 并不是所有的VEGF的表达都依赖c-MYC.已有研究[13-15]发现许多生长因子, 如表皮生长因子(EGF)、转化生长因子(TGF-β)、纤维母细胞生长因子(FGF)、组织因子(TF)等均能促进VEGF mRNA的表达, 而且c-MYC阳性的大肠癌组织, 也有少数的VEGF的表达是阴性的, 这充分说明大肠癌发生的复杂性-机体的生理功能不是基因、蛋白之间单纯的线性关系决定的, 一种基因或蛋白的表达总是受到许多基因或蛋白的调控, 且一种生理功能也可经由许多种不同的途径而产生.但在一个肿瘤患者身上, 可能某一功能的调控途径暂时是固定的, 这鼓励我们应该深入研究他们之间的关系, 从而可以为患者选择更好的个体化治疗方法.
编辑: N/A
| 1. | Pelengaris S, Khan M, Evan GI. Suppression of Myc-induced apoptosis in beta cells exposes multiple oncogenic properties of Myc and triggers carcinogenic progression. Cell. 2002;109:321-334. [PubMed] [DOI] |
| 2. | Cheah PY, Choo PH, Yao J, Eu KW, Seow-Choen F. A survival-stratification model of human colorectal carcinomas with beta-catenin and p27kip1. Cancer. 2002;95:2479-2486. [PubMed] [DOI] |
| 3. | Schlagbauer-Wadl H, Griffioen M, van Elsas A, Schrier PI, Pustelnik T, Eichler HG, Wolff K, Pehamberger H, Jansen B. Influence of increased c-Myc expression on the growth characteristics of human melanoma. J Invest Dermatol. 1999;112:332-336. [PubMed] [DOI] |
| 4. | Deming SL, Nass SJ, Dickson RB, Trock BJ. C-myc amplification in breast cancer: a meta-analysis of its occurrence and prognostic relevance. Br J Cancer. 2000;83:1688-1695. [PubMed] [DOI] |
| 5. | Volm M, Koomagi R. Prognostic relevance of c-Myc and caspase-3 for patients with non-small cell lung cancer. Oncol Rep. 2000;7:95-98. [PubMed] [DOI] |
| 6. | Baudino TA, McKay C, Pendeville-Samain H, Nilsson JA, Maclean KH, White EL, Davis AC, Ihle JN, Cleveland JL. c-Myc is essential for vasculogenesis and angiogenesis during development and tumor progression. Genes Dev. 2002;16:2530-2543. [PubMed] |
| 7. | Song ZJ, Gong P, Wu YE. Relationship between the expression of iNOS,VEGF,tumor angiogenesis and gastric cancer. World J Gastroenterol. 2002;8:591-595. [PubMed] [DOI] |
| 8. | Zheng S, Han MY, Xiao ZX, Peng JP, Dong Q. Clinical significance of vascular endothelial growth factor expression and neovascularization in colorectal carcinoma. World J Gastroenterol. 2003;9:1227-1230. [PubMed] [DOI] |
| 9. | Lee JC, Chow NH, Wang ST, Huang SM. Prognostic value of vascular endothelial growth factor expression in colorectal cancer patients. Eur J Cancer. 2000;36:748-753. [PubMed] [DOI] |
| 10. | Yuan A, Yu CJ, Chen WJ, Lin FY, Kuo SH, Luh KT, Yang PC. Correlation of total VEGF mRNA and protein expression with histologic type, tumor angiogenesis, patient survival and timing of relapse in non-small-cell lung cancer. Int J Cancer. 2000;89:475-483. [PubMed] [DOI] |
| 11. | Kamiyama M, Ichikawa Y, Ishikawa T, Chishima T, Hasegawa S, Hamaguchi Y, Nagashima Y, Miyagi Y, Mitsuhashi M, Hyndman D. VEGF receptor antisense therapy inhibits angiogenesis and peritoneal dissemination of human gastric cancer in nude mice. Cancer Gene Ther. 2002;9:197-201. [PubMed] [DOI] |
| 12. | Kabbinavar F, Hurwitz HI, Fehrenbacher L, Meropol NJ, Novotny WF, Lieberman G, Griffing S, Bergsland E. Phase II, randomized trial comparing bevacizumab plus fluorouracil (FU)/leucovorin (LV) with FU/LV alone in patients with metastatic colorectal cancer. J Clin Oncol. 2003;21:60-65. [PubMed] [DOI] |
| 13. | Seto S, Onodera H, Kaido T, Yoshikawa A, Ishigami S, Arii S, Imamura M. Tissue factor expression in human colorectal carcinoma: correlation with hepatic metastasis and impact on prognosis. Cancer. 2000;88:295-301. [PubMed] [DOI] |
| 14. | Breier G, Blum S, Peli J, Groot M, Wild C, Risau W, Reichmann E. Transforming growth factor-beta and Ras regulate the VEGF/VEGF-receptor system during tumor angiogenesis. Int J Cancer. 2002;97:142-148. [PubMed] [DOI] |