修回日期: 2003-12-01
接受日期: 2003-12-16
在线出版日期: 2004-04-15
目的: 了解甘草甜素调节白介素-18(IL-18)基因启动子的活性, 为甘草甜素的作用机制提供理论依据.
方法: 应用基因表达谱芯片技术对于甘草甜素刺激HepG2细胞之后的基因表达谱进行研究. 聚合酶链反应(PCR)扩增IL-18基因启动子, 命名为IL-18P. 以T-A克隆法, 将IL-18P基因片段连入载体pGEM-T. 将获得的质粒pT-IL-18P, 与报告质粒pCAT3-basic分别用KpnI和Bgl II 双酶切后构建IL-18启动子报告基因表达载体pCAT3-IL-18P, 以重组表达质粒pCAT3-IL-18P瞬时转染HepG2细胞, 以转染pCAT3 basic的HepG2细胞为阴性对照, 甘草甜素刺激后24 h后收获细胞. 用酶联免疫黏附法(ELISA)检测细胞中氯霉素乙酰转移酶(CAT)的表达活性.
结果: 表达谱基因芯片研究结果表明, 甘草甜素可上调IL-18基因表达水平达2.815倍. 构建的报告载体pCAT3-IL-18P经过序列分析和酶切鉴定正确. pCAT3-IL-18P和甘草甜素瞬时转染的HepG2细胞的CAT表达活性是CAT3空载体的7.7倍, pCAT3-IL-18P的1.5倍.
结论: 甘草甜素可以上调IL-18启动子的活性, 进而上调IL-18基因的表达. 为深入了解甘草甜素的免疫调节作用及其在病毒的清除过程中的作用机制提供新的理论依据.
引文著录: 王建军, 李宝伟, 成军, 刘妍, 徐志强, 杨倩, 纪冬, 党晓燕, 王春花. 表达谱基因芯片技术研究甘草甜素上调白介素-18基因的表达. 世界华人消化杂志 2004; 12(4): 855-858
Revised: December 1, 2003
Accepted: December 16, 2003
Published online: April 15, 2004
AIM: To investigate the relationship of glycyrrhizin and interleukin 18 (IL-18) gene expression and to explore the molecular biological mechanisms of glycyrrhizin in antivirus functions.
METHODS: cDNA microarray was used for the study of up-regulated gene by glycyrrhizin. Polymerase chain reaction (PCR) technique was employed to amplify the sequence of IL-18 promoter by using HepG2 cell genomic DNA as the template, named IL-18P, and the PCR product was cloned into pGEM-T vector. The IL-18P gene was cut from T-IL-18 P by KpnI and Bgl II, and then cloned into pCAT3 basic, named pCAT3- IL-18P. pCAT3-IL-18P was transfected into the HepG2 cell line and cotransfected HepG2 cells with glycyrrhizin by FuGENE 6 transfection reagents. The HepG2 cells transfected with pCAT3-basic was used as negative control. The activity of chloramphenicol acetyltransferase (CAT) in HepG2 cells transfected was detected by an enzyme-linked immunoassay (ELISA) kit after 48 h, which reflected the transactivating function of glycyrrhizin to IL-18 gene promoter.
RESULTS: The expressive vector pCAT3-IL-18P was constructed and confirmed by restriction enzyme digestion and sequencing. The expression of CAT in HepG2 cells transfected with pCAT3-IL-18P and stimulated with HepG2 was 7.7 times as higher as that of pCAT3-basic, and 1.5 times as higher as that of pCAT3-IL-18P.
CONCLUSION: HepG2 can up-regulate IL-18 gene promoter. These results provide a new evidence to explain the molecular biological mechanisms of HepG2 in immuno-regulation and antivirus.
- Citation: Wang JJ, Li BW, Cheng J, Liu Y, Xu ZQ, Yang Q, Ji D, Dang XY, Wang CH. Up-regulating effects of glycyrrhizin on interleukin-18 gene expression by cDNA microarray. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 855-858
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/855.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.855
甘草甜素(glycyrrhizin, GL), 是从甘草的根茎提取的一种有效药理成分, 由2分子的葡萄糖醛酸与甘草酸组成的复合物, 具有抗炎症及抗过敏作用. 研究表明, 甘草甜素在乙型肝炎和丙型肝炎抗病毒治疗、保护肝细胞、避免肝损害中具有重要应用前景, 并且具有潜在的抑制肝细胞肿瘤增生的作用[1]. 甘草甜素能诱导小鼠血清中细胞因子干扰素(IFN)的产生, 对巨噬细胞及自然杀伤(NK)细胞活性有显著增强作用[2], 并且选择性刺激小鼠肝内T细胞的增生[3]. 这些结果提示甘草甜素可能具有免疫调节作用. 但是这些药理学作用的分子生物学机制还不十分清楚. 本研究利用基因芯片技术筛选GL上调和下调的靶基因, 首先证实GL可以上调HepG2细胞系中的白介素-18 (IL-18)基因的表达. 采用基因重组技术构建pCAT3-IL-18P报告基因载体, 与甘草甜素共转染人肿瘤细胞系HepG2细胞, 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 测得下游CAT基因的表达增强. 证明GL可上调IL-18启动子活性, 进而上调IL-18基因的表达. IL-18又名IFN诱导因子(IGIF, IFN-inducing factor), 说明人和动物应用GL后, 首先刺激表达IL-18, 然后诱导IFN的产生, 从而达到其免疫调节的治疗作用. 这些结果为深入了解GL的免疫调节作用及其在病毒的清除过程中的作用机制提供新的理论依据.
(1)菌种及细胞株: 人肝癌细胞系HepG2细胞及大肠杆菌JM109菌株为本室保存. (2)工具酶: Tag DNA 聚合酶、T4 DNA 连接酶及限制性内切酶均购自Takara公司. (3)试剂盒: 质粒DNA提取试剂盒, 中间载体pGEM-T及报告质粒pCAT3-basic均购自Promega公司; CAT-ELISA检测试剂盒及质粒DNA转染试剂盒购自Roche公司. GL由深圳健安医药公司提供. 其他生化试剂购自Sigma公司.
由GenBank 分析的IL-18基因的转录起始位点上游选取978 bp及向下游截取186 bp设计引物. 在上下游引物的5'-端分别引入KpnI和Bgl II单一酶切位点, 上游引物P1: 5'-GGT ACC ACT CTG TAC TGG CAA AAC ACA- 3'. 下游引物P2: 5'-AGA TCT GTT CCT TTC CTC TTC CCG AAG - 3', 以HepG2细胞基因组DNA为模板, PCR扩增包含IL-18P 基因启动子全序列的DNA片段, PCR产物经1%琼脂糖凝胶电泳, 切胶, 回收纯化.
以T-A克隆法, 用T4 DNA连接酶将IL-18P基因片段连入载体pGEM-T. 将获得的质粒pTA-IL-18P 和报告质粒pCAT3-basic分别用KpnI和NheI双酶切后用T4 DNA连接酶进行定向连接, 产物转化JM109宿主菌, 筛选抗氨苄青霉素阳性菌落; 提取质粒, 再次双酶切及PCR鉴定正向插入克隆, 命名为pCAT3- IL-18P. DNA测序由上海博亚公司完成.
参照Schena等方法逆转录标记cDNA探针并纯化. Cy3-dUTP标记对照组细胞mRNA (5 g), Cy5-dUTP标记实验组细胞mRNA (5 g). 乙醇沉淀后溶解在20 L 5×SSC+0.2% SDS杂交液中.
芯片包含的1 152个cDNA由上海联合基因有限公司提供, 包括原癌基因和抑癌基因、免疫调节相关基因、细胞凋亡和应激反应蛋白相关基因、信号转导相关基因等. 以通用引物进行PCR扩增, PCR产物长度为1 000-3 000 bp. 靶基因以0.5 g/L溶解于3×SSC溶液中, 用Cartesian公司的Cartesian 7 500点样仪及TeleChem公司的硅烷化玻片进行点样. 玻片经水合(2 h)、室温干燥(30 min), UV交联, 再分别用0.2% SDS、水及0.2% 的硼氢化钠溶液处理10 min, 晾干备用.
将基因芯片和杂交探针在95 ℃水浴变性5 min, 将混合探针加在基因芯片上, 置于60 ℃杂交15-17 h. 依次以2×SSC+ 0.2% SDS、0.1%×SSC+ 0.2% SDS、0.1%×SSC洗涤10 min, 室温晾干.
用General Scanning公司的ScanArray 3 000扫描芯片. 用预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正. 用ImaGene3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值. 阳性结果判断: Cy5/Cy3>2.0, 红色荧光, 显示表达增强; Cy5/Cy3<0.5, 为绿色荧光, 显示表达减弱.
磁珠法提取质粒pCAT3- IL-18P以备转染, 以标准方案培养HepG2细胞. 具体转染方法参照转染说明书进行. 转染48 h后收集细胞, 收集细胞裂解液, 用于CAT活性检测.
在35 mm培养皿中常规培养HepG2细胞, 细胞生长至对数期时分别将甘草甜素+pCAT3-IL-18PP及pCAT3-IL-18P加入细胞培养液中, 甘草甜素终浓度为200 g/mL, 同时以转染pCAT3-Basic的HepG2细胞作阴性对照. 转染24 h后, 收集细胞裂解液, 用于CAT活性检测. 所有实验严格平行操作.
按照试剂盒说明书进行. 取1.0 ng/mL的CAT标准品(试剂盒提供)及细胞裂解液200 L加入已包被抗体的96孔板中, 37 ℃温育2 h, 再依次加入第1抗体(地高辛标记的抗-CAT)、第2抗体(偶联有过氧化物酶的地高辛抗体anti-DIG-POD) 200 L 37 ℃温育1 h后, 加入过氧化物酶的底物室温显色10-30 min. 用酶标仪检测标本在415 nm波长的吸光度, 其数值反映细胞提取物中的CAT表达水平. 以未作转染的细胞裂解液平行实验作空白对照.
在芯片上共有1 152个cDNA. 为了监控芯片杂交技术体系的整个过程, 在芯片上设置了阴性对照(8条水稻基因, 共8个点), 这些点的杂交信号均很低, 证实了数据的可靠性. 由于实验组探针标记Cy5荧光素(呈红色), 对照组探针标记Cy3荧光素(呈绿色), 红绿颜色的差异就显示该基因在实验组和对照组中基因表达水平上的差异, 黄色代表表达水平无差异. 按阳性标准, 从1 152个基因中筛选出差异表达基因共94条, 占8.15%, 其中38条基因表达增强, 56条基因表达降低. 并均在GenBank登录. 其中HepG2细胞受到甘草甜素的刺激之后, IL-18基因转录活性水平提高到2.815倍.
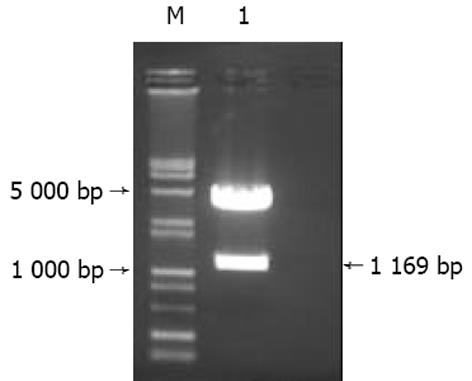
pCAT3-IL-18P鉴定电泳图谱如图1所示, 重组质粒pCAT3-IL-18P分别以KpnI/Bgl II双酶切及PCR鉴定均显示1 163 bp正向插入条带.说明重组质粒pCAT3-IL-18P构建正确.
如图2所示. 所克隆的区域包括一部分IL-18基因序列, 其中+1-40核苷酸序列是由GenBank分析的IL-18基因的转录起始位点.
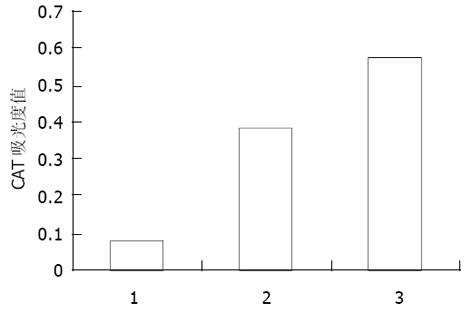
实验结果: 空载体对照组pCAT3 basic的CAT的吸光度值为0.074, pCAT3-IL-18P的CAT的吸光度值为0.385, 共转染pCAT3-IL-18P/甘草甜素的HepG2细胞CAT的吸光度值为0.575, 共转染pCAT3-IL-18P/甘草甜素的 CAT的表达明显增强, 是CAT3空载体的7.7倍, 是pCAT3-IL-18P的1.5倍, 说明甘草甜素对IL-18基因启动子有反式激活作用, 转录激活IL-18基因启动子的活性, 使其下游CAT基因的表达增强(图3).
日本米诺发医药公司(Minophagen)生产的甘草甜素注射液, 具有广泛的药理作用, 在抗炎、抗溃疡、抗过敏反应、皮肤病治疗等方面具有很好疗效. 研究表明, 甘草甜素在治疗慢性乙型、丙型肝炎病毒感染, 预防肝硬化、肝细胞癌方面同样具有明显疗效[4-7]. 甘草甜素对四氯化碳、甲基偶氮苯、扑热息痛所致肝损伤有明显保护作用, 能抑制磷酯酶A2的活性; 能诱导产生IFN和增强NK细胞活性, 保护肝细胞和激活网状内皮系统[8-11]. 甘草甜素在肝脏分解为甘草次酸和葡萄糖醛酸, 可与毒性物质结合而起解毒作用[12]. 甘草甜素具有诱导产生IFN的作用, 对单纯孢疹病毒具有特异的灭活效果; 对水痘、带状孢疹病毒复制有抑制作用[12-13]. 甘草甜素对皮质类固醇在肝内代谢失活起竞争性抑制作用, 间接提高皮质量类固醇的血中浓度而产生皮质样作用[13]. 甘草甜素可抑制纤溶酶系统的活化, 阻止血清对毛细血管渗透性的促进, 抑制膜通透性的亢进, 并且有抑制肉芽肿形成的作用, 对延迟过敏反应症也有抑制作用. 关于甘草甜素免疫调节机制的研究, 对于深入阐明甘草甜素的药理作用机制, 提高甘草甜素在慢性病毒性肝炎中的疗效, 都具有十分重要的意义.
白介素18(IL-18)最初命名为干扰素诱生因子. 他可诱生干扰素(IFN), 加强FasL介导的细胞毒效应, 增强IL-2、粒细胞巨噬细胞集落刺激因子(GM-CSF)的活性, 促进肿瘤坏死因子(TNF)、IL-1、胞间黏附分子1(IC-MA-1)、IL-8的表达, 诱生IL-4[14-15], 与IL-12的生物学功能有相近之处, 对T细胞有多种调节功能, 可以显著刺激Thl细胞产生IFN[16], 促进Thl增生及Fas介导的Thl细胞的细胞毒作用[17]. IL-18能刺激NK细胞增生、活化, 但需要与其他细胞因子组成才能发挥较强的促增生作用. Tomura et al[18]发现IL-18单独对小鼠脾脏NK细胞的促增生作用并不强, 但与IL-2或IL-12组合可以刺激NK细胞向淋巴母细胞转化, 并较强地促进NK细胞增生、活化. Takeda et al[19]的实验显示敲除IL-18基因的小鼠体内的NK细胞失去了体外活化的能力, 说明IL-18是NK的发育成熟和活化的必须细胞因子. NK细胞在肿瘤免疫中占有重要地位, 是机体抗肿瘤的第一道防线. IL-18对NK细胞抗肿瘤作用的调节, 显示了IL-18在肿瘤治疗方面较好的应用前景[20]. Seki et al[21]认为肝细胞在细菌感染时产生急性期蛋白、补体等, 枯否细胞在各种细菌刺激剂(包括脂多糖、细菌超抗原)作用下产生IL-12、IL-18, 进一步激活肝脏自然杀伤(NK)细胞、T细胞产生IFN, 对肿瘤细胞、微生物感染细胞产生细胞毒性, 在防御微生物感染和血源性肿瘤转移中起重要作用.
本研究采用基因重组技术, 自IL-18基因上游自碱基ATG上推976 bp, 以HepG2细胞基因组DNA为模板, 设计引物, PCR扩增包含IL-18 基因启动子全序列的DNA片段, 构建pCAT3-IL-18P报告基因载体, 应用报告基因氯霉素乙酰转移酶(CAT)共转染瞬时表达系统, 与甘草甜素共转染HepG2细胞, 测得共转染甘草甜素/pCAT3-IL-18P 的CAT的表达明显增强, 是CAT3空载体的7.7倍, 是pCAT3-IL-18P的1.5倍, 说明甘草甜素对IL-18基因启动子有反式激活作用, 转录激活IL-18基因的活性. 证明甘草甜素可上调IL-18启动子活性, 进而上调IL-18基因的表达, 为深入了解甘草甜素的免疫调节作用及其在病毒的清除过程中的作用机制提供新的理论依据.
编辑: N/A
| 1. | Khaksa G, Zolfaghari ME, Dehpour AR, Samadian T. Anti-inflammatory and anti-nociceptive activity of disodium glycyrrhetinic acid hemiphthalate. Planta Med. 1996;62:326-328. [PubMed] [DOI] |
| 2. | Kimura M, Watanabe H, Abo T. Selective activation of extrathymic T cells in the liver by glycyrrhizin. Biotherapy. 1992;5:167-176. [PubMed] [DOI] |
| 3. | Homma M, Oka K, Ikeshima K, Takahashi N, Niitsuma T, Fukuda T, Itoh H. Different effects of traditional Chinese medicines containing similar herbal constituents on prednisolone pharmacokinetics. J Pharm Pharmacol. 1995;47:687-692. [PubMed] [DOI] |
| 4. | Zhang YH, Isobe K, Nagase F, Lwin T, Kato M, Hamaguchi M, Yokochi T, Nakashima I. Glycyrrhizin as a promoter of the late signal transduction for interleukin-2 production by splenic lymphocytes. Immunology. 1993;79:528-534. [PubMed] |
| 5. | Zhang YH, Kato M, Isobe K, Hamaguchi M, Yokochi T, Nakashima I. Dissociated control by glycyrrhizin of proliferation and IL-2 production of murine thymocytes. Cell Immunol. 1995;162:97-104. [PubMed] [DOI] |
| 6. | Jeong HG, You HJ, Park SJ, Moon AR, Chung YC, Kang SK, Chun HK. Hepatoprotective effects of 18beta-glycyrrhetinic acid on carbon tetrachloride-induced liver injury: inhibition of cytochrome P450 2E1 expression. Pharmacol Res. 2002;46:221-227. [PubMed] [DOI] |
| 7. | Tanahashi T, Mune T, Morita H, Tanahashi H, Isomura Y, Suwa T, Daido H, Gomez-Sanchez CE, Yasuda K. Glycyrrhizic acid suppresses type 2 11 beta-hydroxysteroid dehydrogenase expression in vivo. J Steroid Biochem Mol Biol. 2002;80:441-447. [PubMed] [DOI] |
| 9. | Zheng QZ, Lou YJ. Pathologic characteristics of immunologic injury in primary cultured rat hepatocytes and protective effect of glycyrrhizin in vitro. Acta Pharmacol Sin. 2003;24:771-777. [PubMed] |
| 10. | Shimoyama Y, Sakamoto R, Akaboshi T, Tanaka M, Ohtsuki K. Characterization of secretory type IIA phospholipase A2 (sPLA2-IIA) as a glycyrrhizin (GL)-binding protein and the GL-induced inhibition of the CK-II-mediated stimulation of sPLA2-IIA activity in vitro. Biol Pharm Bull. 2001;24:1004-1008. [PubMed] [DOI] |
| 11. | Miyaji C, Miyakawa R, Watanabe H, Kawamura H, Abo T. Mechanisms underlying the activation of cytotoxic function mediated by hepatic lymphocytes following the administration of glycyrrhizin. Int Immunopharmacol. 2002;2:1079-1086. [PubMed] [DOI] |
| 12. | Kawakami F, Shimoyama Y, Ohtsuki K. Characterization of complement C3 as a glycyrrhizin (GL)-binding protein and the phosphorylation of C3alpha by CK-2, which is potently inhibited by GL and glycyrrhetinic acid in vitro. J Biochem. 2003;133:231-237. [PubMed] [DOI] |
| 13. | Sekizawa T, Yanagi K, Itoyama Y. Glycyrrhizin increases survival of mice with herpes simplex encephalitis. Acta Virol. 2001;45:51-54. [PubMed] |
| 14. | van Rossum TG, de Jong FH, Hop WC, Boomsma F, Schalm SW. 'Pseudo-aldosteronism' induced by intravenous glycyrrhizin treatment of chronic hepatitis C patients. J Gastroenterol Hepatol. 2001;16:789-795. [PubMed] [DOI] |
| 15. | Yoshimoto T, Tsutsui H, Tominaga K, Hoshino K, Okamura H, Akira S, Paul WE, Nakanishi K. IL-18, although antiallergic when administered with IL-12, stimulates IL-4 and histamine release by basophils. Proc Natl Acad Sci U S A. 1999;96:13962-13966. [PubMed] [DOI] |
| 16. | Okamura H, Tsutsi H, Komatsu T, Yutsudo M, Hakura A, Tanimoto T, Torigoe K, Okura T, Nukada Y, Hattori K. Cloning of a new cytokine that induces IFN-gamma production by T cells. Nature. 1995;378:88-91. [PubMed] [DOI] |
| 17. | Dao T, Ohashi K, Kayano T, Kurimoto M, Okamura H. Interferon-gamma-inducing factor, a novel cytokine, enhances Fas ligand-mediated cytotoxicity of murine T helper 1 cells. Cell Immunol. 1996;173:230-235. [PubMed] [DOI] |
| 18. | Tomura M, Zhou XY, Maruo S, Ahn HJ, Hamaoka T, Okamura H, Nakanishi K, Tanimoto T, Kurimoto M, Fujiwara H. A critical role for IL-18 in the proliferation and activation of NK1.1+ CD3- cells. J Immunol. 1998;160:4738-4746. [PubMed] |
| 19. | Takeda K, Tsutsui H, Yoshimoto T, Adachi O, Yoshida N, Kishimoto T, Okamura H, Nakanishi K, Akira S. Defective NK cell activity and Th1 response in IL-18-deficient mice. Immunity. 1998;8:383-390. [PubMed] [DOI] |
| 21. | Seki S, Habu Y, Kawamura T, Takeda K, Dobashi H, Ohkawa T, Hiraide H. The liver as a crucial organ in the first line of host defense: the roles of Kupffer cells, natural killer (NK) cells and NK1.1 Ag+ T cells in T helper 1 immune responses. Immunol Rev. 2000;174:35-46. [PubMed] [DOI] |