修回日期: 2003-12-01
接受日期: 2003-12-16
在线出版日期: 2004-04-15
目的: 用酵母双杂交技术筛选白细胞中与NSA5TP1结合蛋白的编码基因.
方法: 用多聚酶链反应(PCR)法扩增NS5ATP1基因, 连接入酵母表达载体pGBKT-7中构建诱饵质粒, 转化酵母细胞AH109并在其内表达, 然后与转化了人白细胞文库质粒的酵母细胞Y187进行配合, 在营养缺陷型培养基上进行双重筛选阳性菌落, 增菌后提出质粒, 转化入大肠杆菌(DH5), 提出质粒并测序, 进行生物信息学分析.
结果: 成功克隆出NS5ATP1基因并在酵母细胞中表达, 配合后选出在四缺(SD/-Trp-Leu-Ade-His)培养基及铺有X--半乳糖(X--gal)的四缺培养基上均能生长并变成蓝色的真阳性菌落10个, 其中2个人HLA-B27; 2个人亚砷酸盐转移子(arsA); 1个人单倍型E22i线粒体; 1个人pyrin(MEFV); 1个人肌动蛋白素1 (cofilin 1); 1个人染色体15; 1个来自RP11-353N14克隆人的DNA基因, 位于染色体17; 1个新基因.
结论: 成功克隆出NS5ATP1的结合蛋白, 为进一步研究HCV的作用提供了新线索.
引文著录: 刘敏, 成军, 张树林, 王琳, 邵清, 张健, 梁耀东. 应用酵母双杂交技术筛选白细胞cDNA文库与NS5ATP1结合蛋白基因. 世界华人消化杂志 2004; 12(4): 836-839
Revised: December 1, 2003
Accepted: December 16, 2003
Published online: April 15, 2004
AIM: To investigate the biological function of NS5ATP1 and to screen proteins in leukocytes interacting with NS5ATP1 by yeast-two hybrid.
METHODS: The NS5ATP1 gene was amplified by polymerase chain reaction (PCR) and NS5ATP1 bait plasmid was constructed by using yeast-two hybrid system 3, then the constructed vector was transformed into yeast AH109. The transformed yeast mated with yeast Y187 containing leukocytes cDNA library plasmid in 2×YPDA medium. Diploid yeast was plated on synthetic dropout nutrient medium (SD/-Trp-Leu-His-Ade) and synthetic dropout nutrient medium (SD/-Trp-Leu-His-Ade) containing x--gal for selecting two times and screening. After extracting and sequencing of plasmid from blue colonies, the results were analyzed by bioinformatics.
RESULTS: Ten colonies were sequenced, among which two colonies were human HLA-B27 mRNA, two homo sapiens arsA arsenite transporter, ATP-binding, homolog 1(bacterial) (ASNA1) gene, one homo sapiens haplotype E22i mitochondrion, one homo sapiens pyrin (MEFV) gene, one homo sapiens cofilin 1, one homo sapiens chromosome 15, one s homo sapiens chromosome 17, clone RP11-353N14, and one new gene.
CONCLUSION: Genes of NS5ATP1 interacting proteins in leukocytes are successfully cloned and the results bring some new clues for studying the biological functions of NS5ATP1 and associated proteins.
- Citation: Liu M, Cheng J, Zhang SL, Wang L, Shao Q, Zhang J, Liang YD. Screening of NS5ATP1 interacting proteins in leukocytes by yeast-two hybrid technique. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 836-839
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/836.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.836
丙型肝炎病毒(HCV)基因组为一线状单股正链RNA病毒, 属黄病毒属. 丙型肝炎病毒(HCV)的感染不仅引起急、慢性病毒性肝炎, 而且与肝纤维化、肝细胞癌的发生密切相关. 病毒性肝炎的发病机制中涉及到复杂的反式调节机制[1-2]. 肝炎病毒的反式调节机制至少包括三方面的含义: 一方面是肝炎病毒蛋白对于肝细胞基因组表达调节的反式调节, 即肝炎病毒蛋白与肝细胞基因组启动子DNA结合, 对于肝细胞基因表达谱产生影响; 第二方面是肝细胞蛋白对于肝炎病毒基因表达的反式调节; 第三方面是肝炎病毒蛋白对于肝炎病毒基因组的反式调节. 关于肝炎病毒反式调节机制的研究, 从理论可以加深对于肝炎病毒的分子生物学调节控制的深入了解, 为探索抗肝炎病毒的新技术、新疗法奠定坚实的理论基础[3]. 为了从不同的角度对HCV NS5A的反式调节基因进行验证及研究, 我们应用抑制性消减杂交技术(cDNA microarray)和分子克隆方法对HCV NS5A反式调节的靶基因成功地进行了筛选和克隆, 并将其中一新的靶基因命名为NS5ATP1[4], 为更加广泛深入地研究HCV NS5A的反式调节基因NS5ATP1, 我们用酵母双杂交技术筛选白细胞中与NS5ATP1结合蛋白基因.
Saccharomyces cerevisiae AH109酵母株、预转化的cDNA白细胞文库Y187酵母株(K1612-1)、酵母YPDA培养基、SD/-Trp培养基SD/-Leu、SD/-Trp/-Leu、SD/-Trp/-Leu/-His、SD/-Trp/-Leu/-His/-Ade、 X--半乳糖苷酶(Gal)等均购自Clontech公司, 半硫酸腺苷、醋酸锂购自Sigma公司. 复杂高效感受态(FSB), 本室自制. 大肠杆菌(DH5), 本室保存. cDNA白细胞文库插入序列扩增引物(P1: 5'-TAC CAC TAC AAT GGA TG-3', 2: 5'-TTT TCA GTA TCT ACG AT-3'合成及DNA测序由上海博亚公司承担.
1.2.1 诱饵质粒的构建及表达: PCR扩增NS5ATP1基因, 与酵母表达载体pGBKT7连接, 酶切鉴定后用醋酸锂法将pGBKT7- NS5ATP1转入酵母细胞AH109.
1.2.2 酵母白细胞文库的构建: cDNA白细胞文库进行增菌后, 提出质粒, 转化入酵母细胞(Y187), 经文库滴定, 确定文库细胞计数大于1×109细胞/mL.
1.2.3 诱饵与白细胞文库的酵母配合: 挑取在SD/-Trp选择培养基上生长转化子(计数大于1×109细胞/mL)与白细胞文库混合, 30 ℃轻摇配合过夜, 20-24 h后可见少许颗粒状物, 显微镜下可见三叶状体. 将配合产物铺板, SD/-Trp/-Leu/-His 25块、SD/-Trp/-Leu/-His/-Ade 25块. 同时进行阳性对照实验及文库滴定. 生长16 d后把长出的大于3 mm的酵母集落, 在铺有 X--半乳糖苷酶的QDO上检查-半乳糖苷酶活性, 认为在QDO培养基上生长且出现蓝色菌落的配合为阳性集落.
1.2.4 阳性质粒的克隆和分析: 挑取真正的阳性集落, 用cDNA白细胞插入序列引物做PCR扩增, 行凝胶电泳有阳性条带后按照试剂盒提供的操作指南Lyticase法提取酵母质粒. 提取的质粒以复杂冰冻高效感受态方法转化大肠杆菌, 于含有氨苄青霉素的SOB平板培养, 所获得的菌落酶切鉴定后测序. 阳性克隆DNA测序后, 提交GenBank比对, 进行生物信息学分析, 并把所获新的基因存入GenBank数据库.
利用自行设计的引物成功克隆出NS5ATP1基因, 酶切鉴定与预期片段符合后连接到用相同酶所切的pGBKT7载体中. 再次酶切鉴定结果正确. 由此表明NS5ATP1已按正确方向克隆入酵母表达载体pGBKT7中, pGBKT7-NS5ATP1诱饵质粒构建成功.
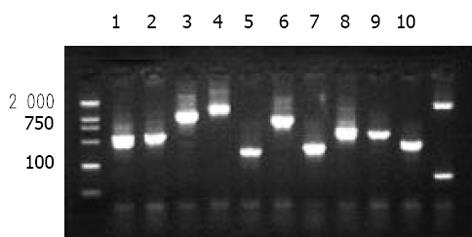
2.2 配合后cDNA筛选配合后筛选出既能在4缺(SD/-Trp/-Leu/-His/-Ade)培养基又能在铺有X--gal 的4缺培养基上生长并变成蓝色的真阳性菌落10个, 行PCR验证有插入序列, 结果见图1.
丙型肝炎病毒基因编码一多聚蛋白的前体可被宿主和病毒的蛋白酶切割产生至少10个独特的蛋白. HCV非结构蛋白5A(HCV NS5A)基因(位于6 258-7 601 bp之间)编码的56 kD的NS5A蛋白(448 aa)具有多种生物学功能, 除了参与HCV多蛋白的成熟和RNA的复制过程外, NS5A蛋白还是一种作用很强的转录激活因子, 能够影响细胞信号转导途径, 激活多种病毒及细胞基因启动子, 调控着细胞基因的转录, 与感染HCV的细胞发生恶性转化过程密切相关[5-8]. 不同磷酸化形式的NS5A蛋白具有反式激活作用也是目前关于NS5A生物学功能研究的热点, 推测NS5A蛋白的这种反式激活作用, 可能是HCV感染与肝细胞癌发生发展密切相关的重要的分子生物学机制[9-10].
我们用酵母双杂交技术对新基因NS5ATP1进行进一步研究获得10个阳性克隆. 其中人白细胞抗原2个. HCV的免疫发病机制为众多的研究所证实, 尽管血中出现HCV抗体, 但HCV仍持续感染, 考虑机体不能产生有效的免疫清除病毒[11-14]. HCV持续感染与遗传性免疫缺陷和紊乱有关[15]. 患者人白细胞抗原与HCV的基因型、疾病的预后、干扰素的疗效有关[16-17]. 本研究证实NS5A相关基因NS5ATP1可与ILA-B27结合, 可能影响机体免疫系统.
亚砷酸盐是一种强毒性和致癌物, 与三价和五价离子反应影响多种生物化学过程. 在细菌, 亚砷酸盐的解毒作用通过特有的染色体和质粒传递的操纵子编码的流出系统分别传递低水平和高水平的抗亚砷酸盐物质完成. 亚砷酸盐质粒携带的砷操纵子由两个调节基因(ArsR and ArsD)及三个结构基因(ArsA, ArsB, and ArsC)组成[18]. ArsA, 外周膜阴离子易位的ATP酶ArsAB的外周膜成分, 通过一个连接子序列相连[19]. 氧化阴离子依赖性的ATP酶由ArsA基因编码且与ArsB编码通道穿膜蛋白相关. ArsC是一种亚砷酸盐还原酶. 在大肠杆菌, ArsA与ArsB共同操纵穿膜通道, 使亚砷酸盐流出. 人源性细菌ArsA (hARSA-I) 与细菌arsA类似, 是非穿膜区ATP酶超家族的一员. Southern 和Northern分析表明在人基因有两个杂交基因且许多组织表达hARSA-I. Western分析表明交叉反应的37 kDa 和42 kDa蛋白存在于两个不同的人细胞系. hARSA-I与细菌ArsA 不同hASNA-I是亚砷酸盐诱导的而不是亚砷酸盐依赖的ATP酶, 但与细菌ArsA有一些相同的生化特性[20]. 肝脏是机体的解毒器官, HCV感染引起肝功能损伤, 毒性产物蓄积. 本研究证实NS5ATP1可与ArsA结合, 影响机体的解毒功能.
FMF是一种隐性遗传性疾病, 特征性表现是间断发作性的发热、疼痛. 典型发作持续1-3 d, 伴随病变部位大量白细胞积聚. FMF的反应基因称为MEFV, MEFV基因位于16号染色体短臂, 编码抗炎性蛋白, 他的蛋白产物称为pyrin或 marenostrin[21]. Pyrin是一种781个氨基酸的蛋白, 以组织限制性的方式存在于中性白细胞、单核细胞和嗜酸细胞及皮肤纤维组织、滑膜、和腹膜. pyrin是含PyD蛋白家族的一员, 可能与凋亡、炎症和天然免疫有关. 用酵母双杂交方法证实pyrin可与长195年a的凋亡颗粒蛋白ASC结合, ASC是一种凋亡前蛋白, 在HL-60细胞, 反叉的ASC多聚核酸可阻止抗肿瘤药依托泊甙诱导的凋亡. ASC转染细胞可形成颗粒, ASC与pyrin共转染细胞, 颗粒阳性细胞增加且存活时间延长. 免疫荧光研究显示pyrin与ASC共同定位于颗粒. 并证实pyrin在凋亡通道中有作用[22-23]. Pyrin在成熟的中性粒细胞表达, 推测具有炎性调节因子作用. 体外用炎前因子干扰素、肿瘤因子、脂多糖刺激单核细胞可诱导MEFV表达增加, 而抗炎因子IL-4、IL-10和转移生长因子抑制这种表达[24]. Mansfield et al[25]证实pyrin在白细胞细胞支架水平调节炎性反应. 本研究证实NS5ATP1与pyrin结合, 从而参与炎症反应及细胞凋亡.
肌动蛋白素(Cofilin)通过切断肌动蛋白丝和增加解聚作用在肌动蛋白动力中发挥重要作用. 肌动蛋白细胞骨架识别在许多细胞基础活动中扮演重要脚色, 包括细胞移动、黏附、形态发生和细胞动力. Cofilin的活性通过磷酸化和去磷酸化可逆调节. Cofilin调节肌动蛋白细胞骨架改型从而影响许多细胞的活性, 包括细胞能动性、黏附性和细胞分裂. 肌动蛋白的识别常常通过细胞外刺激启动, 如结合生长因子和化学吸引剂细胞表面受体和基质蛋白整合素受体. 肌动蛋白丝运动经历肌动蛋白识别, 通过几种肌动蛋白结合蛋白协同调节. 其中, cofilin和他相关的因子肌动蛋白解聚因子(ADF)结合肌动蛋白单体、丝且有效的解聚和切断肌动蛋白丝. 因此, 他们在快速转换肌动蛋白丝中有重要作用. 本研究证实NS5ATP1与肌动蛋白素结合, 影响细胞的基础活动[26-27].
尽管循环中可见到HCV抗体, 但HCV患者感染仍持续且可进展到肝癌、肝硬化. HCV不但在肝细胞复制, 而且在单核细胞、B细胞和T细胞也可复制. HCV感染外周血细胞改变免疫细胞功能, 引起无效的免疫反应在HCV发病机制中有重要作用. 我们用酵母双杂交方法筛选出NS5ATP1结合蛋白, 表明NS5ATP1在干预细胞免疫、参与炎性反应和细胞凋亡、影响细胞解毒及细胞的基础活动中有一定作用. NS5ATP1作为一个新基因其功能还需进一步研究.
编辑: N/A
| 1. | 成 军, 杨 守纯. 现代肝炎病毒分子生物学. 北京: 人民军医出版社 1997; 37-42. |
| 2. | 刘 妍, 成 军. HCV致肝细胞癌的分子生物学机制. 国外医学流行病学传染病学分册. 2000;27:10-13. |
| 5. | Kato N, Lan KH, Ono-Nita SK, Shiratori Y, Omata M. Hepatitis C virus nonstructural region 5A protein is a potent transcriptional activator. J Virol. 1997;71:8856-8859. [PubMed] |
| 6. | Kato N, Yoshida H, Ono-Nita SK, Kato J, Goto T, Otsuka M, Lan K, Matsushima K, Shiratori Y, Omata M. Activation of intracellular signaling by hepatitis B and C viruses: C-viral core is the most potent signal inducer. Hepatology. 2000;32:405-412. [PubMed] [DOI] |
| 7. | Ide Y, Zhang L, Chen M, Inchauspe G, Bahl C, Sasaguri Y, Padmanabhan R. Characterization of the nuclear localization signal and subcellular distribution of hepatitis C virus nonstructural protein NS5A. Gene. 1996;182:203-211. [PubMed] [DOI] |
| 8. | Gong GZ, Waris G, Tanveer R, Siddiqui A. Human hepatitis C virus NS5A protein alters intracellular calcium levels, induces oxidative stress, and activates STAT-3 and NF-κB. Proc Natl Acad Sci USA. 2001;98:9599-9604. [DOI] |
| 9. | Pawlotsky JM, Germanidis G. The non-structural 5A protein of hepatitis C virus. J Viral Hepat. 1999;6:343-356. [PubMed] [DOI] |
| 10. | Lan KH, Sheu ML, Hwang SJ, Yen SH, Chen SY, Wu JC, Wang YJ, Kato N, Omata M, Chang FY. HCV NS5A interacts with p53 and inhibits p53-mediated apoptosis. Oncogene. 2002;21:4801-4811. [PubMed] [DOI] |
| 11. | Urbani S, Uggeri J, Matsuura Y, Miyamura T, Penna A, Boni C, Ferrari C. Identification of immunodominant hepatitis C virus (HCV)-specific cytotoxic T-cell epitopes by stimulation with endogenously synthesized HCV antigens. Hepatology. 2001;33:1533-1543. [PubMed] [DOI] |
| 12. | Hüe S, Cacoub P, Renou C, Halfon P, Thibault V, Charlotte F, Picon M, Rifflet H, Piette JC, Pol S. Human leukocyte antigen class II alleles may contribute to the severity of hepatitis C virus-related liver disease. J Infect Dis. 2002;186:106-109. [PubMed] [DOI] |
| 13. | Penna A, Missale G, Lamonaca V, Pilli M, Mori C, Zanelli P, Cavalli A, Elia G, Ferrari C. Intrahepatic and circulating HLA class II-restricted, hepatitis C virus-specific T cells: functional characterization in patients with chronic hepatitis C. Hepatology. 2002;35:1225-1236. [PubMed] [DOI] |
| 14. | Nelson DR. The immunopathogenesis of hepatitis C virus infection. Clin Liver Dis. 2001;5:931-953. [PubMed] [DOI] |
| 15. | Isaguliants MG, Ozeretskovskaya NN. Host background factors contributing to hepatitis C virus clearance. Curr Pharm Biotechnol. 2003;4:185-193. [PubMed] [DOI] |
| 16. | Renou C, Halfon P, Pol S, Cacoub P, Jouve E, Bronowicki JP, Arpurt JP, Rifflet H, Picon M, Causse X. Histological features and HLA class II alleles in hepatitis C virus chronically infected patients with persistently normal alanine aminotransferase levels. Gut. 2002;51:585-590. [PubMed] [DOI] |
| 17. | Yu ML, Dai CY, Chen SC, Chiu CC, Lee LP, Lin ZY, Hsieh MY, Wang LY, Chuang WL, Chang WY. Human leukocyte antigen class I and II alleles and response to interferon-alpha treatment, in Taiwanese patients with chronic hepatitis C virus infection. J Infect Dis. 2003;188:62-65. [PubMed] [DOI] |
| 18. | Kurdi-Haidar B, Heath D, Aebi S, Howell SB. Biochemical characterization of the human arsenite-stimulated ATPase (hASNA-I). J Biol Chem. 1998;273:22173-22176. [PubMed] [DOI] |
| 19. | Jia H, Kaur P. Biochemical evidence for interaction between the two nucleotide binding domains of ArsA. Insights from mutants and ATP analogs. J Biol Chem. 2003;278:6603-6609. [PubMed] [DOI] |
| 20. | Kurdi-Haidar B, Aebi S, Heath D, Enns RE, Naredi P, Hom DK, Howell SB. Isolation of the ATP-binding human homolog of the arsA component of the bacterial arsenite transporter. Genomics. 1996;36:486-491. [PubMed] [DOI] |
| 22. | Richards N, Schaner P, Diaz A, Stuckey J, Shelden E, Wadhwa A, Gumucio DL. Interaction between pyrin and the apoptotic speck protein (ASC) modulates ASC-induced apoptosis. J Biol Chem. 2001;276:39320-39329. [PubMed] [DOI] |
| 23. | Fairbrother WJ, Gordon NC, Humke EW, O'Rourke KM, Starovasnik MA, Yin JP, Dixit VM. The PYRIN domain: a member of the death domain-fold superfamily. Protein Sci. 2001;10:1911-1918. [PubMed] [DOI] |
| 24. | Centola M, Wood G, Frucht DM, Galon J, Aringer M, Farrell C, Kingma DW, Horwitz ME, Mansfield E, Holland SM. The gene for familial Mediterranean fever, MEFV, is expressed in early leukocyte development and is regulated in response to inflammatory mediators. Blood. 2000;95:3223-3231. [PubMed] |
| 25. | Mansfield E, Chae JJ, Komarow HD, Brotz TM, Frucht DM, Aksentijevich I, Kastner DL. The familial Mediterranean fever protein, pyrin, associates with microtubules and colocalizes with actin filaments. Blood. 2001;98:851-859. [PubMed] [DOI] |
| 26. | Toshima J, Toshima JY, Amano T, Yang N, Narumiya S, Mizuno K. Cofilin phosphorylation by protein kinase testicular protein kinase 1 and its role in integrin-mediated actin reorganization and focal adhesion formation. Mol Biol Cell. 2001;12:1131-1145. [PubMed] [DOI] |
| 27. | Idrissi FZ, Wolf BL, Geli MI. Cofilin, but not profilin, is required for myosin-I-induced actin polymerization and the endocytic uptake in yeast. Mol Biol Cell. 2002;13:4074-4087. [PubMed] [DOI] |