修回日期: 2003-12-01
接受日期: 2003-12-16
在线出版日期: 2004-04-15
目的: 用酵母双杂交技术筛选肝细胞中与乙型肝炎病毒(HBV)前-X蛋白结合蛋白的编码基因.
方法: 用多聚酶链反应(PCR)法扩增HBV基因组中的前-X基因, 连接入酵母表达载体pGBKT-7中构建诱饵质粒, 转化酵母细胞AH109并在其内表达, 然后与转化了人肝细胞文库质粒的酵母细胞Y187进行配合, 在营养缺陷型培养基上进行双重筛选阳性菌落, 增菌后提出质粒, 转化入大肠杆菌(DH5), 提出质粒并测序, 进行生物信息学分析.
结果: 成功克隆出HBV的前-X基因, 构建表达载体并在酵母细胞中表达, 配合后选出在四重缺陷(SD/-Trp-Leu-Ade-His)培养基及铺有X--半乳糖(X--gal)的四重缺陷培养基上均能生长并变成蓝色的真阳性菌落19个, 其中5个是人铁蛋白; 1个是人的胰岛素样生长因子结合蛋白3(IGFBP3); 1个是人醛缩酶B; 1个是人糖基化磷脂酰肌醇锚定结合因子1(GPAA1); 1个是人血红素结合蛋白; 1个是人C1酯酶抑制子(C1-INH); 1个是人玻连蛋白; 1个是人电压依赖性阴离子通道1 (VDAC1); 1个是丝氨酸穿膜蛋白酶(hepsin); 1个是人梭素; 1个是人纤溶酶原(PLG); 3个是人假想蛋白; 1个是RP11-542M13克隆,位于染色体16.
结论: 成功克隆出前-X的结合蛋白, 为进一步研究HBV的前-X蛋白的作用提供了新线索.
引文著录: 刘敏, 王琳, 成军, 张树林, 邵清, 张健, 杨倩, 董菁. 应用酵母双杂交技术筛选肝细胞cDNA文库中乙型肝炎病毒前-X蛋白结合蛋白基因. 世界华人消化杂志 2004; 12(4): 790-793
Revised: December 1, 2003
Accepted: December 16, 2003
Published online: April 15, 2004
AIM: To investigate the biological function of pre-X protein encoded by hepatitis B virus (HBV) genome, and to screen proteins in hepatocytes interacting with pre-X protein by yeast-two hybrid technique.
METHODS: The pre-X gene was amplified by polymerase chain reaction (PCR) and pre-X bait plasmid was constructed by using yeast-two hybrid system 3, then the constructed vector was transformed into yeast AH109. The transformed yeast mated with yeast Y187 containing hepatocytes cDNA library plasmid in 2×YPDA medium. Diploid yeast was plated on synthetic dropout nutrient medium (SD/-Trp-Leu-His-Ade) and synthetic dropout nutrient medium (SD/-Trp-Leu-His-Ade) containing x--gal for selecting two times and screening. After extracting and sequencing of plasmid from blue colonies, the results were analyzed by bioinformatics.
RESULTS: Nineteen colonies were sequenced, in which five colonies were homo sapiens ferritin, one colonies was homo sapiens insulin-like growth factor binding protein 3 (IGFBP3), one homo sapiens aldolase B, one homo sapiens gene for glycosylphosphatidylinositol anchor attachment 1 (GAA1), one homo sapiens hemopexin, one homo sapiens C1 esterase inhibitor (C1-INH), one homo sapiens vitronectin, one homo sapiens voltage-dependent anion channel 1 (VDAC1), one hepsin (transmembrane protease, serine 1), one homo sapiens spindling, one homo sapiens plasminogen (PLG), three hypothetical proteins, and one homo sapiens chromosome 16 clone RP11-542M13.
CONCLUSION: Genes of pre-X interacting proteins in hepatocytes are successfully cloned and the results bring some new clues for studying the biological functions of pre-X and associated proteins.
- Citation: Liu M, Wang L, Cheng J, Zhang SL, Shao Q, Zhang J, Yang Q, Dong J. Screening and identification of interacting proteins with pre-X protein of hepatitis B virus in hepatocytes by yeast-two hybrid technique. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 790-793
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/790.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.790
乙型肝炎病毒(HBV)是一种嗜肝性部分双链DNA病毒, 不仅引起急、慢性病毒性肝炎, 而且与肝纤维化(LF)、肝细胞癌(HCC)的发生发展密切相关[1]. 1979年Gelibert et al[2]首次报告了HBV DNA的全基因序列并确定4个主要的开放读码框架(ORF), 分别命名为S、C、P、X区, 一直沿用至今. HBV基因组只有3.2 kb, 其结构特点是结构基因与调节基因序列之间重叠, 甚至结构基因序列之间重叠[3]. 关于这一紧密DNA结构中是否存在新的编码序列, 一直没有进行系统的研究. 最近董菁et al对于中国HBV流行株的全基因序列进行克隆和序列分析, 发现了前-前-S和前-X基因序列, 改写了HBV DNA编码基因序列研究的历史[4-7]. 病毒蛋白和肝细胞蛋白之间的作用是病毒致病的关键之一, 通过与肝细胞中的许多蛋白质的相互作用, 介导病毒进入肝细胞, 影响这些蛋白质的活性功能, 进一步调节改变细胞功能, 影响病毒复制, 造成机体免疫功能失调, 感染慢性化及肿瘤发生. 深入研究这些蛋白之间相互作用对于揭示病毒性肝炎发病机制, 寻找可能的新的治疗方法均有重要意义. 我们应用酵母双杂交技术筛选肝细胞cDNA文库中与HBV前-X蛋白结合蛋白基因, 以筛选与前-X蛋白有相互作用的蛋白, 为研究前-X的功能提供线索.
Saccharomyces cerevisiae AH109酵母株、Y187酵母株(K1612-1)、cDNA肝细胞文库等均购自Clontech公司. 酵母YPDA培养基、SD/-Trp、 SD/-Leu、SD/-Trp/-Leu、SD/-Trp/-Leu/-His、SD/-Trp/-Leu/-His/-Ade培养基, X--半乳糖苷酶(Gal)等购自Clontech公司, 半硫酸腺苷、醋酸锂购自Sigma公司. 复杂高效感受态(FSB), 本室自制. 大肠杆菌(DH5), 本室保存.
1.2.1 前-X基因PCR扩增: 根据董菁et al的研究[4], 确定前-X基因序列, 长度168 bp. 以此设计引物, 同时在引物两端加酶切位点行PCR扩增. 将扩增产物连接于pGEM-T载体, 转化DH5后提质粒行酶切鉴定、测序, 确定扩增的基因结果正确.
1.2.2 诱饵质粒的构建及表达: 构建前-X基因的酵母表达载体pGBKT7-前-X, 用醋酸锂法转入单倍体酵母细胞AH109.
1.2.3 酵母肝文库的构建: cDNA肝文库进行增菌后, 提出质粒, 转化入酵母细胞(Y187), 经文库滴定, 确定文库细胞计数大于1×109细胞/mL.
1.2.4 诱饵与肝文库的酵母配合: 挑取在SD/-Trp选择培养基上生长转化子(计数大于1×109细胞/ml)与肝细胞文库混合, 30 ℃轻摇配合过夜, 24 h后铺板SD/-Trp/-Leu/-His 25块、SD/-Trp/-Leu/-His/-Ade 25块. 同时进行阳性对照实验及文库滴定. 生长16 d后挑取生长大于3 mm的酵母集落, 在铺有 X-半乳糖苷酶的QDO上检查-半乳糖苷酶活性, 认为在QDO培养基上生长且出现蓝色菌落的配合为阳性集落.
1.2.5 阳性质粒的克隆和分析: 挑取真正的阳性集落按照试剂盒提供的操作指南Lyticase法提取酵母质粒. 提取的质粒以复杂冰冻高效感受态方法转化大肠杆菌, 于含有氨苄青霉素的SOB平板培养, 所获得的菌落酶切鉴定后测序. 阳性克隆DNA测序后, 提交GenBank比对, 进行生物信息学分析, 并把所获新的基因存入GenBank数据库.
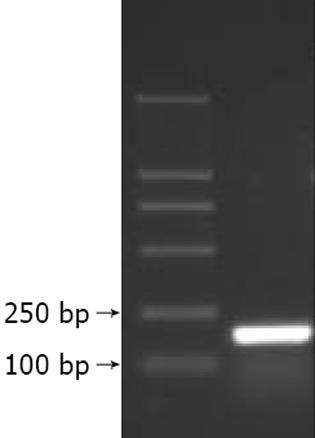
2.1 pGBKT7-前-X诱饵质粒的构建及表达 利用自行设计的引物成功克隆出前-X基因(图1), 酶切鉴定与预期片段符合后连接到用相同酶所切的pGBKT7载体中. 再次酶切鉴定结果正确. 由此表明前-X基因已按正确方向克隆入酵母表达载体pGBKT7中, pGBKT7-前-X诱饵质粒构建成功.
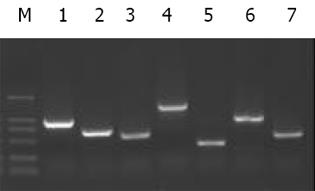
2.2 配合后cDNA筛选配合后筛选出既能在4缺(SD/-Trp/-Leu/-His/-Ade)培养基又能在铺有X--gal 的4缺培养基上生长并变成蓝色的真阳性菌落, 行PCR验证有插入序列, 结果见图2.
阳性菌落测序后, 与GenBank数据库进行初步比较. 19个均与已知基因的部分序列高度同源(98%-100%), 详细结果见表1.
| 序号 | 筛选出的目的基因 | 同源性 | 相同克隆数 |
| 1 | 人铁蛋白 | 99%-100% | 5 |
| 2 | 人胰岛素样生长因子结合蛋白3(IGFBP3) | 99% | 1 |
| 3 | 人醛缩酶B | 99% | 1 |
| 4 | 人糖基化磷脂酰肌醇锚定结合因子1(GAA1) | 99% | 1 |
| 5 | 人血红素结合蛋白 | 99% | 1 |
| 6 | 人C1酯酶抑制子(C1-INH) | 100% | 1 |
| 7 | 人玻连蛋白 | 99% | 1 |
| 8 | 人电压依赖性阴离子通道1 (VDAC1) | 98% | 1 |
| 9 | 丝氨酸穿膜蛋白酶(hepsin) | 100% | 1 |
| 10 | 人梭素 | 100% | 1 |
| 11 | 人纤溶酶原(PLG) | 98% | 1 |
| 12 | 人假想蛋白 | 99% | 3 |
| 13 | RP11-542M13克隆, 位于染色体16 | 100% | 1 |
最早在1990年Loncarevic et al[8]在对HCC患者血液HBV基因组的研究中简单介绍了前-X区的存在. Takahashi et al[9]于1995年的研究结果认为前-X区与HCC有密切关系. 1998年, Hiroi et al[10]自HCC患者体内克隆了40株HBV全序列, 其中38株为adr亚型, 之中的18株含有前-X基因, 作者综合以往的资料, 认为前-X基因与HCC有密切的关系. 但上述资料分析的患者病例数较少, 结论需要进一步推敲. 董菁et al对于中国HBV流行株的全基因序列进行克隆和序列分析, 界定了乙型肝炎病毒前-X基因区, 根据针对前-X多肽的氨基酸组成分析, 发现该区域含有多个S, 可能是磷酸化的重要区域, 与细胞内信号转导有关[4]. 关于前-X编码蛋白的功能及相互作用蛋白还需应用多种分子生物学技术从多方面研究.
酵母双杂交技术是近年来新发展起来的一种分析真核细胞中蛋白-蛋白、蛋白-DNA、蛋白-RNA相互作用的一种有效的基因分析方法. 我们应用此技术成功的筛选出前-X蛋白相互作用蛋白. 其中特别有意义的是糖基化磷脂酰肌醇糖基化磷脂酰肌醇锚定结合因子1(glycosyl phosphatidylinositol anchor attachment GAA1)、电压依赖性阴离子通道1 (VDAC1)和丝氨酸穿膜蛋白酶(Hepsin).
糖基化磷脂酰肌醇(glycosyl phosphatidylinositol GPI) 结合是蛋白锚定细胞膜表面的一般机制[10]. GPI锚定蛋白的作用是细胞与细胞间的相互作用而不是细胞生长[11]. 大多数原核细胞表面蛋白通过共价黏附GPI被锚定于细胞膜. 转录后黏附GPI是在细胞表面表达这些蛋白的基础[12]. 这种膜锚定也广泛存在于所有真核组织. 在哺乳动物细胞有100多个细胞表面蛋白存在各种大小和功能的GPI锚定位点[13]. 在内质网中GPI前体和一种蛋白前体形成GPI锚定蛋白. GPI锚定蛋白有两个信号多肽. 一个是氨基末端信号多肽直接易位穿过内质网膜. 另一个是羧基末端信号多肽直接黏附GPI锚凹. 转录后, 羧基端GPI黏附信号立即被GPI氨基转移酶识别并分离信号以GPI取代. 从F9细胞裂解GAA1, 发现GAA1是蛋白前体GPI锚凹的基础而对GPI合成无作用. 缺少GAA1, 羧基末端介导的蛋白前体和GPI氨基转移无法形成. GAA1和Gpi8p形成复合物, 所以这两个蛋白对于羧基末端介导的形成是必要的[10]. HBV 前-X蛋白与GAA1有相互作用, 推测前-X蛋白与细胞死亡对细胞转化和肿瘤发生起作用, 有研究表明C-Raf可通过调节线粒体VDAC影响细胞存活[21]. VDAC结合Ca(2+), 使Ca(2+)透过, 在调节线粒体Ca(2+)的自身稳定中有作用[14-21]. HBV 前-X与VDAC有相互作用, 推测前-X蛋白与线粒体膜蛋白可结合, 从而影响线粒体膜通透性, 与HBV感染癌变有关.
丝氨酸穿膜蛋白酶是一种51 kDa的膜相关性丝氨酸蛋白酶, 作为一种完整的膜蛋白参与细胞生长和维持合适的细胞形态. 在许多原发性肿瘤和生长分化快的细胞中有丝氨酸穿膜蛋白酶超表达, 如肝癌细胞、哺乳动物癌细胞、外周神经细胞和幼小仓鼠肾细胞中水平高, 而在人脐带和大鼠毛细血管上皮细胞测不到[22]. 肝癌细胞用抗-丝氨酸穿膜蛋白酶抗体处理后生长抑制, 推测正常细胞生长在细胞表面要有丝氨酸穿膜蛋白酶分子, 但丝氨酸穿膜蛋白酶超表达与肿瘤发生有关[23]. Chen et al[24]认为丝氨酸穿膜蛋白酶在癌前状态超表达意味着丝氨酸穿膜蛋白酶在肿瘤侵入时有作用. Wu et al[25]认为丝氨酸穿膜蛋白酶是一种II型穿膜丝氨酸蛋白酶, 肝细胞表面大量表达, 对血液凝集、肝细胞生长和受精过程有一定作用. 前-X蛋白与丝氨酸穿膜蛋白酶有相互作用, 是否与HBV癌变发生有关有待进一步研究证实.
众所周知, HBV感染与HCC发生、发展密切相关. 我们用酵母双杂交技术成功筛查出与HBV 前-X蛋白相互作用蛋白, 提示前-X蛋白与信号传导、细胞凋亡、HCC发生等关系密切, 这一部分的研究还有待进一步深入.
编辑: N/A
| 2. | Galibert F, Mandart E, Fitoussi F, Tiollais P, Charnay P. Nucleotide sequence of the hepatitis B virus genome (subtype ayw) cloned in E. coli. Nature. 1979;281:646-650. [PubMed] [DOI] |
| 3. | Cho KJ, Martel W. Recognition of splenic vein occlusion. AJR Am J Roentgenol. 1978;131:439-443. [PubMed] [DOI] |
| 6. | 杨 倩, 董 菁, 成 军, 刘 妍, 洪 源, 王 建军, 张 树林. 乙型肝炎病毒基因组中前-前-S-编码基因启动子序列的确定及转录活性的鉴定. 解放军医学杂志. 2003;28:762-764. |
| 7. | 杨 倩, 董 菁, 成 军, 刘 妍, 洪 源, 王 建军, 王 琳, 张 树林. 乙型肝炎病毒基因组中前-X-编码基因启动子序列的确定及转录活性的鉴定. 解放军医学杂志. 2003;28:765-767. |
| 8. | Loncarevic IF, Zentgraf H, Schröder CH. Sequence of a replication competent hepatitis B virus genome with a preX open reading frame. Nucleic Acids Res. 1990;18:4940. [PubMed] [DOI] |
| 9. | Takahashi K, Brotman B, Usuda S, Mishiro S, Prince AM. Full-genome sequence analyses of hepatitis B virus (HBV) strains recovered from chimpanzees infected in the wild: implications for an origin of HBV. Virology. 2000;267:58-64. [PubMed] [DOI] |
| 10. | Hiroi Y, Chen R, Sawa H, Hosoda T, Kudoh S, Kobayashi Y, Aburatani H, Nagashima K, Nagai R, Yazaki Y. Cloning of murine glycosyl phosphatidylinositol anchor attachment protein, GPAA1. Am J Physiol Cell Physiol. 2000;279:C205-C212. [PubMed] |
| 11. | Takeda J, Kinoshita T. GPI-anchor biosynthesis. Trends Biochem Sci. 1995;20:367-371. [PubMed] [DOI] |
| 12. | Ohishi K, Inoue N, Maeda Y, Takeda J, Riezman H, Kinoshita T. Gaa1p and gpi8p are components of a glycosylphosphatidylinositol (GPI) transamidase that mediates attachment of GPI to proteins. Mol Biol Cell. 2000;11:1523-1533. [PubMed] [DOI] |
| 13. | Kinoshita T, Inoue N, Takeda J. Defective glycosyl phosphatidylinositol anchor synthesis and paroxysmal nocturnal hemoglobinuria. Adv Immunol. 1995;60:57-103. [PubMed] [DOI] |
| 14. | Gincel D, Zaid H, Shoshan-Barmatz V. Calcium binding and translocation by the voltage-dependent anion channel: a possible regulatory mechanism in mitochondrial function. Biochem J. 2001;358:147-155. [PubMed] [DOI] |
| 15. | Kmita H, Budzińska M, Stobienia O. Modulation of the voltage-dependent anion-selective channel by cytoplasmic proteins from wild type and the channel depleted cells of Saccharomyces cerevisiae. Acta Biochim Pol. 2003;50:415-424. [PubMed] |
| 16. | Benz R. Permeation of hydrophilic solutes through mitochondrial outer membranes: review on mitochondrial porins. Biochim Biophys Acta. 1994;1197:167-196. [PubMed] [DOI] |
| 17. | Shi Y, Chen J, Weng C, Chen R, Zheng Y, Chen Q, Tang H. Identification of the protein-protein contact site and interaction mode of human VDAC1 with Bcl-2 family proteins. Biochem Biophys Res Commun. 2003;305:989-996. [PubMed] [DOI] |
| 18. | Müller A, Rassow J, Grimm J, Machuy N, Meyer TF, Rudel T. VDAC and the bacterial porin PorB of Neisseria gonorrhoeae share mitochondrial import pathways. EMBO J. 2002;21:1916-1929. [PubMed] [DOI] |
| 19. | Müller A, Rudel T. Modification of host cell apoptosis by viral and bacterial pathogens. Int J Med Microbiol. 2001;291:197-207. [PubMed] [DOI] |
| 20. | Kroemer G, Reed JC. Mitochondrial control of cell death. Nat Med. 2000;6:513-519. [PubMed] [DOI] |
| 21. | Le Mellay V, Troppmair J, Benz R, Rapp UR. Negative regulation of mitochondrial VDAC channels by C-Raf kinase. BMC Cell Biol. 2002;3:14. [PubMed] [DOI] |
| 22. | Somoza JR, Ho JD, Luong C, Ghate M, Sprengeler PA, Mortara K, Shrader WD, Sperandio D, Chan H, McGrath ME. The structure of the extracellular region of human hepsin reveals a serine protease domain and a novel scavenger receptor cysteine-rich (SRCR) domain. Structure. 2003;11:1123-1131. [PubMed] [DOI] |
| 23. | Torres-Rosado A, O'Shea KS, Tsuji A, Chou SH, Kurachi K. Hepsin, a putative cell-surface serine protease, is required for mammalian cell growth. Proc Natl Acad Sci U S A. 1993;90:7181-7185. [PubMed] [DOI] |
| 24. | Chen Z, Fan Z, McNeal JE, Nolley R, Caldwell MC, Mahadevappa M, Zhang Z, Warrington JA, Stamey TA. Hepsin and maspin are inversely expressed in laser capture microdissectioned prostate cancer. J Urol. 2003;169:1316-1319. [PubMed] [DOI] |
| 25. | Wu Q. Gene targeting in hemostasis. Hepsin. Front Biosci. 2001;6:D192-D200. [PubMed] [DOI] |