修回日期: 2004-01-01
接受日期: 2004-01-08
在线出版日期: 2004-04-15
目的: 研究肿瘤转移抑制基因KAI1对MHCC97-H细胞裸鼠成瘤及转移的影响.
方法: 将已转染KAI1正、反义核苷酸的高转移潜能肝癌细胞MHCC97-H接种裸鼠皮下, 观察皮下肿瘤生长情况, 再将皮下肿瘤组织进行裸鼠原位肝接种, 观察接种后肿瘤肺转移情况. 其中, 转染空载体及未转染的MHCC97-H亲本细胞作为实验对照组.
结果: 正义组、反义组、空载体组及亲本细胞组裸鼠皮下均成瘤, 肿瘤出现的时间、肿瘤块生长的速度无明显差异, 生长方式上反义组表现出明显的侵袭性. 原位肝接种6 wk后裸鼠肺部均出现癌巢, AFP染色可见癌巢中肿瘤细胞质有黄色颗粒沉着, 证实为肝癌转移至肺形成的转移灶. 与MHCC97-H亲本细胞组比较, 反义组转移灶数目明显增加(P = 0.0 0158), 正义组转移灶数目明显减少(P = 0.00 465), 差异均有显著性, 而载体组转移灶数目无明显变化(P = 0.15 166).
结论: 肿瘤转移抑制基因KAI1对MHCC97-H细胞裸鼠成瘤性及肿瘤生长无明显影响, 但上调KAI1蛋白的表达水平能在一定程度上降低肿瘤的侵袭性、抑制转移的发生. 这为肝癌的抗转移治疗研究提供了重要线索.
引文著录: 彭志红, 杨建民, 唐波, 司遂海, 房殿春, 罗元辉. KAI1基因对MHCC97-H细胞裸鼠成瘤及转移的影响. 世界华人消化杂志 2004; 12(4): 778-781
Revised: January 1, 2004
Accepted: January 8, 2004
Published online: April 15, 2004
AIM: To explore the effects of metastasis-suppressor gene KAI1 on tumorigenicity and metastasis of hepatocellular carcinoma cells MHCC97-H with high metastatic potential in nude mice.
METHODS: The MHCC97-H hepatocellular carcinoma cells with high metastatic potential transfected with sense or antisense KAI1 expression plasmid in our previous experiments were inoculated subcutaneously into nude mice. The growth of subcutaneous tumor was observed, then the subcutaneous tumor tissues were harvested and implanted orthotopicly into nude mice liver. The tumor metastasis in lung was carefully examined under microscope. MHCC97-H and the cells transfected with vector pCI-neo, but without KAI1 gene were used as control.
RESULTS: The different cells inoculated subcutaneously all had tumorigenicity. There were no significant differences in the speed of tumor growth among different groups, but the antisense group showed stronger invasion ability than others. The spontaneous metastasis to lung occurred in latency period of six wk via orthotopic implantation of tumor tissue. Immunostaining showed strongly positive for AFP in lung metastatic lesions, which indicated those were lung metastatic lesions from hepatocellular carcinoma. The number of lung metastatic lesions increased dramaticly in antisense group (P = 0.00 158), decreased significantly in sense group (P = 0.00 465) and no significant difference in vector pCI-neo group (P = 0.15 166), as compared with their paternal MHCC97-H group.
CONCLUSION: The metastasis-suppressor gene KAI1 has no significant effects on tumorigenicity and growth of MHCC97-H hepatocellular carcinoma cells, but enhanced KAI1 expression can decrease the invasion ability and inhibit the metastasis, which offers an important clue to investigate the anti-metastasis treatment for hepatocellular carcinoma.
- Citation: Peng ZH, Yang JM, Tang B, Si SH, Fang DC, Luo YH. Effects of metastasis-suppressor gene KAI1 on tumorigenicity and metastasis of hepatocellular carcinoma MHCC97-H cells with high metastatic potential in nude mice. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 778-781
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/778.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.778
原发性肝癌是消化系统最常见的恶性肿瘤之一[1-9]. 肝癌发病隐匿, 发展迅速[10-12], 大多数患者在确诊时已有转移[13-16], 不宜或无法切除[17-19], 死亡率位列我国恶性肿瘤病死率的第二位[20], 而术后大部分患者死于复发. 转移和复发是影响肝癌预后的主要因素. 因此, 阐明肝癌转移、复发的发生机制, 寻求有效的抗转移治疗措施, 对改善肝癌患者预后有重要意义. KAI1基因是在前列腺癌细胞中发现的一种肿瘤转移抑制基因, 属跨膜4超家族(transmembrane 4 superfamily, TM4SF)成员. 已有研究表明其在多种恶性肿瘤如卵巢癌[21]、宫颈癌[22]、子宫内膜癌[23]等中表达减少, 但对肝癌的影响国内外研究较少, 而且多均从组织病理学角度进行, 在裸鼠体内进行实验, 模拟肝癌体内发生、发展、转移的研究未见报道. 我们即从该角度入手, 建立裸鼠肝癌成瘤及转移模型, 探讨KAI1基因对肝癌侵袭、转移的影响, 为肝癌的抗转移治疗提供线索.
MHCC97-H肝癌细胞系为上海复旦大学医学院附属中山医院肝癌研究所建立的高转移潜能细胞, 属贴壁生长型[24]. 我们前已利用亚克隆技术构建了人类KAI1全长正、反义结构基因哺乳动物真核表达质粒, 通过DOTAP脂质体介导的转染系统分别将其转入该肝癌细胞中, 并进行了基因整合和表达的鉴定, 说明基因转染成功, 可获得预期KAI1蛋白表达[25]. 转染有KAI1正义基因的肝癌细胞重新命名为MHCC97-H-S, 转染KAI1反义基因的肝癌细胞命名为MHCC97-H-AS, 转染有pCI-neo空载体的肝癌细胞命名为MHCC97-H-pCI. 细胞培养条件为: 高糖DMEM(Hyclone公司)加100 mL/L优等胎牛血清(Hyclone公司)和两种抗生素(青霉素100 mg/L, 链霉素100 mg/L), 37 ℃、50 mL/L CO2、饱和湿度培养. 实验用BALB/c裸鼠购自华中科技大学同济医学院动物学部(生产合格证号: 医动字第19-52号). 共80只, 先后分为两批, 每批40只, 均为♂, 4-6周龄, 质量17-20 g. 每批随机分为4组, 每组10只, 分别为正义组、反义组、MHCC97-H亲本细胞组、空载体组. 饲养在重庆医科大学动物中心, 恒温(25℃-27 ℃)、恒湿(45%-50%)、新鲜空气高度除尘除菌、无特殊病原体(SPF)环境下饲养. 动物置于有机玻璃饲养盒内, 安放于层流式超净架内, 每只饲养盒内饲养5只动物, 灭菌处理的水和饲料供动物自由摄入. 实验过程为无菌操作.
将处于对数生长期癌细胞培养液丢弃, 用无菌中性PBS洗涤细胞1次, 胰酶消化, 从培养瓶洗脱下, 吹打成单细胞悬液. 离心后重悬, 密度约为5×1010/L, 在1 h内将0.2 mL单细胞悬液接种于裸鼠右侧背部皮下. 接种后密切观察接种部位肿瘤的生长情况. 在皮下肿瘤长至直径1 cm左右时用脱颈法处死裸鼠, 取肿瘤组织, 仔细去除表面的纤维包膜、血管, 用PBS缓冲液漂洗后放入盛DMEM培养液的培养皿中, 切成约1 mm3小块瘤组织待用. 每组处死1只, 其余继续饲养观察. 用30 g/L硫酸戊巴比妥钠腹腔注射法麻醉裸鼠, 剂量40-50 mg/kg. 动物取仰卧位, 皮肤用5 g/L碘伏消毒2次, 铺无菌孔巾. 取左肋缘下切口, 长约1-2 cm, 分层切开腹壁, 进入腹腔, 暴露肝脏左叶. 轻轻将肝左叶拖出腹腔置于湿纱布上, 在其表面做0.3 cm斜切口, 压迫止血, 将瘤组织块植入肝内, 每组每只约3块瘤组织, 压迫切口, 待切口表面血凝将肝脏轻轻地送回腹腔, 6-0的无损伤缝线逐层缝合腹膜、腹壁肌肉及皮肤, 无菌饲养(Cancer Res 1993; 53: 1204). 每周观察动物1次, 用精密卡尺测量肿瘤最大直径和垂直短径. 参照文献(中华医学杂志 2000; 80: 831), 测量肿瘤长短径, 肿瘤体积为长径×短径2×0.5, 绘制各组肿瘤生长的体积曲线. 接种8 wk后处死裸鼠, 肿瘤组织行HE染色. 原位肝接种肿瘤接种6 wk后处死裸鼠, 观察肝脏肿瘤组织侵犯周围脏器、组织情况, 测量肿瘤大小, 取肝脏肿瘤组织甲醛固定, 石蜡包埋, HE染色. 切除所有肺组织, 40 g/L甲醛溶液固定, 石蜡包埋. 双肺蜡块取5个冠状切面, 每个切面连续切5张, 每张厚4-5 m, 每个切面之间相距0.8 mm (以最大冠状切面为中心), 切片做HE染色, 在镜下进行肺转移结节记数(同一个结节出现于不同切面上按一个结节计), 比较各组肺转移结节数目的差异. 取肺组织石蜡切片用SP法行AFP免疫组化染色, 对转移灶行定性观察. 兔抗人AFP多克隆抗体及SP免疫组化试剂盒均为北京中山公司产品. 具体步骤按照试剂盒说明进行.
统计学处理 所有实验数据均经t检验.
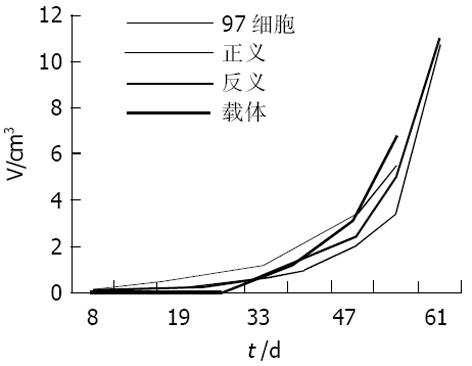
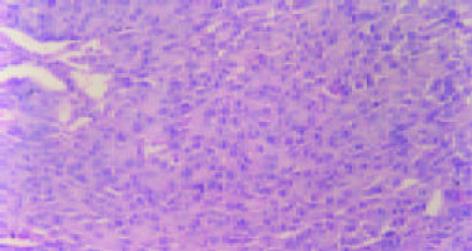
裸鼠共40只, 在实验过程中无意外死亡, 均存活. 在皮下注射肿瘤细胞悬液后各组均在2 wk左右出现肿瘤组织块, 随后肿瘤组织块增长迅速, 并逐渐可见肿瘤表面红色粗大的肿瘤血管. 接种8 wk后处死裸鼠, 分离切除皮下肿瘤块, 并测量其大小. 在分离过程中可见肿瘤组织呈鱼肉状, 质脆, 易出血, 中间可见坏死, 肿瘤与深部组织呈浸润性生长(表1, 图1).
| 肿瘤 | 皮下种植肿瘤(n = 10) | 肝种植肿瘤(n = 10) | |||
| 分组 | 股骨 | 脊柱 | 腹膜 | 膈肌 | 肠系膜 |
| 反义组 | 4 | 5 | 6 | 4 | 2 |
| 正义组 | 0 | 1 | 1 | 0 | 0 |
| 97组 | 2 | 3 | 3 | 2 | 1 |
| 载体组 | 3 | 2 | 4 | 1 | 1 |
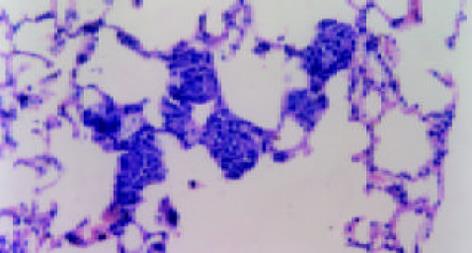
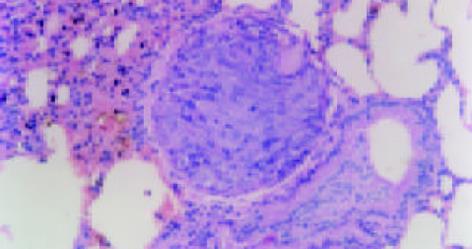
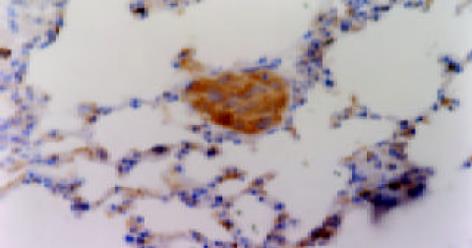
裸鼠共40只, 在实验过程中也无意外死亡, 均存活. 接种6 wk后裸鼠衰竭, 处死裸鼠, 打开腹腔, 可见肝脏部位白色肿瘤组织块, 表面凹凸不平结节状, 有丰富的肿瘤血管. 肿瘤侵犯大部分肝脏, 只存留少量肝组织, 有的可见肿瘤组织与腹膜、腹壁、肠系膜等组织粘连, 有一只可见膈肌上白色癌灶. 分离肿瘤组织时见肿瘤组织呈鱼肉状, 质脆, 易出血, 中间可见坏死. 各组肿瘤组织侵犯周围脏器、组织(表1, 图2). 巨检见双肺呈暗红色, 未见明显转移结节. 镜检见转移灶分布于周边肺, 以间质内微转移瘤和血管内瘤栓为主, 灶内癌细胞体积明显增大, 核大浆少, 多见病理性核分裂像. 如上方法记数转移情况, 可见反义组转移灶数目为27.7±3.8个/只, 正义组转移灶数目为16.1±2.2个/只, 载体组转移灶数目为21.6±3.6个/只, MHCC97-H亲本细胞组为19.3±2.3个/只. 其中, 与MHCC97-H亲本细胞组比较, 反义组转移灶数目明显增加, 正义组转移灶数目明显减少, 差异均有显著性(P<0.01), 而载体组转移灶数目无明显变化(P>0.1). 肺转移灶及肺血管瘤栓(图3, 4). 肺转移灶的AFP表达部位主要在上述核大浆少, 细胞聚集的细胞团块内, 呈细胞质着色, 可见癌巢中肿瘤细胞质有黄色颗粒沉着(图5). 证明这些细胞团块确是肝癌转移至肺形成的转移灶.
肿瘤细胞的侵袭转移是一个复杂的生物学过程, 涉及癌细胞从原发灶脱落, 侵袭和穿透基底膜, 降解细胞外基质, 向远处转移等. 因此, 深入研究肝癌转移的发生机制, 寻求有效的抗转移治疗措施, 对改善肝癌患者预后具有重要意义. KAI1基因是前列腺癌的转移抑制基因. 该基因定位于人类染色体11p11.2, 全长约80 kb, 包括8 kb的 5 区域, 10个外显子, 9个内含子和8 kb的3区, 编码产物为含267个氨基酸的细胞膜糖蛋白, Mr 29 610. 其分子结构中含有4个跨膜功能区和一个大的胞外糖基化功能区, 因而结构上属跨膜4超家族 (transmembrane 4 superfamily, TM4SF) 成员, 其生物学功能至今仍有诸多不清楚的地方. 他们在细胞膜上的定位和广泛的糖基化提示他们在细胞与细胞及细胞与胞外基质的相互作用中发挥功能, 而这些作用在肿瘤的侵袭和转移中具有十分重要的意义. 特别是这些分子的N糖基化与其抑制转移作用是一致的, 因为N端连接寡聚糖的过程与转移表型有关. 研究发现MRP1基因产物与细胞的穿透性和运动性有关, 并可降低某些肿瘤细胞的转移潜能, 而且在肿瘤细胞中MRP-1与KAI1变化具有一致性. 另外大部分TM4SF成员同B细胞MHCⅡ类糖蛋白或T细胞的CD4和CD8分子介导细胞和周围环境的信号转导, 进而影响细胞的运动和分化.
本实验可看出, 从生长速度看, 皮下肿瘤和肝原位种植肿瘤各组基本一致, 说明KAI1基因对MHCC97-H肝癌细胞的生长无明显影响, 这与前期的体外实验结果是一致的, 即转染正、反义KAI1基因及空载体细胞与原细胞株比较, 绘制的生长曲线无差异, 也与Takaoka et al在结肠癌、Dong et al在前列腺癌细胞中的研究结果一致. 从生长方式看, 反义组明显呈浸润性, 皮下肿瘤表现为与深部组织融合生长, 有的甚至侵犯脊柱, 原位肝种植肿瘤表现为分别侵犯腹膜、皮下组织、肠系膜甚至膈肌(在膈肌上形成白色转移灶), 载体组、MHCC97-H亲本细胞组则浸润性较差, 而正义组则几乎未见周围脏器、组织浸润, 说明KAI1基因影响肿瘤的侵袭性, 反义基因使KAI1基因的功能减弱, 在动物体内具体表现为反义组肿瘤组织侵袭性增强, 而正义基因则明显增强了其功能, 表现为肿瘤组织向周围组织的侵袭能力减弱, 这与我们以前体外Boyden Chamber侵袭实验的结果一致. 从KAI1基因对肺转移的影响看, 反义组转移灶数目为27.7±3.8个/只, 正义组转移灶数目为16.1±2.2个/只, 载体组转移灶数目为21.6±3.6个/只, MHCC97-H亲本组为19.3±2.3个/只. 与MHCC97-H亲本细胞组比较, 反义组转移灶数目明显增加(P = 0.00 158), 正义组转移灶数目明显减少(P = 0.00 465), 差异均有显著性, 而载体组转移灶数目无明显变化(P = 0.15 166). 说明KAI1反义基因明显促进了肺转移的发生, 即KAI1基因失去了其肿瘤转移抑制作用而使转移更易发生, 而正义基因上调了KAI1蛋白的表达水平从而在一定程度上抑制了转移的发生. 提示上调KAI1基因在肝癌细胞内的表达可能是抑制肝癌转移的一条有效途径, 这为肝细胞癌的抗转移治疗提供了实验基础.
肿瘤转移的发生过程极其复杂, 他涉及肿瘤细胞与细胞之间, 肿瘤细胞与细胞外基质之间以及细胞外基质与细胞外基质之间的相互作用. 在今后的工作中, 为进一步研究KAI1影响转移的可能机制, 我们拟从细胞外基质成分入手, 探讨KAI1对细胞外基质各成分表达的影响.
编辑: N/A
| 3. | Yang JM, Chen WS, Liu ZP, Luo YH, Liu WW. Effects of insulin-like growth factors-IR and -IIR antisense gene transfection on the biological behaviors of SMMC-7721 human hepatoma cells. J Gastroenterol Hepatol. 2003;18:296-301. [PubMed] [DOI] |
| 4. | 邵 晓冬, 吴 开春, 郭 晓钟, 徐 建华, 郭 长存, 孟 繁平, 樊 代明. KAI1基因在肝硬化和肝细胞癌组织中的表达及其意义. 世界华人消化杂志. 2001;9:1238-1241. [DOI] |
| 7. | Yin ZY, Wang XM, Yu RX, Zhang BM, Yu KK, Li N, Li JS. Total vascular exclusion technique for resection of hepatocellular carcinoma. World J Gastroenterol. 2003;9:2194-2197. [PubMed] [DOI] |
| 8. | Bangoura G, Yang LY, Huang GW, Wang W. Expression of HIF-2alpha/EPAS1 in hepatocellular carcinoma. World J Gastroenterol. 2004;10:525-530. [PubMed] [DOI] |
| 9. | Hsieh CB, Chang HM, Chen TW, Chen CJ, Chan DC, Yu JC, Liu YC, Chang TM, Shen KL. Comparison of transcatheter arterial chemoembolization, laparoscopic radiofrequency ablation, and conservative treatment for decompensated cirrhotic patients with hepatocellular carcinoma. World J Gastroenterol. 2004;10:505-508. [PubMed] [DOI] |
| 10. | Wan YL, Zheng SS, Zhao ZC, Li MW, Jia CK, Zhang H. Expression of co-stimulator 4-1BB molecule in hepatocellular carcinoma and adjacent non-tumor liver tissue, and its possible role in tumor immunity. World J Gastroenterol. 2004;10:195-199. [PubMed] |
| 11. | Xiao EH, Li JQ, Huang JF. Effects of p53 on apoptosis and proliferation of hepatocellular carcinoma cells treated with transcatheter arterial chemoembolization. World J Gastroenterol. 2004;10:190-194. [PubMed] |
| 12. | Shi YJ, Gong JP, Liu CA, Li XH, Mei Y, Mi C, Huo YY. Construction of a targeting adenoviral vector carrying AFP promoter for expressing EGFP gene in AFP-producing hepatocarcinoma cell. World J Gastroenterol. 2004;10:186-189. [PubMed] |
| 13. | Chen WX, Min PQ, Song B, Xiao BL, Liu Y, Ge YH. Single-level dynamic spiral CT of hepatocellular carcinoma: correlation between imaging features and density of tumor microvessels. World J Gastroenterol. 2004;10:67-72. [PubMed] |
| 14. | Sheen IS, Jeng KS, Shih SC, Wang PC, Chang WH, Wang HY, Shyung LR, Lin SC, Kao CR, Tsai YC. Does surgical resection of hepatocellular carcinoma accelerate cancer dissemination? World J Gastroenterol. 2004;10:31-36. [PubMed] |
| 15. | Xu KC, Niu LZ, He WB, Guo ZQ, Hu YZ, Zuo JS. Percutaneous cryoablation in combination with ethanol injection for unresectable hepatocellular carcinoma. World J Gastroenterol. 2003;9:2686-2689. [PubMed] [DOI] |
| 16. | Lai YC, Shih CY, Jeng CM, Yang SS, Hu JT, Sung YC, Liu HT, Hou SM, Wu CH, Chen TK. Hepatic arterial infusion chemotherapy for hepatocellular carcinoma with portal vein tumor thrombosis. World J Gastroenterol. 2003;9:2666-2670. [PubMed] [DOI] |
| 17. | Luo MY, Shan H, Jiang ZB, Li LF, Huang HQ. Study on hepatocellular carcinoma-associated hepatic arteriovenous shunt using multidetector CT. World J Gastroenterol. 2003;9:2455-2459. [PubMed] |
| 18. | Chen XP, He SQ, Wang HP, Zhao YZ, Zhang WG. Expression of TNF-related apoptosis-inducing Ligand receptors and antitumor tumor effects of TNF-related apoptosis-inducing Ligand in human hepatocellular carcinoma. World J Gastroenterol. 2003;9:2433-2440. [PubMed] |
| 19. | Cai RL, Meng W, Lu HY, Lin WY, Jiang F, Shen FM. Segregation analysis of hepatocellular carcinoma in a moderately high-incidence area of East China. World J Gastroenterol. 2003;9:2428-2432. [PubMed] |
| 20. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 21. | Houle CD, Ding XY, Foley JF, Afshari CA, Barrett JC, Davis BJ. Loss of expression and altered localization of KAI1 and CD9 protein are associated with epithelial ovarian cancer progression. Gynecol Oncol. 2002;86:69-78. [PubMed] [DOI] |
| 22. | Liu FS, Chen JT, Dong JT, Hsieh YT, Lin AJ, Ho ES, Hung MJ, Lu CH. KAI1 metastasis suppressor gene is frequently down-regulated in cervical carcinoma. Am J Pathol. 2001;159:1629-1634. [PubMed] [DOI] |
| 23. | Liu FS, Dong JT, Chen JT, Hsieh YT, Ho ES, Hung MJ, Lu CH, Chiou LC. KAI1 metastasis suppressor protein is down-regulated during the progression of human endometrial cancer. Clin Cancer Res. 2003;9:1393-1398. [PubMed] |
| 24. | Li Y, Tang ZY, Ye SL, Liu YK, Chen J, Xue Q, Chen J, Gao DM, Bao WH. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol. 2001;7:630-636. [PubMed] |