修回日期: 2004-01-01
接受日期: 2004-02-01
在线出版日期: 2004-04-15
目的: 利用硫氧还蛋白融合表达系统表达胃癌相关基因GCRG224.
方法: 采用PCR技术从pGEM-T质粒上扩增出含完整ORF的GCRG224 cDNA序列, 将其克隆至硫氧还蛋白融合表达载体pET102/D-TOPO中, 转化大肠杆菌BL21, 经IPTG诱导表达重组融合蛋白, SDS-PAGE分析表达产物.
结果: 高效表达出相对分子量约16 800的重组融合蛋白. 薄层凝胶扫描显示, 其表达量占菌体总蛋白质的22.3%.
结论: 在大肠杆菌中成功表达了GCRG224重组融合蛋白.
引文著录: 伍银桥, 王刚石, 王孟薇, 吴本俨, 尤纬缔, 王卫华. 胃癌相关基因GCRG224的克隆及其在大肠杆菌中的表达. 世界华人消化杂志 2004; 12(4): 763-766
Revised: January 1, 2004
Accepted: February 1, 2004
Published online: April 15, 2004
AIM: To express gastric cancer related gene GCRG224 by using thioredoxin fusion expression system.
METHODS: GCRG224 cDNA with complete open reading frame was amplified by PCR from plasmid pGEM-T, and then cloned into thioredoxin fusion expression vector pET102/D-TOPO. The recombinant plasmid was further transformed into E.coli BL21 strain. After induction with IPTG, thioredoxin-GCRG224 fusion protein was expressed in E.coli.
RESULTS: SDS-PAGE analysis showed the thioredoxin-GCRG224 fusion protein with a relative molecule mass of 16 800 was highly expressed. The thin layer gel scanning analysis showed that the yield of GCRG224 fusion protein was 22.3% of the total bacterial protein.
CONCLUSION: The GCRG224 recombinant fusion protein is successfully expressed in E.coli.
- Citation: Wu YQ, Wang GS, Wang MW, Wu BY, You WD, Wang WH. Cloning and expression of gastric cancer related gene GCRG224 in E.coli. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 763-766
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/763.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.763
研究表明, 胃癌的发生发展过程中涉及到多种癌基因、抑癌基因的变化[1-7], 但迄今为止, 仍未从基因角度阐明胃癌发生、浸润或转移等方面的机制, 胃癌的早期诊断、预后判断和治疗等各方面均无明显突破, 其年死亡率在我国仍居各类恶性肿瘤之首[8-13]. 我们应用荧光标记的mRNA差异显示技术分析了我国人胃窦部进展期腺癌组织、癌旁组织和正常胃黏膜组织之间表达基因的差异, 从中筛选并克隆出1条基因序列, 命名为GCRG224, 生物信息学分析显示其与已知的蛋白质无同源性[14-15]. 为了获得GCRG224蛋白并进一步研究其在胃癌发生发展中的作用, 我们通过PCR方法, 扩增了含完整ORF的GCRG224 cDNA序列. 采用基因重组技术, 构建了融合基因表达载体pET-224, 并在大肠杆菌中得到高效表达.
含目的片段的pGEM-T质粒由本室王刚石博士构建保存. E.coli TOP10, BL21 StarTM(DE3)菌株, platinum Pfx DNA polymerase和pET102/D-TOPO载体均为Invitrogen公司产品. IPTG, 质粒提取试剂盒购自Promega公司. DNA分子质量标准DL2000购自宝生物工程有限公司(Takara). 蛋白质分子质量标准购自北京原平皓生物有限公司. SDS, Tris碱为Gibco公司产品. 丙烯酰胺, 甘氨酸为Sigma公司产品. 按照GCRG224的cDNA序列设计了一对引物, 并根据表达载体要求在上游引物5'-端加入CACC序列, 以便于后续的定向克隆. 引物由中国科学院微生物所合成. 引物序列如下: P1: 5'- C ACC ATT CCT GGT AAC CCA AGT CC -3'; P2: 5'- GAG AGA AGG AAC TTA TCT ACG GC -3'.
以pGEM-T质粒为模板, 以P1, P2为引物, 用Pfx DNA聚合酶扩增出含完整ORF的GCRG224 cDNA序列. PCR扩增的条件是: 94 ℃变性30 s, 55 ℃退火30 s, 68 ℃延伸1 min, 25次循环反应后, 于68 ℃继续延伸10 min. 表达载体的构建按产品说明将PCR产物与pET102/D-TOPO载体连接, 转化TOP10感受态菌, 随机挑取10个菌落, 进行PCR鉴定. 选取经过PCR初步鉴定的阳性菌落, 送上海博亚生物工程公司测序. 将质粒DNA转化BL21 StarTM(DE3)感受态菌, 接种于10 mL含氨苄青霉素(100 mg/L)的LB液体培养基中, 37 ℃过夜培养后按1: 50放大培养至OD600达0.5-0.6, 加入IPTG至浓度为1 mmol/L, 诱导培养3-4 h. 收集菌体进行SDS-PAGE凝胶电泳检测. 离心收集诱导培养的工程菌菌体, 悬浮于裂解缓冲液中, 经反复冷融或超声破碎后离心, 沉淀不溶解蛋白, 上清即为可溶组分, 再进行SDS-PAGE凝胶电泳. 根据上清组分与沉淀组分中的蛋白的含量, 判断其表达形式.
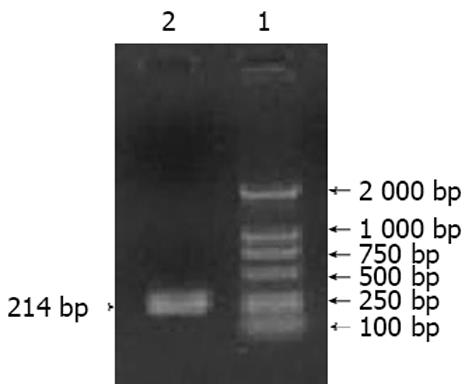
PCR扩增产物经琼脂糖凝胶电泳后, 可见1条清晰、单一、大小约214 bp的特异性扩增条带(图1), 其大小与预计的相吻合. 序列测定结果与理论预期一致.
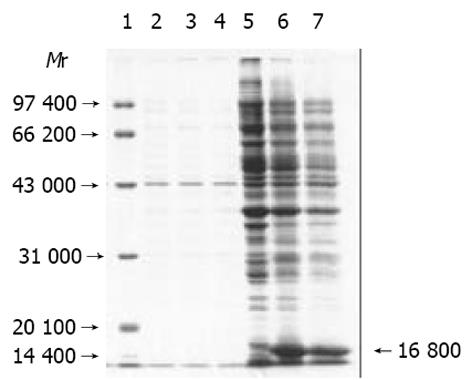
SDS-PAGE分析表明, 工程菌经IPTG诱导后, 在相对分子质量约16 800处出现了1条明显的新蛋白带, 其大小与理论推算的融合蛋白相对分子质量相符合, 未诱导的工程菌中未见此带. 在诱导后1 h该蛋白即开始表达, 3-4 h达高峰. 凝胶薄层扫描分析显示其表达量约占菌体总蛋白的22.3%. 将菌体进行冻融裂解或超声破碎、离心后分别取其上清和沉淀进行SDS-PAGE凝胶电泳检测, 发现无论诱导时间长短, thioredoxin/GCRG224融合蛋白均主要以包涵体形式存在于沉淀中, 菌体裂解物上清在相应位置没有明确条带出现(图2, 3).
癌基因和抑癌基因以及与肿瘤发生相关的其他因素的研究一直是近年来肿瘤研究的焦点[16-19]. 在胃癌的发生发展过程中涉及到HER2/neu, met, k-sam, ras, c-myc, Bcl-2, APC, E-Cadherin, p53, Rb, cyclin等多种基因[20-29]. 但这些基因在胃癌组织中变异的特异性不强, 仍很难用作胃癌的监测指标. 至今为止, 国内外缺乏对人胃癌组织特异性基因的了解和研究. GCRG224是本实验室应用荧光标记的mRNA差异显示技术(DDRT-PCR)从我国人胃窦部进展期腺癌组织、癌旁组织和正常胃黏膜组织中筛选并克隆出的1条差异表达基因序列. GCRG224在非癌组织的表达高于肿瘤组织; 原位杂交表明其在5/30例腺癌, 3/18例不典型增生和6/18例肠上皮化生表达高于正常胃腺体, 而在26/30例正常胃黏膜上皮有显著过表达[15].
为了进一步弄清楚GCRG224在胃癌发生发展中的作用及在胃癌诊断中的意义. 我们以获得的含完整开放阅读框架的GCRG224 cDNA片段为切入点, 利用大肠杆菌高密度生长的优势和易于表达蛋白、纯化简单, 尤其是以融合蛋白表达的形式等特点, 进行了GCRG224 cDNA片段在原核系统中的表达, 为后续的功能研究、蛋白制备及其抗体研制提供了良好的实验材料. 可以预期, 对GCRG224的深入研究, 不仅有助于阐明胃癌的发病机制, 也将为胃癌的诊断、治疗和预后判断提供新的思路和手段. 通常PCR产物与载体的直接连接效率不高, 并且有非特异性背景菌落产生, 造成后续的筛选困难. 而拓朴异构酶I却能高效且快速地将PCR产物与载体相连, 同时我们使用的TOPO平端克隆方法主要是载体进行了改良设计, 含有ccdB (control of cell death)基因[30-32], 可降低非特异性背景菌落, 也易于筛选. 在原核细胞表达时, 为获得产量高、利于基因工程下游纯化的工作, 目前多主张选用以融合蛋白表达形式的载体, 这样既能解决表达蛋白的纯化, 又可防止宿主菌蛋白酶对融合蛋白的降解, 有利于保护目的蛋白的生物活性. 我们选用pET102/D-TOPO表达载体, 是近年构建的新型载体, 带有强大的T7表达启动子, 给实验操作带来极为有利的方便.
我们以pET102/D-TOPO载体高水平地表达了人thioredoxin/GCRG224融合蛋白, 产物表达量占菌体总蛋白的22.3%. 我们选用pET102/D-TOPO载体除了希望得到高水平表达的重组融合蛋白, 同时还希望获得可溶性蛋白, 但其表达仍主要以包涵体的形式存在. 究其形成包涵体的原因, 可能有以下几个方面: (1)重组蛋白的高水平表达. 一般而言, 包涵体的形成是外源蛋白在大肠杆菌中高效表达时的普遍现象. (2)大肠杆菌胞质与真核细胞胞质环境的差异使重组的外源蛋白不能在大肠杆菌中进行正常的折叠[33-34]. (3)包涵体的形成虽与所表达蛋白的分子无关, 但却受肽链氨基酸组成的影响, 大量疏水氨基酸的存在易促进蛋白的聚集[35]. (4)细菌培养温度、pH等也可能影响包涵体的形成[36-38]. 包涵体蛋白虽然往往无生物活性, 需要重新溶解和复性, 但也为重组蛋白纯化带来了极大的方便, 此外, 包涵体的形成有利于防止蛋白酶对表达蛋白的降解, 增加了产物的稳定性.
编辑: N/A
| 1. | Tamura G. Genetic and epigenetic alterations of tumor suppressor and tumor-related genes in gastric cancer. Histol Histopathol. 2002;17:323-329. [PubMed] |
| 2. | Yasui W, Yokozaki H, Fujimoto J, Naka K, Kuniyasu H, Tahara E. Genetic and epigenetic alterations in multistep carcinogenesis of the stomach. J Gastroenterol. 2000;35 Suppl 12:111-115. [PubMed] |
| 3. | Tahara E. Genetic alterations in human gastrointestinal cancers. The application to molecular diagnosis. Cancer. 1995;75:1410-1417. [PubMed] [DOI] |
| 4. | Xu AG, Li SG, Liu JH, Gan AH. Function of apoptosis and expression of the proteins Bcl-2, p53 and C-myc in the development of gastric cancer. World J Gastroenterol. 2001;7:403-406. [PubMed] [DOI] |
| 9. | Zhou YN, Xu CP, Han B, Li M, Qiao L, Fang DC, Yang JM. Expression of E-cadherin and beta-catenin in gastric carcinoma and its correlation with the clinicopathological features and patient survival. World J Gastroenterol. 2002;8:987-993. [PubMed] [DOI] |
| 10. | Fang DC, Luo YH, Lu R, Liu WW. Studies on the relationship between the point mutation of ras oncogenes and the prognosis of patients with gastric cancer. China Nati J New Gastroenterol. 1997;3:19-21. |
| 11. | Zuo DS, Dai J, Bo AH, Fan J, Xiao XY. Significance of expression of heat shock protein90alpha in human gastric cancer. World J Gastroenterol. 2003;9:2616-2618. [PubMed] |
| 12. | 王 孟薇, 杨 少波, 张 子其, 祝 庆孚, 王 刚石, 李 晖, 姚 晨, 吴 本俨, 尤 纬缔. 老年人胃癌前黏膜癌变的胃镜随访. 世界华人消化杂志. 2003;11:1279-1281. [DOI] |
| 13. | Lu JB, Sun XB, Dai DX, Zhu SK, Chang QL, Liu SZ, Duan WJ. Epidemiology of gastroenterologic cancer in Henan Province, China. World J Gastroenterol. 2003;9:2400-2403. [PubMed] |
| 14. | Wang GS, Wang MW, You WD, Li H. Cloning and primary expression analyses of down-regulated cDNA fragment in human gastric cancer. Chin J Med Genet. 2001;18:43-47. |
| 15. | Wang GS, Wang MW, Wu BY, You WD, Yang XY. A novel gene, GCRG224, is differentially expressed in human gastric mucosa. World J Gastroenterol. 2003;9:30-34. [PubMed] [DOI] |
| 16. | Becker KF, Keller G, Hoefler H. The use of molecular biology in diagnosis and prognosis of gastric cancer. Surg Oncol. 2000;9:5-11. [PubMed] [DOI] |
| 17. | Boussioutas A, Taupin D. Towards a molecular approach to gastric cancer management. Intern Med J. 2001;31:296-303. [PubMed] [DOI] |
| 18. | Yasui W, Oue N, Kuniyasu H, Ito R, Tahara E, Yokozaki H. Molecular diagnosis of gastric cancer: present and future. Gastric Cancer. 2001;4:113-121. [PubMed] [DOI] |
| 19. | Yokozaki H, Yasui W, Tahara E. Genetic and epigenetic changes in stomach cancer. Int Rev Cytol. 2001;204:49-95. [PubMed] [DOI] |
| 20. | Ross JS, McKenna BJ. The HER-2/neu oncogene in tumors of the gastrointestinal tract. Cancer Invest. 2001;19:554-568. [PubMed] [DOI] |
| 21. | Amemiya H, Kono K, Itakura J, Tang RF, Takahashi A, An FQ, Kamei S, Iizuka H, Fujii H, Matsumoto Y. c-Met expression in gastric cancer with liver metastasis. Oncology. 2002;63:286-296. [PubMed] [DOI] |
| 22. | Hattori Y, Itoh H, Uchino S, Hosokawa K, Ochiai A, Ino Y, Ishii H, Sakamoto H, Yamaguchi N, Yanagihara K. Immunohistochemical detection of K-sam protein in stomach cancer. Clin Cancer Res. 1996;2:1373-1381. [PubMed] |
| 23. | Yoo J, Park SY, Robinson RA, Kang SJ, Ahn WS, Kang CS. ras Gene mutations and expression of Ras signal transduction mediators in gastric adenocarcinomas. Arch Pathol Lab Med. 2002;126:1096-1100. [PubMed] |
| 24. | Lee JH, Abraham SC, Kim HS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Rashid A, Hamilton SR. Inverse relationship between APC gene mutation in gastric adenomas and development of adenocarcinoma. Am J Pathol. 2002;161:611-618. [PubMed] [DOI] |
| 25. | Ishii HH, Gobé GC, Pan W, Yoneyama J, Ebihara Y. Apoptosis and cell proliferation in the development of gastric carcinomas: associations with c-myc and p53 protein expression. J Gastroenterol Hepatol. 2002;17:966-972. [PubMed] [DOI] |
| 26. | Fricke E, Keller G, Becker I, Rosivatz E, Schott C, Plaschke S, Rudelius M, Hermannstädter C, Busch R, Höfler H. Relationship between E-cadherin gene mutation and p53 gene mutation, p53 accumulation, Bcl-2 expression and Ki-67 staining in diffuse-type gastric carcinoma. Int J Cancer. 2003;104:60-65. [PubMed] [DOI] |
| 27. | Ougolkov A, Yamashita K, Bilim V, Takahashi Y, Mai M, Minamoto T. Abnormal expression of E-cadherin, beta-catenin, and c-erbB-2 in advanced gastric cancer: its association with liver metastasis. Int J Colorectal Dis. 2003;18:160-166. [PubMed] |
| 28. | Zhou Y, Gao SS, Li YX, Fan ZM, Zhao X, Qi YJ, Wei JP, Zou JX, Liu G, Jiao LH. Tumor suppressor gene p16 and Rb expression in gastric cardia precancerous lesions from subjects at a high incidence area in northern China. World J Gastroenterol. 2002;8:423-425. [PubMed] [DOI] |
| 29. | Chetty R, Sitti CW. Cyclin E immunoexpression in gastric cancer does not correlate with clinicopathological parameters. Histopathology. 2003;42:66-69. [PubMed] [DOI] |
| 30. | Van Melderen L. Molecular interactions of the CcdB poison with its bacterial target, the DNA gyrase. Int J Med Microbiol. 2002;291:537-544. [PubMed] [DOI] |
| 31. | Lew BM, Paulus H. An in vivo screening system against protein splicing useful for the isolation of non-splicing mutants or inhibitors of the RecA intein of Mycobacterium tuberculosis. Gene. 2002;282:169-177. [PubMed] [DOI] |
| 32. | Dao-Thi MH, Charlier D, Loris R, Maes D, Messens J, Wyns L, Backmann J. Intricate interactions within the ccd plasmid addiction system. J Biol Chem. 2002;277:3733-3742. [PubMed] [DOI] |
| 33. | Carrió MM, Villaverde A. Role of molecular chaperones in inclusion body formation. FEBS Lett. 2003;537:215-221. [PubMed] [DOI] |
| 34. | Middelberg AP. Preparative protein refolding. Trends Biotechnol. 2002;20:437-443. [PubMed] [DOI] |
| 35. | Zhu H, Liu W, Shi W, Xue Y, Kuai L, Ma Z. In vitro renaturation of recombinant human pro-urokinase expressed in Escherichia coli. Chin Med J (Engl). 2001;114:186-190. [PubMed] |
| 36. | Chalmers JJ, Kim E, Telford JN, Wong EY, Tacon WC, Shuler ML, Wilson DB. Effects of temperature on Escherichia coli overproducing beta-lactamase or human epidermal growth factor. Appl Environ Microbiol. 1990;56:104-111. [PubMed] |
| 37. | Gavit P, Better M. Production of antifungal recombinant peptides in Escherichia coli. J Biotechnol. 2000;79:127-136. [PubMed] [DOI] |
| 38. | Yang Q, Xu J, Li M, Lei X, An L. High-level expression of a soluble snake venom enzyme, gloshedobin, in E. coli in the presence of metal ions. Biotechnol Lett. 2003;25:607-610. [PubMed] [DOI] |