修回日期: 2003-08-05
接受日期: 2003-10-07
在线出版日期: 2004-03-15
目的: 探讨饮食中铁过载诱导肝组织纤维化形成的组织学变化.
方法: 采用♂SD大鼠, 在饮食中适量添加铁, 共饲喂9 wk, 然后处死动物, 收取肝组织, 分别在石蜡切片和透射电镜下观察肝组织损害、肝窦毛细血管化和窦周纤维化形成以及Ⅰ、Ⅳ型胶原和Laminin的分布情况.
结果: 铁剂组大鼠可见肝细胞凝固坏死, 星状细胞活化, 肝窦毛细血管化和轻微窦周纤维化, Ⅰ型胶原和laminin含量增多, 中央静脉基底膜增厚.
结论: 饮食中铁过载持续一定时间可损害肝细胞, 激活肝星状细胞, 减少窦内皮细胞的窗孔, 导致肝窦毛细血管化和窦周肝纤维化, 故酒精性肝病造模可考虑配合使用.
引文著录: 徐光福, 葛桂玲, 李澎涛, 田德禄, 姜良铎, 杨晋祥. 铁剂诱发大鼠肝纤维化的组织学变化. 世界华人消化杂志 2004; 12(3): 714-718
Revised: August 5, 2003
Accepted: October 7, 2003
Published online: March 15, 2004
AIM: To study the histological changes of hepatic fibrosis induced by diet iron overload in SD rats.
METHODS: After living on an iron overload in diet for 63 d, the male SD rats were decollated and the livers were harvested to examine the liver indexes, morphology of hepatocytes, hepatic stellate cells (HSC), sinusoidal endothelial cells, sinusoid, peri-sinusoid, and distribution of collagen type III and laminin were also observed.
RESULTS: On model rats there were coagulation necrosis of hepatocytes, activated HSC, sinusoidal endothelial cells with less fenestrae, sinusoidal capillarization and light peri-sinusoid fibrosis, thickened basement of central vein, more collagen types I and II and laminin than those in normal controls.
CONCLUSION: Iron overload in diet for some time can injure hepatocytes, activate HSC, decrease the fenestrae of sinusoidal endothelial cell, and result in sinusoidal capillarization and peri-sinusoid fibrosis. It may be feasible to establish an ALD model with iron overload in diet.
- Citation: Xu GF, Ge GL, Li PT, Tian DL, Jiang LD, Yang JX. Changes of hepatic fibrosis induced by iron overload in SD rats. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 714-718
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/714.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.714
酒精性肝病模型大致可分成酒精灌胃和Tsukamoto-French 模型两种, 前者需要每天灌胃数次, 对动物损害较大, 操作不熟练易造成意外死亡; 各单位对每天应该给予的酒精量尚未得出一致意见, 主要问题是酒精量小不易成模, 酒精量大动物容易死亡, 导致造模失败, 而且常需要在酒精之外添加辅助材料如吡唑或者玉米油、羰基铁之类才能较易成模, 不如纯酒精造成者更有说服力, 但操作简便、成本较低是其优点. Tsukamoto-French 模型需要一次手术和附加设备, 除此之外仅需酒精即可, 不需添加辅助材料, 优势明显但价格昂贵, 国内尚未广泛采用. 铁过载可以促进脂质过氧化, 导致氧化应激, 破坏生物膜完整性并妨碍线粒体呼吸链电子传递, 造成细胞器质性损害和ATP下降, 并可以活化肝星状细胞, 甚至造成严重的肝纤维化和肝硬化. 轻微铁过载对肝脏的影响尚未见详细报道, 我们的酒精性肝病模型采用了添加羰基铁的办法, 为了阐明其在酒精性肝病模型形成中的作用, 我们探讨适量铁过载诱发肝纤维化的组织学变化如下.
北京维通利华公司SD♂大鼠, 体质量130-150 g. 羰基铁(carbonyl iron)购自美国Sigma公司; 多克隆一抗typeⅠ, Ⅳcollagen 和 laminin均购自美国抗体诊断公司(antibody diagnostic inc, ADI), 由上海长岛抗体诊断试剂公司经销. PV-6001 Kits为美国PowerVision公司产品, 显色剂ZLI-9030, 防脱片剂ZLI9001, 均购自北京中山公司.
动物设正常组6只, 铁剂组6只. 采用正常饲料喂养, 辅以混合试剂灌胃的方法, 羰基铁35 mg/kg, 麦芽-糊精和黄原胶适量, 每周灌5 d, 休2 d, 自由进食、水, 共9 wk. 第9 wk末由下腔静脉放血处死动物, 自肝边缘垂直向内剪取3-5 mm宽的右叶组织, 取靠近边缘横切1 mm3以30 g/L戊二醛固定液固定作透射电镜标本, 再横切3-5 mm3组织以100 g/L甲醛固定, 按常规制作光镜切片, 厚4 m, 作HE, Masson 三色染色及免疫组化染色, 用美国3Y公司产品MIS-2000图像分析系统进行光镜观察、拍照并使用自带软件作图像分析半定量. 按常规制作透射电镜切片, 厚80 nm, 在80KV JEM-1200EX电子显微镜下观察超微结构并照相.
统计学处理 采用SPSS 10.0软件对数据进行方差分析.
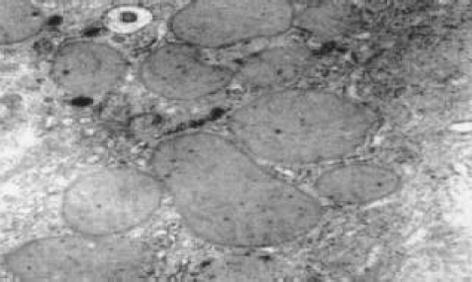
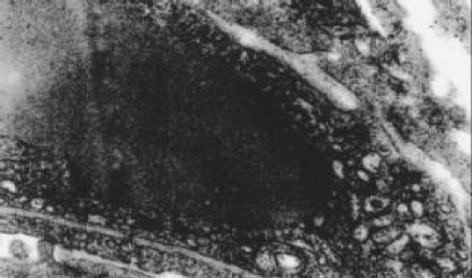
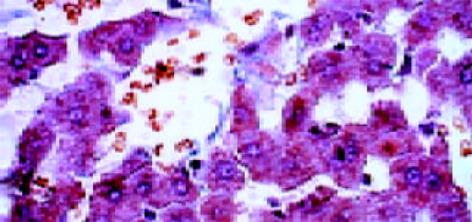
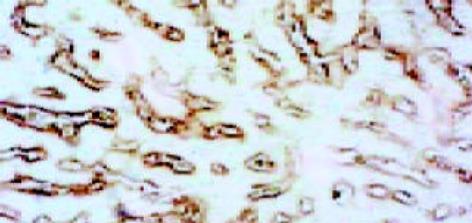
正常肝细胞核清晰, 圆形, 染色质疏密均匀, 胞内无铁质沉积, 线粒体正常大小, 嵴清楚, 粗面内质网围绕胞核排列, 可见大量糖原. 狄氏间隙星状细胞不明显, 内皮细胞有多数筛孔, 外部未见明显基底膜和胶原原纤维, 由肝细胞的微绒毛紧密接触. 铁剂组肝细胞核发生皱缩变形, 线粒体普遍肿胀, 无嵴, 粗面内质网数量减少, 结构紊乱, 可见铁颗粒沉积于肝细胞内, 肝细胞微绒毛增粗变短或者断裂. 肝星状细胞核清晰、深染, 染色质较粗大靠近核周边, 在细胞附近可见大量胶原原纤维. 血窦内皮细胞多数胞质疏松、水肿, 胞质中易见致密状包含体, 其形态为类圆形、数个至十余个不等, 由单层膜包绕, 筛孔减少或消失, 外周被清晰完整的基底膜包绕, 基底膜外尚可见胶原原纤维(图1-3).
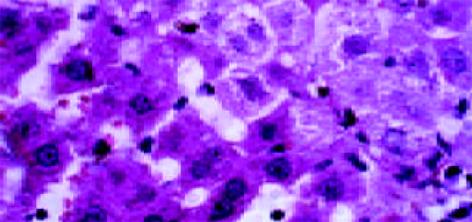
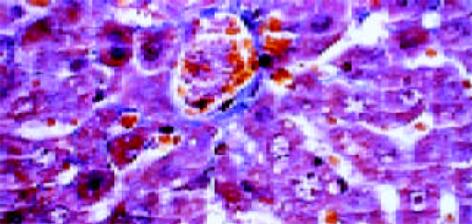
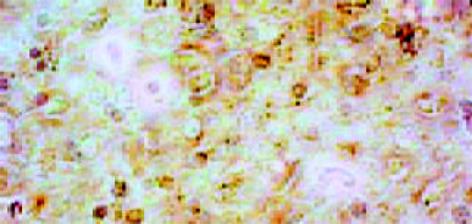
正常肝组织肝索排列清晰、整齐, 肝细胞含多数糖元, 并呈现异型性. 中央静脉基底膜不可见, 汇管区结构正常. 铁剂组可见汇管区略微增宽, 管道的基膜增厚. 肝索结构基本保留, 但肝细胞结构不清, 细胞皱缩, 少量凝固坏死和炎细胞浸润, 间质细胞增生活跃(图4, 5).
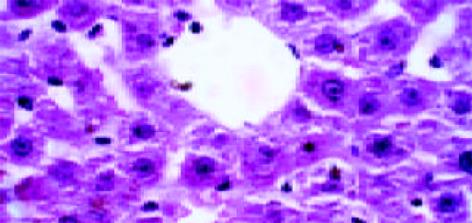
正常组肝组织结构同前所见, 中央静脉基底膜仅见轻微染色, 肝细胞周围阳性染色基本不可见. 铁剂组中央静脉基底膜明显增厚, 并与轻微窦周纤维化的纤维互相连续, 肝细胞凝固坏死和部分脂肪变性, 但肝索结构基本保留(图6, 7).
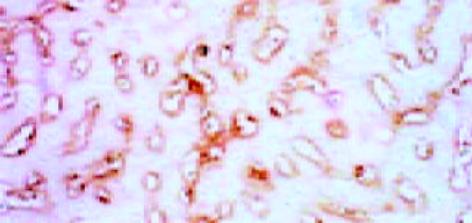
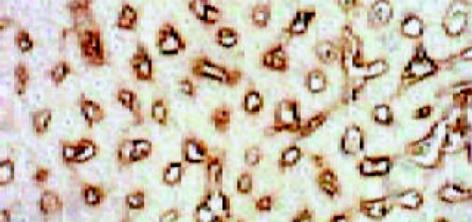
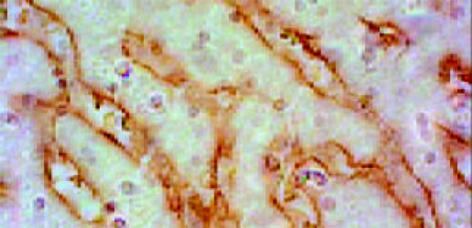
正常肝组织有一定量Ⅰ型胶原存在, 但分布不均匀, 靠近肝腺泡Ⅲ区较少, 而靠近肝腺泡Ⅰ区较明显. 铁剂组则明显增多而两个区域无明显差别(图8, 9). Ⅳ型胶原在正常组有一定含量, 分布无明显差异, 铁剂组略为增多, 但无显著性差异(图10, 11). Laminin在正常组染色很弱, 铁剂组则明显增多, 且分布均匀(图12, 13, 表1).
缺铁导致的贫血、免疫功能和注意力低下、经常性头痛和末梢神经障碍等, 在上个世纪得到全球高度重视. 已经证明改善膳食结构、使用铁强化食品等可以改善缺铁状态. 以前人们认为身体内储存的铁无害, 然而近年研究发现并非如此. 人类可由于大量食用铁强化食品、使用铁制炊具、超量服用抗坏血酸, 饮用柠檬酸, 嗜酒、输血、胰岛素抵抗[1-3]等而导致体内铁过多. 人体流行病学调查和动物实验都显示铁过多与心脏病、肿瘤、糖尿病、关节炎、骨质疏松症、肝硬化等有关[4-6].
铁过载造成肝脏损害的经典例子是遗传性血色病(genetic hemochromatosis). 近年有学者研究铁过载造成肝纤维化的机制, 如Bridle et al[7]报道铁离子沉积本身可以引起炎症反应, 并可以检测到细胞因子如白介素10、CD3、TGF-1、TNF-、-干扰素、CD68、CD45RO等的变化. 遗传性血色病基因的杂合子表现出更容易受到铁过载的不良影响, 并会不同程度的加重其他疾病的病情. 已经有研究报道[8-9]该基因表达与其他疾病的关系. 机体没有该基因, 仅仅饮食中铁过载造成肝脏损害的机制和后果尚不很清楚; 另外铁的作用位点意见不尽一致, 如Kim et al[10]报道肝硬化患者铁在肝细胞的沉积含量与门静脉周围感染或者碎屑样坏死的严重程度没有关系. Grizzi et al[11]发现铁过载可以严重损害肝脏实质和非实质细胞, 并且是主要的肝纤维化促进因子之一. Raynard et al[12]认为肝脏铁过载在酒精性肝病中是独立的致纤维化因素. Karbownik et al[13]认为铁可以诱导肝脏微粒体膜的过氧化损害, 有利于癌症发生. Angelucci et al[14]报道丙型肝炎伴随的铁过载是独立的肝纤维化促进因子. Gardi et al[15]更证明铁可以在不影响血清因子和不借助脂质过氧化的情况下, 促进胶原合成. 铁还可以促进HSC分泌活化的MMP-2, 如所周知, MMP-2活化是HSC活化的标志, 这更证明了铁是一个HSC活化并分泌胶原的启动促进因子. Chitturi et al[16]认为铁过载可能参与胰岛素抵抗和非酒精性脂肪性肝炎的发病, 减少铁含量可能有助于治疗. Huang et al[17] 认为大多数酒精性脂肪肝均与铁过载有关, 且血清铁和血清层粘蛋白含量关系密切. Parkes et al[18]报道铁过载导致肝细胞损伤后, 受损肝细胞释放TGF-Beta可能是导致HSC发生纤维增生表现的原因. 但其他学者报道[19-20] 氧化应激基因和乙醛结合物仅见于充满铁的间质细胞, HSC活化和纤维化的发生是因为铁在间质细胞的积聚引起, 线粒体中去铁敏-螯合物池积聚和线粒体氧化代谢机制受损、ATP下降, 而附近的肝细胞则幸免. Arezzini et al[21]报道单独接受铁添加的小鼠表现为轻度肝纤维化, 但铁促进亚毒性剂量CCl4所造成的肝硬化. Brittenham [22]报道铁和酒精可从受损肝细胞、库普弗细胞、HSC和细胞外基质等方面互相加重并促进肝纤维化, 而且对细胞器的氧化应激损害可能已经影响到信号传导水平. Fiorelli et al[23] 认为非转铁蛋白结合铁在诱导脂质过氧化方面较抗氧化剂屏障功能下降更加重要, 即使在细胞还原剂NADPH存在的情况下, 非转铁蛋白结合铁亦可以参与自由基反应. DeFeo et al[24] 也发现非转铁蛋白结合铁在肝硬化患者较非肝硬化患者要高得多, 证实铁在酒精性肝硬化形成中具有特殊作用. 早有学者证实铁过载可以导致沙土鼠肝脏线粒体不可逆性损伤, 而铁螯合剂口服[25]对人类铁过载初步显示有较好防治效果, 也反证铁过载的致病作用.
上述研究结果的不尽一致说明该领域需要更多的资料. 二价铁离子可导致线粒体膜脂质过氧化损伤, 使其呼吸链障碍, ATP产生减少, 线粒体肿胀, 嵴丢失等. 三价铁粒子诱发肝细胞微粒体膜硬化和脂质过氧化, 并降低膜的流动性, 细胞可发生过氧化损伤甚至癌变. 铁可催化超氧化物阴离子的羟化反应, 自由基产生增多导致氧化应激, 损害生物膜和蛋白质, 还可能损害DNA, 增加发生肿瘤、动脉硬化和心力衰竭的危险, 或至少损害心血管系统. 微粒体脂质过氧化可产生丙二醛, 10种微粒体蛋白质可与丙二醛形成加合物, 并导致细胞损伤、铁质沉着症、肝细胞坏死、ALT上升、肝组织羟脯氨酸含量上升等, 甚至会损害红细胞. 我们的观察发现铁剂可对大鼠肝细胞造成损害, 表现为线粒体肿胀、嵴消失, 细胞核皱缩变形, 粗面内质网紊乱断裂等, 进一步证明铁对肝细胞的直接毒性作用. 铁颗粒在肝细胞内的沉积和病变同时发生是直接证据. HE染色切片显示肝细胞呈凝固变性、坏死等也提供佐证. 肝细胞损伤机制可能与脂质过氧化和氧化应激有关, 后二者可引起肝细胞脂质代谢紊乱, 部分肝细胞的脂肪变性可能通过此种机制而形成. 本实验还发现HSC活化并分泌大量胶原原纤维非常明显, 但HSC内部铁颗粒较少, 线粒体肿胀、嵴丢失同样存在, 铁可能直接激活HSC, 同时肝细胞损伤所释放的细胞因子也可以导致HSC活化, 我们倾向于这两种机制同时存在. 另外观察到肝窦内皮细胞的内含物囊泡较多, 据报道这也是一个内皮细胞活化的征象, 象征着肝窦毛细血管化.
国外学者发现酒精可增加铁的摄入和沉积, 组织化学染色显示酒精摄入导致三价铁在小叶中心集聚. 铁和酒精可协同引起脂质过氧化和纤维化, 铁过载可单独引起, 随后酒精可加强之, 二者可共同增加肝细胞损害和纤维化进程. 但也有学者认为饮酒与铁吸收增多无关. 晚近有学者报道铁沉积诱发的脂质过氧化发生在肝窦内皮细胞, 特别是1区的窦内皮细胞多见; 而脂肪变性所诱发者则作用于肝腺泡三区肝细胞, 其促进纤维化形成机制与铁过载所引起者不同, 说明铁过载是一个单独的肝纤维化诱发因素. 有学者证实铁染色积分是相对独立的酒精性肝病肝纤维化诱发因素. 嗜酒者血清中存在一种非运铁蛋白结合的铁, 饮酒量越多则含量越高, 并且肝硬化也越重, 说明饮酒能增加铁的摄入是确实的. 因此考虑在酒精性肝病模型制造中添加铁, 有其合理方面.
铁能通过肝脏细胞的脂质过氧化和氧化应激途径诱发HSC活化, 而脂质过氧化和氧化应激是肝纤维化的诱发因素. 本实验透射电镜观察到铁剂组肝HSC细胞核染色质变粗深染, 细胞体丰满, 细胞外堆积大量胶原原纤维, 显示HSC已经活化并强化了合成分泌功能. HE染色显示间质细胞核深染可能与此有关, Masson-HE染色发现中央静脉基底膜增厚并与肝细胞周围窦周纤维化相连接等, 与此吻合. 正常肝组织Ⅰ型胶原有一定含量, 但肝腺泡Ⅲ区很少, 铁剂组则明显增多, 说明铁过载可增加肝腺泡Ⅲ区的Ⅰ型胶原含量, 这可能作为主要成分参与了窦周纤维化的形成. 通常认为Ⅳ型胶原和laminin是构成肝窦基底膜的主要成分[26-27], 我们观察到正常基底膜Ⅳ型胶原有一定含量, 铁剂组略有增多, 但无统计学差异, 说明轻微铁过载对基底膜Ⅳ型胶原代谢影响不大, 这一点与混合酒精灌胃饮料所引起者不同, 虽然该饮料含有铁, 但在致病机制方面有差别, 铁不能代替该饮料(全文另发). laminin正常时染色较弱, 结果与大多数学者报道一致, 说明正常的肝窦基底膜以Ⅳ型胶原为主组成, 但电镜下不可见; 铁剂组laminin含量明显增多, 提示本模型肝窦基底膜形成可能主要归因于laminin增多所致. 肝窦毛细血管化包括肝窦内皮的失窗孔和基底膜形成两大变化, 我们观察证实此点, 说明轻微铁过载本身可诱发酒精性肝病特征性病理变化如窦周纤维化和肝窦毛细血管化, 而细胞组织的坏死并不严重, 仅有个别肝细胞点状凝固坏死发生, 肝小叶结构得以较完整保留, 这对明铁在酒精性肝病形成中有特殊作用. 接受单纯饮食中铁过载的动物整体表现如精神状态、体质量增加速度等未发现与正常动物有差异, 说明轻微铁过载在临床上可能不易察觉. 我们的结论是: 饮食中轻微铁过载可以损伤肝细胞, 激活HSC, 并引起肝纤维化和肝窦毛细血管化; 在酒精性肝病模型制造中添加铁过载因素有其合理性, 可能会缩短造模时间, 但肝损害加重是否影响动物生命安全, 导致造模失败则有待观察, 合适的剂量可能是关键所在. 此外, 铁诱发肝纤维化的机制值得进一步探讨.
编辑: N/A
| 1. | Guillygomarc'h A, Mendler MH, Moirand R, Lainé F, Quentin V, David V, Brissot P, Deugnier Y. Venesection therapy of insulin resistance-associated hepatic iron overload. J Hepatol. 2001;35:344-349. [PubMed] [DOI] |
| 2. | Turlin B, Mendler MH, Moirand R, Guyader D, Guillygomarc'h A, Deugnier Y. Histologic features of the liver in insulin resistance-associated iron overload. A study of 139 patients. Am J Clin Pathol. 2001;116:263-270. [PubMed] [DOI] |
| 3. | Chitturi S, George J. Interaction of iron, insulin resistance, and nonalcoholic steatohepatitis. Curr Gastroenterol Rep. 2003;5:18-25. [PubMed] [DOI] |
| 5. | Schumann K. Safety aspects of iron in food. Ann Nutr Metab. 2001;45:91-101. [DOI] |
| 6. | Huang CW, Bai L. [Iron overload and liver diseases]. Di Yi Jun Yi Da Xue Xue Bao. 2002;22:370-371. [PubMed] |
| 7. | Bridle KR, Crawford DH, Fletcher LM, Smith JL, Powell LW, Ramm GA. Evidence for a sub-morphological inflammatory process in the liver in haemochromatosis. J Hepatol. 2003;38:426-433. [DOI] |
| 8. | Tung BY, Emond MJ, Bronner MP, Raaka SD, Cotler SJ, Kowdley KV. Hepatitis C, iron status, and disease severity: relationship with HFE mutations. Gastroenterology. 2003;124:318-326. [PubMed] [DOI] |
| 9. | Bonkovsky HL, Lambrecht RW, Shan Y. Iron as a co-morbid factor in nonhemochromatotic liver disease. Alcohol. 2003;30:137-144. [PubMed] [DOI] |
| 10. | Kim MJ, Mitchell DG, Ito K, Kim JH, Pasqualin D, Rubin R. Hepatic iron deposition on magnetic resonance imaging: correlation with inflammatory activity. J Comput Assist Tomogr. 2002;26:988-993. [PubMed] [DOI] |
| 11. | Grizzi F, Ceva-Grimaldi G, Franceschini B, Roncalli M, Chiriva-Internati M, Dioguardi N. Simultaneous staining of cytoplasmic iron and collagen matrix in human liver biopsy specimens. Eur J Histochem. 2002;46:101-104. [PubMed] [DOI] |
| 12. | Raynard B, Balian A, Fallik D, Capron F, Bedossa P, Chaput JC, Naveau S. Risk factors of fibrosis in alcohol-induced liver disease. Hepatology. 2002;35:635-638. [DOI] |
| 13. | Karbownik M, Reiter RJ, Garcia JJ, Cabrera J, Burkhardt S, Osuna C, Lewinski A. Indole-3-propionic acid, a melatonin-related molecule, protects hepatic microsomal membranes from iron-induced oxidative damage: relevance to cancer reduction. J Cell Biochem. 2001;81:507-513. [DOI] |
| 14. | Angelucci E, Muretto P, Nicolucci A, Baronciani D, Erer B, Gaziev J, Ripalti M, Sodani P, Tomassoni S, Visani G. Effects of iron overload and hepatitis C virus positivity in determining progression of liver fibrosis in thalassemia following bone marrow transplantation. Blood. 2002;100:17-21. [PubMed] [DOI] |
| 15. | Gardi C, Arezzini B, Fortino V, Comporti M. Effect of free iron on collagen synthesis, cell proliferation and MMP-2 expression in rat hepatic stellate cells. Biochem Pharmacol. 2002;64:1139-1145. [PubMed] [DOI] |
| 16. | Chitturi S, George J. Interaction of iron, insulin resistance, and nonalcoholic steatohepatitis. Curr Gastroenterol Rep. 2003;5:18-25. |
| 17. | Huang CW, Bai L, Cai JJ, Guo W, Lan L. [Relationship of serum iron and ferritin with the indicators for hepatic fibrosis]. Di Yi Jun Yi Da Xue Xue Bao. 2003;23:466-468. [PubMed] |
| 18. | Parkes JG, Templeton DM. Modulation of stellate cell proliferation and gene expression by rat hepatocytes: effect of toxic iron overload. Toxicol Lett. 2003;144:225-233. [PubMed] [DOI] |
| 19. | Pietrangelo A, Montosi G, Garuti C, Contri M, Giovannini F, Ceccarelli D, Masini A. Iron-induced oxidant stress in nonparenchymal liver cells: mitochondrial derangement and fibrosis in acutely iron-dosed gerbils and its prevention by silybin. J Bioenerg Biomembr. 2002;34:67-79. [PubMed] [DOI] |
| 20. | Masini A, Ceccarelli D, Giovannini F, Montosi G, Garuti C, Pietrangelo A. Iron-induced oxidant stress leads to irreversible mitochondrial dysfunctions and fibrosis in the liver of chronic iron-dosed gerbils. The effect of silybin. J Bioenerg Biomembr. 2000;32:175-182. [PubMed] [DOI] |
| 21. | Arezzini B, Lunghi B, Lungarella G, Gardi C. Iron overload enhances the development of experimental liver cirrhosis in mice. Int J Biochem Cell Biol. 2003;35:486-495. [PubMed] [DOI] |
| 23. | Fiorelli G, De Feo TM, Duca L, Tavazzi D, Nava I, Fargion S, Cappellini MD. Red blood cell antioxidant and iron status in alcoholic and nonalcoholic cirrhosis. Eur J Clin Invest. 2002;32 Suppl 1:21-27. [PubMed] [DOI] |
| 24. | De Feo TM, Fargion S, Duca L, Cesana BM, Boncinelli L, Lozza P, Cappellini MD, Fiorelli G. Non-transferrin-bound iron in alcohol abusers. Alcohol Clin Exp Res. 2001;25:1494-1499. [DOI] |