修回日期: 2003-09-25
接受日期: 2003-10-06
在线出版日期: 2004-03-15
目的: 探讨L-精氨酸对酒精性肝脂肪变大鼠肝组织NOS表达及氧应激的影响.
方法: 采用在饮水中加入酒精的方法建立酒精性肝脂肪变动物模型. 32只SD大鼠随机分成4组, 每组8只. A, B组分别喂饲400 mL/L乙醇至16, 20 wk; C组喂饲乙醇同B组, 自17 wk起腹腔注射L-精氨酸; D组为正常对照组. B, D组自17 wk起腹腔注射等量的生理盐水. 应用免疫组化和逆转录多聚酶链反应(RT-PCR)的方法检测肝组织中NOS的蛋白和mRNA表达, 同时测定肝组织中NO, MDA, GSH, SOD含量, 并观察肝组织病理变化.
结果: A, B组肝组织出现了不同程度脂肪变性, B组更为显著(t = 76.5, P<0.05).与D组相比, A, B组肝组织中NO, MDA含量、iNOS表达明显增高(P<0.01); GSH, SOD含量、eNOS表达明显降低(P<0.05).与B组相比, C组肝组织脂肪变性被逆转或明显减轻(t = 62.5, P<0.05), NO含量无显著改变, MDA含量、iNOS表达明显降低(P<0.05); GSH, SOD含量及eNOS表达明显升高(P<0.05).
结论: L-精氨酸对酒精性肝脂肪变的治疗作用可能与iNOS表达降低、eNOS表达升高以及氧应激减轻有关.
引文著录: 田德安, 洪捷敏, 刘南植, 王家马龙. L-精氨酸对酒精性肝脂肪变大鼠肝组织NOS表达及氧应激的影响. 世界华人消化杂志 2004; 12(3): 702-705
Revised: September 25, 2003
Accepted: October 6, 2003
Published online: March 15, 2004
AIM: To study the effects of L-arginine on the expression of nitric oxide synthase and oxidative stress in rat liver tissues with alcoholic hepatic steatosis.
METHODS: The rat alcoholic hepatic steatosis models were made with ethanol supplied in the drinking water.32 SD rats were randomly divided into four groups (n = 8 in each group). Rats were fed with 400 mL/L ethanol for up to 16 (group A) or 20 (group B) wks. Rats in group C were fed with ethanol as rats in group B and administered with L-arginine by intraperitoneal injection from the 17th wk. Group D was the normal control. Rats in groups B and D were administered normal saline by intraperitoneal injection from the 17th wk. The expression of protein and mRNA of NOS in the liver was detected with immunohistochemistry and reverse transcription polymerase chain reaction. Meanwhile, NO, MDA, GSH,SOD contents were measured and histopathological changes were observed in the liver tissues.
RESULTS: In groups A and B, different degrees of steatosis could be seen. Steatosis was more significant in group B than in group A (t = 76.5, P < 0.05). Compared to group D, NO and MDA contents and the expression of iNOS were significantly increased (P < 0.01). However, GSH and SOD contents and the expression of eNOS were significantly decreased (P < 0.05) in groups A and B. In comparison to group B, steatosis in the liver was reversed or significantly lessened (t = 62.5, P < 0.05), NO contents were unchanged, MDA contents and the expression of iNOS were significantly decreased (P<0.05), GSH and SOD contents and the expression of eNOS were markedly increased in the group C (P < 0.05).
CONCLUSION: The therapeutic effects of L-arginine on alcoholic hepatic steatosis are probably involved in decreased iNOS expression, increased eNOS expression and alleviated oxidative stress.
- Citation: Tian DA, Hong JM, Liu NZ, Wang JL. Effects of L-arginine on expression of nitric oxide synthase and oxidative stress in rat liver tissues with alcoholic hepatic steatosis. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 702-705
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/702.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.702
L-精氨酸不仅能显著减轻或完全阻止大鼠酒精引起的肝损害[1], 而且能逆转酒精所导致的肝脏炎症和纤维化[2], 提示L-精氨酸对酒精性肝损害有预防和治疗作用.关于L-精氨酸的作用机制, 目前尚不清楚. 我们研究L-精氨酸对酒精性肝脂肪变大鼠肝组织NOS表达及氧应激的影响, 探讨L-精氨酸作用的可能机制.
健康♂SD大鼠32只, 体质量180-220 g, 由华中科技大学同济医学院动物中心提供; 丙二醛 (MDA)、超氧化物歧化酶 (SOD)、谷胱甘肽(GSH) 、一氧化氮(NO)试剂盒购自南京建成生物工程研究所; 兔抗鼠iNOS及eNOS多克隆抗体购自美国Santa Cruz公司; 免疫组织化学试剂盒(SP法)购自北京中山生物技术有限公司; Trizol一步法RNA提取试剂购自美国Gibco公司; iNOS, eNOS及GAPDH引物均由北京赛北盛工程公司合成; RT-PCR试剂购自美国Promega公司产品; L-精氨酸由上海政翔化学试剂研究所生产.
将实验大鼠适应性饲养1 wk后, 随机分成A, B, C, D四组, 每组8只. 采用在饮水中加入酒精的方法建立酒精性肝脂肪变动物模型, 造模方法为: 先给大鼠随意饮用20 g/L蔗糖溶液3 d, 然后再加入50 mL/L 的乙醇, 每隔4 d增加50 mL/L直至150 mL/L, 然后再每周增加50 mL/L直至终浓度为400 mL/L, 从此开始计算造模时间[3-4], 大鼠进食普通饲料(脂肪占50 g/L). A组造模时间为16 wk, B组为20 wk. C组为L-精氨酸干预组, 乙醇喂饲同B组, 另从17 wk开始每日腹腔注射L-精氨酸100 mg/kg. D组为正常对照组, 饮用20 g/L蔗糖溶液, 时间为20 wk. B, D组从17 wk开始每日腹腔注射等量的生理盐水.
1.2.1 肝组织NO, MDA, GSH和SOD含量测定: 大鼠颈椎脱臼处死后, 取肝右叶1 g湿重组织, 4 ℃下加生理盐水制成100 g/L的匀浆, 1 000 r/min离心5 min后取上清, 硝酸还原酶法测NO代谢产物NO2-和NO3-间接反映NO水平, 硫代巴比妥酸法检测MDA含量, 二硫代二硝基苯甲酸法测定GSH含量, 黄嘌呤氧化酶法测定SOD活力(肝匀浆稀释成10 g/L的浓度), 双缩脲法测定肝组织中蛋白含量.
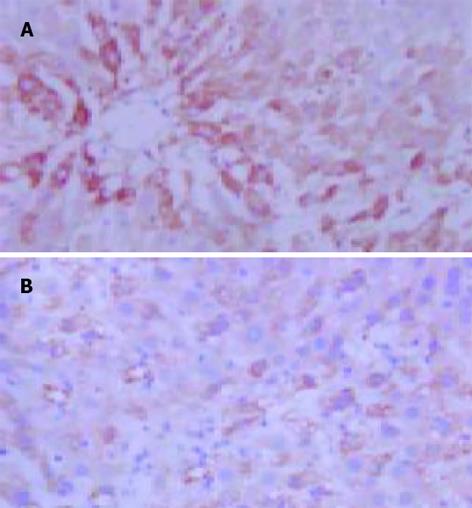
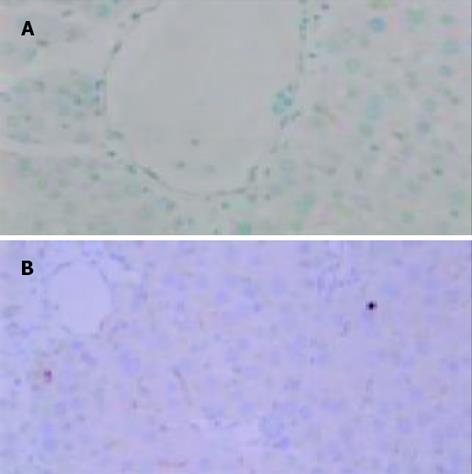
1.2.2 肝组织病理和免疫组化检查: 取肝左叶组织, 40 g/L甲醛固定, 石蜡包埋, 5 m切片, HE染色, 光学显微镜下观察肝组织病理变化. 肝细胞脂肪变性的半定量指标(中华病理学杂志1994; 23: 14-16)按脂变肝细胞占肝细胞总数的百分数分为5个等级, 即: 脂变肝细胞<0.05为-; 0.05-0.25为+; 0.26-0.50为++; 0.51-0.70为+++; 大于0.70为++++. eNOS, iNOS免疫组化染色采用SP法, 第一抗体的工作浓度均为1: 50, 操作流程按试剂盒说明书进行, 以PBS代替一抗作阴性对照. 联苯二胺(DAB)显色, 苏木素复染, 封片. 通过HPIAS-1000型图像分析仪进行图像分析处理得出平均A值, 作为eNOS, iNOS蛋白表达的相对含量.
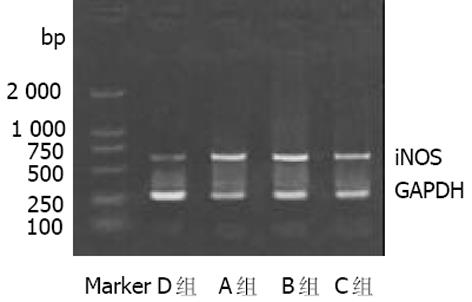
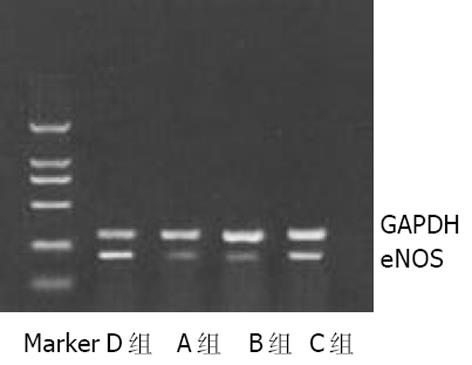
1.2.3 逆转录多聚酶链反应(RT-PCR): 采用Trizol一步法提取总RNA, 用DNA/RNA测定仪(英国Pharmarcia公司)检测RNA浓度和纯度. 取总RNA 4 g, 加入Oligo (dt)15引物及逆转录酶, 在20 L体系下, 45 ℃, 60 min完成逆转录反应, cDNA置-20 ℃保存. iNOS引物序列[5]为: 上游5'-ACA ACA GGA ACC TAC CAG CTC A -3', 下游5'-GAT GTT GTA GCG CTG TGT GTC A -3'; eNOS引物序列[5]为: 上游5'-GGA GAA GAT GCCAAG GCT GCT-3', 下游5'-CTT CCA GTG TCC AGA CGC ACC-3'; GAPD引物序列[5]为: 上游5'-CGG AGT CAA GGA TTT GGT CGT AT -3', 下游5'-AGC CTT CTC CAT GGT GGT GAA GAC -3'. 反应条件为iNOS: 94 ℃, 1 min; 60 ℃, 30 s; 72 ℃, 1 min; 30个循环; eNOS: 90 ℃, 1 min; 56 ℃, 30 s; 72 ℃, 1 min; 27个循环; GAPDH: 94 ℃, 1 min; 56 ℃, 30 s; 72 ℃, 1 min; 30个循环.iNOS, eNOS及GAPDH的扩增产物大小分别为651 bp, 224 bp和306 bp. 经15 g/L琼脂糖凝胶电泳, 利用MUVB-20凝胶分析系统(美国Ultralum公司)对扩增产物条带进行扫描, 分别以iNOS/GAPDH, eNOS/GAPDH的平均A值作为iNOS mRNA, eNOS mRNA表达的相对含量.
统计学处理 应用SAS 8.01版软件进行统计学分析.计量资料以mean±SD表示, 用方差分析检验组间的总差异, 两组间差异比较采用q检验, 等级资料采用秩和检验, P<0.05为差异有统计学意义.
B, C组分别有1, 2只大鼠死亡; A, D组大鼠全部存活. A组肉眼见肝脏明显肿大, 呈黄色缺血状, 表面有油腻感. HE染色显示肝细胞出现了+-++级脂肪变性, 主要见于肝腺泡II, III区, 为胞质内以大泡型为主的混合脂滴, 空泡将肝细胞核挤向一侧. B组肝细胞脂肪变性较A组更显著 (t = 76.5, P<0.05), 伴有轻度炎性细胞浸润. C组肝组织脂肪变性较B组明显减轻(t = 62.5, P<0.05), 表现为正常(5/6只)或+级脂肪变性(1/6只). D组大鼠肝组织的形态学表现正常, 肝脏色红, 肝窦清晰, 肝索排列整齐, 偶见个别肝细胞内有极少量细小脂滴散布于细胞核周围(表1).
iNOS阳性反应产物呈黄色或棕黄色, 主要位于肝细胞及单核巨噬细胞胞质中. D组(正常对照组)无或有少许iNOS表达; A, B组iNOS表达升高.A, B组iNOS平均A值较D组明显升高(P<0.01), 经L-精氨酸干预后, C组iNOS平均A值较B组明显降低(P<0.05, 图1AB). 各组肝组织iNOSmRNA RT-PCR结果与免疫组化结果类似(图3). eNOS阳性反应产物呈黄色或棕黄色, 主要位于肝脏血管内皮细胞胞质中. A, B组eNOS平均A值较D组明显降低(P<0.01), 经L-精氨酸干预后, C组eNOS平均A值与B组相比显著升高(P<0.05, 图2AB). 各组肝组织eNOSmRNA RT-PCR结果与免疫组化结果类似(图4).
A, B组肝组织NO, MDA水平与D组相比显著增高(P<0.01), 而GSH, SOD水平显著降低(P<0.05或 P<0.01). 与B组相比, 经L-精氨酸干预后, C组NO水平无明显改变(P>0.05), 而MDA水平显著降低(P<0.01); GSH, SOD水平显著升高(P<0.05, 表2).
酒精性脂肪肝形成机制较复杂, 由多种因素共同参与[6-11].目前有学者提出了关于脂肪肝发病机制的"二次打击"学说, 认为各种不同病因通过氧应激促使反应性氧化物(ROS)增加作为发病的基础机制[12]. ROS与膜磷脂的多不饱和脂肪酸起过氧化反应, 形成脂质过氧化物(LPO)[13]. 脂质过氧化可干扰脂肪酸的氧化, 导致脂肪在肝中蓄积[14]. 而脂质沉积的增多又能加重脂质过氧化反应, 遂形成恶性循环[15]. 本结果显示, A组大鼠肝组织中脂质过氧化产物MDA含量明显增加, 而反映抗氧化能力的指标GSH, SOD含量明显下降, 提示肝组织中促氧化物与抗氧化物之间的动态平衡失调, 导致氧应激和脂质过氧化, 促使肝脂肪变性发. B组大鼠肝组织中GSH, SOD含量下降更明显, 抗氧化能力进一步削弱, 氧自由基对肝脏的损害加剧, 脂肪变性程度也更重.
嗜酒人群和慢性酒精摄入大鼠由于酒精损害了肠黏膜屏障, 肠壁通透性增加, 细菌毒素移位, 致使血中内毒素水平升高[16-18], 而且慢性酒精摄入也使TNF-产生增加[19]. 内毒素、TNF-等可诱导iNOS基因表达[20], 而抑制eNOS基因转录[21-22], 降低eNOSmRNA的稳定性[23]使eNOS表达下调. 本实验表明, A, B组脂肪变性肝组织中iNOS表达明显上调, eNOS表达明显减少, 可能与内毒素、TNF-等的产生增加有关. 肝组织中iNOS, eNOS表达呈相反趋势, 但NO含量显著增加, 由此结果可推测, NO含量增加主要通过iNOS表达上调所引起. iNOS所产生的大量NO与O2-结合生成一种更强的氧化剂ONOO-[24], ONOO-不仅导致自由基反应加剧[25-26], 而且可氧化蛋白质巯基、Fe/S中心、锌指结构及硝基化蛋白质的酪氨酸残基, 从而使SOD, GSH等的合成和再生减少[27-28], 显著减弱了抗氧化酶清除自由基的能力, 导致组织损伤.同时eNOS表达下降, 肝组织灌注减少, 血小板聚集, 微血栓形成[29], 自由基产生增加[30], 进一步加重了对肝组织的损害.
Nanji et al[2]研究表明, NO前体L-精氨酸可降低酒精性肝损害大鼠血浆内毒素和肝组织TNF- mRNA水平. 本实验表明, 与B组相比, C组经L-精氨酸干预后, 由于诱导iNOS或下调eNOS表达的刺激因素作用降低, 肝组织中iNOS表达明显降低, eNOS表达明显升高, NO含量无明显改变. iNOS表达降低可减轻ONOO-对GSH、SOD等抗氧化酶的损害, GSH、SOD含量明显升高, 肝脏的抗氧化能力增强, 氧应激减轻, 脂质过氧化产物MDA含量减少. 同时eNOS表达升高可增加肝组织灌注, 减少血小板聚集及微血栓形成, 有利于肝组织的损伤修复[31], 因而给予L-精氨酸治疗后肝脂肪变性被逆转或明显减轻. 总之, L-精氨酸对酒精性脂肪肝的治疗作用可能与降低iNOS的表达、升高eNOS表达以及减轻氧应激有关.
编辑: N/A
| 1. | Nanji AA, Greenberg SS, Tahan SR, Fogt F, Loscalzo J, Sadrzadeh SM, Xie J, Stamler JS. Nitric oxide production in experimental alcoholic liver disease in the rat: role in protection from injury. Gastroenterology. 1995;109:899-907. [PubMed] [DOI] |
| 2. | Nanji AA, Jokelainen K, Lau GK, Rahemtulla A, Tipoe GL, Polavarapu R, Lalani EN. Arginine reverses ethanol-induced inflammatory and fibrotic changes in liver despite continued ethanol administration. J Pharmacol Exp Ther. 2001;299:832-839. [PubMed] |
| 3. | Keegan A, Martini R, Batey R. Ethanol-related liver injury in the rat: a model of steatosis, inflammation and pericentral fibrosis. J Hepatol. 1995;23:591-600. [PubMed] [DOI] |
| 5. | Liu H, Ma Z, Lee SS. Contribution of nitric oxide to the pathogenesis of cirrhotic cardiomyopathy in bile duct-ligated rats. Gastroenterology. 2000;118:937-944. [PubMed] [DOI] |
| 8. | Maher JJ. Alcoholic steatosis and steatohepatitis. Semin Gastrointest Dis. 2002;13:31-39. [PubMed] |
| 9. | Stewart S, Jones D, Day CP. Alcoholic liver disease: new insights into mechanisms and preventative strategies. Trends Mol Med. 2001;7:408-413. [PubMed] [DOI] |
| 11. | Piao YF, Li JT, Shi Y. Relationship between genetic polymorphism of cytochrome P450IIE1 and fatty liver. World J Gastroenterol. 2003;9:2612-2615. [PubMed] |
| 13. | Zhou JF, Cai D, Zhu YG, Yang JL, Peng CH, Yu YH. A study on relationship of nitric oxide, oxidation, peroxidation, lipoperoxidation with chronic chole-cystitis. World J Gastroenterol. 2000;6:501-507. [PubMed] |
| 14. | Rouach H, Fataccioli V, Gentil M, French SW, Morimoto M, Nordmann R. Effect of chronic ethanol feeding on lipid peroxidation and protein oxidation in relation to liver pathology. Hepatology. 1997;25:351-355. [PubMed] [DOI] |
| 16. | Parlesak A, Schäfer C, Schütz T, Bode JC, Bode C. Increased intestinal permeability to macromolecules and endotoxemia in patients with chronic alcohol abuse in different stages of alcohol-induced liver disease. J Hepatol. 2000;32:742-747. [PubMed] [DOI] |
| 17. | Zuo GQ, Gong JP, Liu CA, Li SW, Wu XC, Yang K, Li Y. Expression of lipopolysaccharide binding protein and its receptor CD14 in experimental alcoholic liver disease. World J Gastroenterol. 2001;7:836-840. [PubMed] [DOI] |
| 18. | Chen XM, Xu RL, Ma XH, Zhou YC, Han DW. Mucosal permeability to lipopolysaccharides in the colon in chronic alcoholic rats. China Nati J New Gastroenterol. 1996;2:125-127. [DOI] |
| 19. | Shi L, Kishore R, McMullen MR, Nagy LE. Chronic ethanol increases lipopolysaccharide-stimulated Egr-1 expression in RAW 264.7 macrophages: contribution to enhanced tumor necrosis factor alpha production. J Biol Chem. 2002;277:14777-14785. [PubMed] [DOI] |
| 20. | Taylor BS, Geller DA. Molecular regulation of the human inducible nitric oxide synthase (iNOS) gene. Shock. 2000;13:413-424. [PubMed] [DOI] |
| 21. | Anderson HD, Rahmutula D, Gardner DG. Tumor necrosis factor-alpha inhibits endothelial nitric-oxide synthase gene promoter activity in bovine aortic endothelial cells. J Biol Chem. 2004;279:963-969. [PubMed] |
| 22. | Lu JL, Schmiege LM 3rd, Kuo L, Liao JC. Downregulation of endothelial constitutive nitric oxide synthase expression by lipopolysaccharide. Biochem Biophys Res Commun. 1996;225:1-5. [PubMed] [DOI] |
| 23. | Yoshizumi M, Perrella MA, Burnett JC Jr, Lee ME. Tumor necrosis factor downregulates an endothelial nitric oxide synthase mRNA by shortening its half-life. Circ Res. 1993;73:205-209. [PubMed] [DOI] |
| 24. | Ferdinandy P, Schulz R. Nitric oxide, superoxide, and peroxynitrite in myocardial ischaemia-reperfusion injury and preconditioning. Br J Pharmacol. 2003;138:532-543. [PubMed] [DOI] |
| 25. | Radi R, Cassina A, Hodara R. Nitric oxide and peroxynitrite interactions with mitochondria. Biol Chem. 2002;383:401-409. [PubMed] [DOI] |
| 26. | Zhou JL, Jin GH, Yi YL, Zhang JL, Huang XL. Role of nitric oxide and peroxynitrite anion in lung injury induced by intestinal ischemia-reperfusion in rats. World J Gastroenterol. 2003;9:1318-1322. [PubMed] [DOI] |
| 27. | Pryor WA, Squadrito GL. The chemistry of peroxynitrite: a product from the reaction of nitric oxide with superoxide. Am J Physiol. 1995;268:L699-L722. [PubMed] |
| 28. | Squadrito GL, Pryor WA. Oxidative chemistry of nitric oxide: the roles of superoxide, peroxynitrite, and carbon dioxide. Free Radic Biol Med. 1998;25:392-403. [PubMed] [DOI] |
| 29. | Serracino-Inglott F, Virlos IT, Habib NA, Williamson RC, Mathie RT. Differential nitric oxide synthase expression during hepatic ischemia-reperfusion. Am J Surg. 2003;185:589-595. [PubMed] [DOI] |
| 30. | Hon WM, Lee KH, Khoo HE. Nitric oxide in liver diseases: friend, foe, or just passerby? Ann N Y Acad Sci. 2002;962:275-295. [PubMed] [DOI] |
| 31. | Bagchi D, Bagchi M, Stohs SJ, Das DK, Ray SD, Kuszynski CA, Joshi SS, Pruess HG. Free radicals and grape seed proanthocyanidin extract: importance in human health and disease prevention. Toxicology. 2000;148:187-197. [PubMed] [DOI] |