修回日期: 2003-11-25
接受日期: 2003-12-08
在线出版日期: 2004-03-15
目的: 通过检测胆囊癌组织中hPTTG1、bFGF的表达和胆囊癌组织血管生成状况, 探讨他们之间的相互关系及其与胆囊癌临床病理特征之间的关系.
方法: 用免疫组织化学SP法对41例胆囊癌和22例慢性胆囊炎组织中hPTTG1和bFGF的表达进行检测, 并用抗CD34抗体检测微血管密度(MVD). 用MVD反映血管生成情况.
结果: 原发胆囊癌组织中hPTTG1和bFGF的表达阳性率分别为82.9%和75.6%, 均高于在慢性胆囊炎中的表达阳性率(P = 0.002, 0.006). hPTTG1的表达与临床分期和淋巴结转移有关(P = 0.025, 0.007), 而与组织学分级无显著关系(P = 0.114); bFGF的表达与组织学分级、临床分期有关(P = 0.015, 0.019), 而与淋巴结转移无显著关系(P = 0.081); hPTTG1的表达与bFGF的表达密切相关(r = 0.648, P = 0.000). 二者的表达与患者的性别、年龄、肿瘤的种类, 是否伴有胆囊结石均无关. 胆囊癌组织MVD值明显大于慢性胆囊炎组织(P = 0.001). MVD分别与胆囊癌组织hPTTG1的表达及bFGF的表达有关(P = 0.000, 0.000). MVD与胆囊癌组织Nevin分期及淋巴结转移有关(P = 0.007, 0.024); 而与患者的性别、年龄、肿瘤的种类、分化程度、是否伴有胆囊结石均无关.
结论: hPTTG1的异常表达与胆囊癌的发生、发展过程及血管生成过程密切相关, 可能为胆囊癌的诊治提供了一条新的途径.
引文著录: 王江, 窦科峰. 胆囊癌组织hPTTG1和bFGF表达与血管生成的关系. 世界华人消化杂志 2004; 12(3): 680-684
Revised: November 25, 2003
Accepted: December 8, 2003
Published online: March 15, 2004
AIM: To investigate the expression of hPTTG1 and bFGF in human gallbladder carcinoma tissues and their correlation with angiogenesis and other clinicobiological behaviors.
METHODS: The expression of hPTTG1 and bFGF in 41 cases of human gallbladder carcinoma and 22 cases of chronic cholecystitis was detected by immunohistochemical staining (SP method). The microvessels were highlighted by immunohistochemical staining (SP method) to detect antigen of CD34. Angiogenesis was represented by intratumor microvessel density (MVD).
RESULTS: In the gallbladder carcinoma, the positive rates of hPTTG1 and bFGF were 82.9% and 75.6% respectively, which were significantly higher than those in the chronic cholecystitis (P = 0.002 and 0.006). The expression of hPTTG1 was significantly associated with clinical stages and lymph node metastasis status (P = 0.025, 0.007), but not with histological differentiation (P = 0.144). The expression of bFGF was significantly correlated with clinical stages and histological differentiation (P = 0.019, 0.015), but not with lymph node metastasis status (P = 0.081). There was a significant correlation between the expression of hPTTG1 and bFGF (r = 0.648, P = 0.000). Neither of them had relation with age, sex, histological type and cholelithiasis. The value of MVD in the gallbladder carcinoma was significantly higher than that in the chronic cholecystitis (t = 3.684, P = 0.001). The expression of hPTTG1 and bFGF was correlated with MVD in gallbladder carcinoma (P = 0.000, 0.000). MVD in the gallbladder carcinoma was significantly associated with clinical stages and lymph node metastasis status (P = 0.007, 0.024), but not with age, sex, histological type, histological differentiation and cholelithiasis.
CONCLUSION: Overexpression of hPTTG1 is related to the tumorigenesis and angiogenesis in gallbladder carcinoma, which may provide a new target for therapy of gallbladdercarcinoma.
- Citation: Wang J, Dou KF. Expression of hPTTG1 and bFGF in gallbladder carcinoma tissue and their correlation with angiogenesis. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 680-684
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/680.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.680
垂体瘤转化基因(pttg)是在大鼠垂体瘤细胞中发现的一种癌基因[1]. 人垂体瘤转化基因(hpttg)是一个至少包含有三个成员的基因家族, 其中hpttg1与肿瘤的发生、细胞增生和血管生成密切相关[2-7]. 血管生成是实体肿瘤生长和转移过程中的关键步骤[8-9]. 碱性成纤维细胞生长因子(bFGF)是重要的促血管生长因子, 在许多肿瘤组织中均有较高水平的表达, 与肿瘤的生长、转移关系密切[10-14]. 目前国内、外对于胆囊癌组织中hPTTG1表达尚无文献报道. 我们通过检测胆囊癌组织中hPTTG1和bFGF的表达及胆囊癌组织血管生成状况, 探讨他们之间的相互关系及其与胆囊癌临床病理特征之间的关系.
第四军医大学西京医院病理科存档, 1992-2002年根治性手术切除胆囊癌蜡块标本41例. 男13例, 女28例; 年龄32-80(平均60.3, 中位61岁). 其中腺癌36例(包括乳突状腺癌19例, 管状腺癌16例, 黏液腺癌1), 鳞癌2例, 腺鳞癌、腺棘癌、印戒细胞癌各1例. 高分化癌17例, 中分化癌12例, 低分化癌12例. Nevin Ⅰ期1例, Ⅱ期2例, Ⅲ期5例, Ⅳ期7例, Ⅴ期26例. 伴有结石22例, 有淋巴结转移31例. 另取慢性胆囊炎标本22例作为对照组. 抗hPTTG1兔抗人多克隆抗体(SK601[15])由Kakar S S教授(University of Louisville. USA)惠赠, 抗FGF-2 (bFGF)兔抗人多克隆抗体系Santa Cruz 公司产品. 抗CD34鼠抗人mAb及SP免疫组化试剂盒系北京中山生物技术公司产品, DAB显色剂系DAKO公司产品.
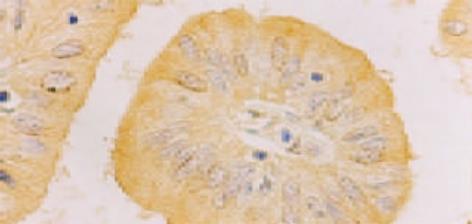
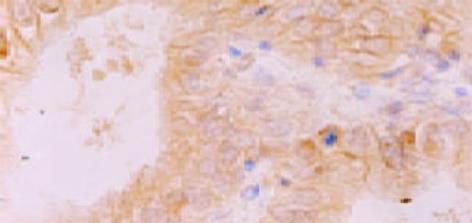
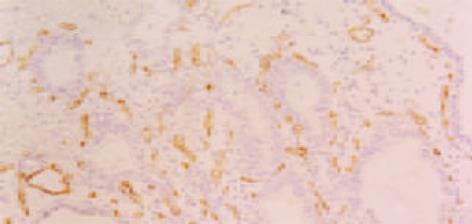
免疫组织化学SP法. 检测步骤: 组织切片常规脱蜡至水; 滴加3 mol/L尿素溶液室温静置30 min; PBS冲洗5 min×2; 置枸橼酸盐抗原修复液中用微波炉进行抗原修复10 min, 自然冷却至室温, PBS冲洗5 min×2; 30 mL/L H2O2浸泡20 min, PBS冲洗5 min; 正常山羊血清37 ℃封闭30 min, 分别滴加抗hPTTG1兔抗人多克隆抗体SK601(1: 100)、抗bFGF兔抗人多克隆抗体(1: 100)及抗CD34鼠抗人mAb (1: 50), 4 ℃冰箱过夜 ; PBS冲洗5 min×3; 滴加生物素标记二抗, 37 ℃孵育30 min; PBS冲洗5 min×3 min; 滴加辣根酶标记的链霉卵白素, 37 ℃孵育30 min; PBS冲洗5 min×3 min; DAB显色, 自来水冲洗, 苏木素复染, 封片. 同时用PBS代替一抗作染色的阴性对照, 用已知的染色阳性切片作阳性对照. 结果判断: hPTTG1以肿瘤细胞胞质出现棕黄色颗粒为阳性细胞(图1). bFGF以肿瘤细胞胞质出现棕黄色颗粒为阳性细胞(图2). 二者采取统一的评价标准. 在500倍光镜下至少观察5个视野, 肿瘤阳性细胞大于10%定义为阳性表达, 小于或等于10%为阴性表达. 用抗CD34抗体进行SP法免疫组化染色, 在微血管内皮细胞膜、胞质着色呈棕黄色(图3). 微血管密度(MVD)的测定参照Weidner et al (N Engl J Med 1992; 324: 1-8)的方法, 在低倍镜(×125)下对每张切片进行观察, 找出5个微血管高密度区域作为"热点", 再在高倍镜(×500)镜下对每个区域的微血管进行计数, 取5个区域的平均计数值即为MVD值. 典型的血管内皮细胞着色, 即使未形成管腔, 也可作为独立新生微血管计数. 依据形态差异剔除浆细胞与巨噬细胞.
统计学处理 采用SPSS10.0统计学软件, 采用独立样本t检验和方差分析以及x2检验和Spearman等级相关分析. 显著性水准定为: P<0.05.
hPTTG1主要分布在细胞质中, 部分胞核着色, 少量癌旁浸润肝脏细胞着色, 无明显间质中纤维及淋巴细胞着色. bFGF也主要分布在细胞质中, 部分胞核和血管内皮细胞着色. 胆囊癌组织hPTTG1表达阳性率高于慢性胆囊炎组织, 差别有显著意义(x2=9.545, P = 0.002 表1). 胆囊癌组织bFGF表达阳性率高于慢性胆囊炎组织, 差别有显著意义 (x2=7.438, P = 0.006 表1). hPTTG1在Nevin Ⅳ-Ⅴ期胆囊癌组织中表达阳性率高于Ⅰ-Ⅲ期胆囊癌组织, 差别有显著意义(x2=7.611, P = 0.025 表2); 伴有淋巴结转移的胆囊癌组织hPTTG1表达阳性率高于不伴有淋巴结转移胆囊癌组织, 差别有显著意义(x2=7.258, P = 0.007 表2). hPTTG1表达阳性率与性别、年龄、病理组织分化程度、病理类型、是否伴有胆石症无关. Nevin Ⅳ-Ⅴ期胆囊癌组织中bFGF表达阳性率明显高于Ⅰ-Ⅲ期, 差别有显著意义(x2=5.471, P = 0.019 表2). 中、低分化的胆囊癌组织bFGF表达阳性率明显高于高分化胆囊癌组织, 差别有显著意义(P = 0.015 表2). bFGF表达阳性率同性别、年龄、病理类型、是否伴有淋巴结转移及胆石症无关. 经Spearman 等级相关检验, 本组胆囊癌标本, hPTTG1表达阳性率同bFGF表达阳性率存在显著正相关关系(r = 0.648, P = 0.000).
| 组别 | n | PTTG1 | BFGF | MVD(个) | ||||||
| 阳性 | 阴性 | P 值 | 阳性 | 阴性 | P 值 | mean±SD | t值 | P值 | ||
| 胆囊癌 | 41 | 34 | 7 | 31 | 10 | 27±7 | ||||
| 慢性胆囊炎 | 22 | 10 | 12 | 0.002 | 9 | 13 | 0.006 | 21±5 | 3.684 | 0.001 |
| 指标 | n | PTTG1 | BFGF | MVD(个) | ||||||
| 阳性 | 阴性 | P 值 | 阳性 | 阴性 | P 值 | mean±SD | t值 | P值 | ||
| 性别 | ||||||||||
| 男性 | 13 | 12 | 1 | 11 | 2 | 28±6 | ||||
| 女性 | 28 | 22 | 6 | 0.521 | 20 | 8 | 0.600 | 26±6 | 0.520 | 0.606 |
| 年龄(岁) | ||||||||||
| >60 | 21 | 18 | 3 | 17 | 4 | 27±6 | ||||
| <60 | 20 | 16 | 4 | 0.943 | 14 | 6 | 0.651 | 27±7 | 0.009 | 0.993 |
| 结石 | ||||||||||
| 有 | 22 | 19 | 3 | 15 | 7 | 28±6 | ||||
| 无 | 19 | 15 | 4 | 0.831 | 16 | 3 | 0.408 | 26±7 | 1.11 | 0.274 |
| 病理类型 | ||||||||||
| 腺癌 | 36 | 30 | 6 | 26 | 10 | 27±7 | ||||
| 非腺癌 | 5 | 4 | 1 | 0.855 | 5 | 0 | 0.310 | 28±5 | 0.319 | 0.751 |
| 分化程度 | ||||||||||
| 高 | 17 | 12 | 5 | 9 | 8 | 26±8 | ||||
| 中 | 12 | 11 | 1 | 11 | 1 | 26±5 | ||||
| 低 | 12 | 11 | 1 | 0.144 | 11 | 1 | 0.015 | 29±5 | 0.680* | 0.513 |
| Nevin分期 | ||||||||||
| Ⅰ-Ⅲ | 8 | 4 | 4 | 3 | 5 | 21±6 | ||||
| Ⅳ-Ⅴ | 33 | 30 | 3 | 0.025 | 28 | 5 | 0.019 | 28±6 | 2.879 | 0.007 |
| 淋巴结转移 | ||||||||||
| 阳性 | 31 | 29 | 2 | 26 | 5 | 28±6 | ||||
| 阴性 | 10 | 5 | 5 | 0.007 | 5 | 5 | 0.081 | 23±7 | 2.350 | 0.024 |
胆囊癌组织中新生血管内皮细胞胞膜、胞质着色, 呈现棕黄色; 胆囊癌组织中新生血管分布不均匀(图3). 胆囊癌组织MVD值在高倍视野下(×500)为: 27±7个, 明显高于慢性胆囊炎组织MVD值: 21±5个, 差别有显著意义(t = 3.684, P = 0.001, 表1). Nevin Ⅳ-Ⅴ期胆囊癌组织MVD值: 28±6, 明显高于Ⅰ-Ⅲ期胆囊癌组织MVD值: 21±6, 差别有显著意义(t = 2.879, P = 0.007, 表2); 伴有淋巴结转移胆囊癌组织MVD值: 28±6, 不伴淋巴结转移胆囊癌组织MVD值: 23±7, 差别有显著意义(t = 2.350, P = 0.024, 表2). MVD与患者的性别、年龄、肿瘤的种类、分化程度、是否伴有胆囊结石均无关.
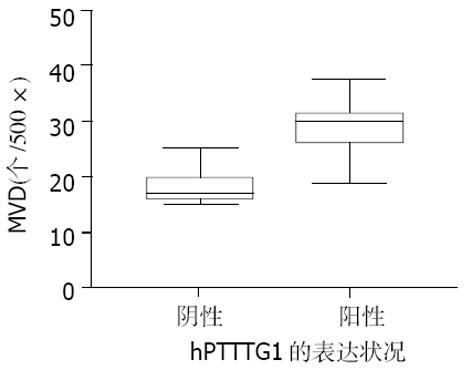
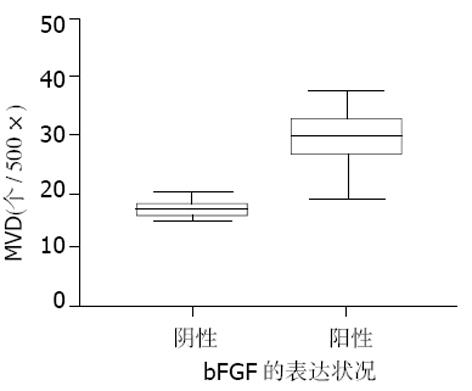
胆囊癌组织中表达hPTTG1组MVD值大于未表达hPTTG1组, 差别有显著意义(t = 4.113, P = 0.000, 图4), 表达hPTTG1组MVD值较未表达hPTTG1组的MVD值变异范围大(图4); 表达bFGF蛋白组MVD值大于未表达bFGF蛋白组, 差别有显著意义(t = 7.148, P = 0.000, 图5), 表达bFGF组MVD值较未表达bFGF组的MVD值变异范围大(图5).
垂体瘤转化基因(pttg), 可以在体外转化小鼠3T3细胞, 转化的3T3细胞在无胸腺裸鼠体内可以形成肿瘤[1]. 人垂体瘤转化基因1(hpttg 1)定位于5号染色体长臂, 5q35区, 其基因表达产物hPTTG1对人类细胞进行正常有丝分裂具有重要作用[16-17]. 过度表达的hPTTG会抑制有丝分裂M期姊妹染色体分离, 进而发生染色体异常, 产生异倍体[18-19]. hPTTG1仅在睾丸、胸腺、胚胎肝脏中高表达, 在其他正常组织中仅弱表达甚至检测不到, 在乳腺癌、结肠癌、子宫内膜癌、卵巢癌、淋巴瘤等肿瘤组织及肿瘤细胞系中高表达[4]. hPTTG1的表达与结肠癌、食管癌等肿瘤的恶性程度、转移及预后密切相关[20-21]. 我们发现: 在胆囊癌组织中, hPTTG1表达阳性率明显高于慢性胆囊炎(P<0.01). 在胆囊癌组织中hPTTG1 的表达阳性率同肿瘤病理分期有关, 在Nevin Ⅳ-Ⅴ期胆囊癌组织中表达阳性率明显高于Ⅰ-Ⅲ期胆囊癌组织(P<0.05). 在胆囊癌组织中hPTTG1 的表达阳性率还与淋巴结转移有关, 伴有淋巴结转移组hPTTG1表达阳性率明显高于无淋巴结转移组(P<0.01). 这表明hPTTG1的异常表达与胆囊癌的发生、发展及侵袭进程密切相关, hPTTG1是反映胆囊癌侵袭性的有用指标.
碱性成纤维细胞生长因子(bFGF)对肿瘤间质血管生成具有重要作用. bFGF在多种肿瘤组织中高表达, 并与肿瘤的浸润、转移和预后差密切相关[10-14]. 我们发现: 胆囊癌组织bFGF表达阳性率明显高于慢性胆囊炎组织(P<0.01). Nevin Ⅳ-Ⅴ期胆囊癌组织中bFGF蛋白表达阳性率明显高于Ⅰ-Ⅲ期(P<0.05). 中、低分化的胆囊癌组织bFGF表达阳性率明显高于高分化胆囊癌组织(P<0.05). 以上结果表明, bFGF异常表达与胆囊癌发生及胆囊癌细胞去分化有关, 是反映胆囊癌恶性程度的有用指标.
肿瘤生长与转移依赖于血管生成. 微血管密度(MVD)可以作为评估肿瘤血管生成的一个有用指标[8]. 我们发现, 胆囊癌组织MVD值大于慢性胆囊炎组织MVD值 (P<0.01), Nevin Ⅵ-Ⅴ期胆囊癌组织MVD值大于Ⅰ-Ⅲ期胆囊癌组织MVD值(P<0.01); 伴有淋巴结转移胆囊癌组织MVD值大于不伴有淋巴结转移的胆囊癌组织MVD值(P<0.05). 本研究结果提示: 同结、直肠癌[21-23]、胆管癌[24]等肿瘤组织一样, 胆囊癌组织中肿瘤新生血管形成与其肿瘤恶性程度及侵袭性密切相关. 我们的研究结果与牛新捷et al[25]、白涛et al[26]对胆囊癌组织MVD研究结果基本一致. 我们同时发现: 表达hPTTG1组较未表达hPTTG1组的MVD值大(P<0.001). 表达bFGF组较未表达bFGF组的MVD值大(P<0.001). 这表明在胆囊癌组织中肿瘤新生血管的形成同hPTTG1及bFGF的异常表达均密切相关. Melmed et al[21]对结肠癌组织中hPTTG1表达与MVD关系的研究结果与我们的研究结论一致.
我们发现胆囊癌组织中hPTTG1表达同bFGF表达存在正相关关系(r = 0.648, P<0.001). 对垂体肿瘤的研究表明, hPTTG1可以诱导bFGF表达, 而bFGF的表达又可上调hPTTG1的表达, 二者之间存在正反馈关系[7]. 我们的研究结果提示: 在胆囊癌组织中bFGF与hPTTG1可能也存在这样的协同作用. hPTTG1异常表达可能通过上调bFGF的表达间接诱导胆囊癌新生血管形成, 进而促进胆囊癌生长与转移.
原发性胆囊癌是胆道系统常见肿瘤, 其发病率近年有增加趋势[27-31]. 作为癌基因蛋白, hPTTG1具有转化功能, 促进肿瘤新生血管形成, 与bFGF协同参与肿瘤的发生、发展及侵袭进程. 我们认为hPTTG1异常表达在胆囊癌的发生、发展及侵袭进程中具有重要意义, 可能成为反映胆囊癌侵袭性的重要指标. 针对hpttg1基因及其表达产物的治疗, 有望为胆囊癌治疗提供一条新的途径.
编辑: N/A
| 1. | Pei L, Melmed S. Isolation and characterization of a pituitary tumor-transforming gene (PTTG). Mol Endocrinol. 1997;11:433-441. [PubMed] [DOI] |
| 2. | Zhang X, Horwitz GA, Prezant TR, Valentini A, Nakashima M, Bronstein MD, Melmed S. Structure, expression, and function of human pituitary tumor-transforming gene (PTTG). Mol Endocrinol. 1999;13:156-166. [PubMed] [DOI] |
| 3. | Chen L, Puri R, Lefkowitz EJ, Kakar SS. Identification of the human pituitary tumor transforming gene (hPTTG) family: molecular structure, expression, and chromosomal localization. Gene. 2000;248:41-50. [PubMed] [DOI] |
| 4. | Hamid T, Kakar SS. PTTG and cancer. Histol Histopathol. 2003;18:245-251. [PubMed] |
| 5. | Ishikawa H, Heaney AP, Yu R, Horwitz GA, Melmed S. Human pituitary tumor-transforming gene induces angiogenesis. J Clin Endocrinol Metab. 2001;86:867-874. [PubMed] [DOI] |
| 6. | McCabe C. Genetic targets for the treatment of pituitary adenomas: focus on the pituitary tumor transforming gene. Curr Opin Pharmacol. 2001;1:620-625. [PubMed] [DOI] |
| 7. | Faglia G, Spada A. Genesis of pituitary adenomas: state of the art. J Neurooncol. 2001;54:95-110. [PubMed] [DOI] |
| 8. | Teo NB, Shoker BS, Martin L, Sloane JP, Holcombe C. Angiogenesis in pre-invasive cancers. Anticancer Res. 2002;22:2061-2072. [PubMed] |
| 10. | Qin LX, Tang ZY. The prognostic molecular markers in hepatocellular carcinoma. World J Gastroenterol. 2002;8:385-392. [PubMed] [DOI] |
| 12. | Yu R, Melmed S. Oncogene activation in pituitary tumors. Brain Pathol. 2001;11:328-341. [PubMed] [DOI] |
| 13. | McCabe CJ, Khaira JS, Boelaert K, Heaney AP, Tannahill LA, Hussain S, Mitchell R, Olliff J, Sheppard MC, Franklyn JA. Expression of pituitary tumour transforming gene (PTTG) and fibroblast growth factor-2 (FGF-2) in human pituitary adenomas: relationships to clinical tumour behaviour. Clin Endocrinol (Oxf). 2003;58:141-150. [PubMed] [DOI] |
| 14. | Dow JK, deVere White RW. Fibroblast growth factor 2: its structure and property, paracrine function, tumor angiogenesis, and prostate-related mitogenic and oncogenic functions. Urology. 2000;55:800-806. [PubMed] [DOI] |
| 15. | Kakar SS, Chen L, Puri R, Flynn SE, Jennes L. Characterization of a polyclonal antibody to human pituitary tumor transforming gene 1 (PTTG1) protein. J Histochem Cytochem. 2001;49:1537-1546. [PubMed] [DOI] |
| 16. | Zou H, McGarry TJ, Bernal T, Kirschner MW. Identification of a vertebrate sister-chromatid separation inhibitor involved in transformation and tumorigenesis. Science. 1999;285:418-422. [PubMed] [DOI] |
| 17. | Cohen-Fix O. The making and breaking of sister chromatid cohesion. Cell. 2001;106:137-140. [PubMed] [DOI] |
| 18. | Honda S, Hayashi M, Kobayashi Y, Ishikawa Y, Nakagawa K, Tsuchiya E. A role for the pituitary tumor-transforming gene in the genesis and progression of non-small cell lung carcinomas. Anticancer Res. 2003;23:3775-3782. [PubMed] |
| 19. | Yu R, Lu W, Chen J, McCabe CJ, Melmed S. Overexpressed pituitary tumor-transforming gene causes aneuploidy in live human cells. Endocrinology. 2003;144:4991-4998. [PubMed] [DOI] |
| 20. | Shibata Y, Haruki N, Kuwabara Y, Nishiwaki T, Kato J, Shinoda N, Sato A, Kimura M, Koyama H, Toyama T. Expression of PTTG (pituitary tumor transforming gene) in esophageal cancer. Jpn J Clin Oncol. 2002;32:233-237. [PubMed] [DOI] |
| 21. | Heaney AP, Singson R, McCabe CJ, Nelson V, Nakashima M, Melmed S. Expression of pituitary-tumour transforming gene in colorectal tumours. Lancet. 2000;355:716-719. [PubMed] [DOI] |
| 27. | 石 景森, 杨 毅军, 王 作仁, 周 连锁, 王 林, 王 健生, 何 平, 卢 云, 孙 立江, 焦 兴元. 原发性胆囊癌44年诊治的临床回顾. 外科理论与实践. 2001;6:137-141. |
| 29. | Rashid A. Cellular and molecular biology of biliary tract cancers. Surg Oncol Clin N Am. 2002;11:995-1009. [DOI] |
| 30. | Misra S, Chaturvedi A, Misra NC, Sharma ID. Carcinoma of the gallbladder. Lancet Oncol. 2003;4:167-176. [PubMed] [DOI] |